HOC247 xin giới thiệu nội dung tài liệu Đề thi HK1 môn Hóa học 10 CTST có đáp án năm 2022-2023 Trường THPT Nguyễn Trãi giúp các em củng cố kiến thức, rèn luyện kỹ năng làm bài chuẩn bị cho kì thi HK1 sắp đến. Chúc các em đạt được kết quả thật tốt của bài thi này nhé!
|
TRƯỜNG THPT NGUYỄN TRÃI |
ĐỀ THI HỌC KÌ 1 MÔN HÓA HỌC 10 CTST NĂM HỌC 2022-2023 Thời gian làm bài: 45 phút |
Phần I: Trắc nghiệm
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự vận chuyển của máu trong hệ tuần hoàn.
B. Cấu tạo của chất và sự biến đổi của chất.
C. Tốc độ của ánh sáng trong chân không.
D. Sự tự quay của Trái Đất quanh trục riêng.
Câu 2: Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân.
B. Nguyên tử trung hòa về điện.
C. Proton và electron có khối lượng gần bằng nhau.
D. Nguyên tử có cấu trúc rỗng.
Câu 3: Một nguyên tử được đặc trưng cơ bản bằng
A. số proton và số đơn vị điện tích hạt nhân.
B. số proton và số electron.
C. số khối và số neutron.
D. số khối và số đơn vị điện tích hạt nhân.
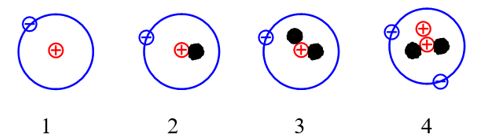
Câu 4: Cho những nguyên tử của các nguyên tố sau:
Những nguyên tử nào sau đây là đồng vị của nhau?
A. 1 và 2.
B. 2 và 3.
C. 1, 2 và 3.
D. 1, 2, 3 và 4.
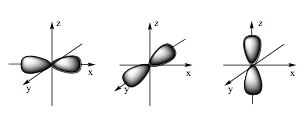
Câu 5: Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Câu 6: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
Câu 7: Nguyên tử nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. [Ne] 3s23p2.
B. [Ne] 3s23d2.
C. [He] 3s23p2.
D. [Ar] 3s23p2.
Câu 8: Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9: Số hiệu nguyên tử của nguyên tố hóa học bằng
A. số thứ tự của ô nguyên tố.
B. số thứ tự của chu kì.
C. số thứ tự của nhóm.
D. số electron lớp ngoài cùng của nguyên tử.
Câu 10: Chu kì 4 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
---(Để xem đầy đủ nội dung câu 11 đền câu 28 của Đề thi, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
Phần II: Tự luận
Câu 29: Viết cấu hình electron của các ion: K+, Mg2+, F–, S2–. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
Câu 30: Dựa vào giá trị độ âm điện, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, O2, H2 và NH3.
|
Nguyên tử |
Mg |
Al |
H |
N |
Cl |
Br |
O |
|
Độ âm điện |
1,31 |
1,61 |
2,20 |
3,04 |
3,16 |
2,96 |
3,44 |
Câu 31: Giải thích tại sao ở điều kiện thường, các nguyên tố nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
ĐÁP ÁN
Phần I: Trắc nghiệm
|
1B |
2C |
3D |
4C |
5B |
6D |
7A |
8A |
9A |
10B |
|
11C |
12B |
13B |
14C |
15D |
16A |
17B |
18B |
19D |
20C |
|
21B |
22A |
23B |
24B |
25D |
26D |
27A |
28B |
Câu 29:
- Cấu hình electron K+: 1s22s22p63s23p6 => giống cấu hình electron của khí hiếm argon.
- Cấu hình electron Mg2+: 1s22s22p6 => giống cấu hình electron của khí hiếm neon.
- Cấu hình electron F–: 1s22s22p6 => giống cấu hình electron của khí hiếm neon.
- Cấu hình electron S2–: 1s22s22p63s23p6 => giống cấu hình electron của khí hiếm argon.
Câu 30:
- MgCl2: Δχ = 3,16 − 1,31 = 1,85 > 1,7 ⇒Δχ = 3,16 − 1,31 = 1,85 > 1,7 ⇒ liên kết ion.
- AlCl3: 0,4<Δχ = 3,16 − 1,61 = 1,55 < 1,7 ⇒0,4 < Δχ = 3,16 − 1,61 = 1,55 < 1,7 ⇒ liên kết cộng hóa trị phân cực.
- HBr: 1,7 > Δχ = 2,96 − 2,20 = 0,76 > 0,4 ⇒ 1,7 > Δχ = 2,96 − 2,20 = 0,76 > 0,4 ⇒ liên kết cộng hóa trị phân cực.
- O2, H2 liên kết cộng hóa trị không phân cực do được hình thành từ hai nguyên tử giống nhau.
- NH3: 1,7 > Δχ = 3,04 − 2,20 = 0,84 > 0,4 ⇒ 1,7 > Δχ = 3,04 − 2,20 = 0,84 > 0,4 ⇒ liên kết cộng hóa trị phân cực.
Câu 31:
Khi đi từ F2 đến I2, do khối lượng các phân tử tăng dần làm tương tác van der Waals giữa các phân tử halogen cũng tăng dần, nên fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Trên đây là một phần trích đoạn nội dung Đề thi HK1 môn Hóa học 10 CTST có đáp án năm 2022-2023 Trường THPT Nguyễn Trãi. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Các em quan tâm có thể tham khảo tài liệu cùng chuyên mục:
- Đề cương ôn tập HK1 môn Hóa học 10 CTST năm 2022-2023
- Đề thi HK1 môn Hóa học 10 KNTT có đáp án năm 2022-2023 Trường THPT Chu Văn An
Chúc các em học tập tốt !