Nhằm giúp các em có thêm tài liệu tham khảo, chuẩn bị thật tốt cho kì thi sắp đến. Hoc247 đã tổng hợp nội dung Bài toán về độ tan và tinh thể hyđrat môn Hóa học 10 năm 2021 dưới đây. Mời các em cùng tham khảo!
1. KIẾN THỨC CƠ BẢN
1.1. Công thức toán:
\({S_{}} = \frac{{{m_{ct}}}}{{{m_{{H_2}O}}}} \cdot 100\) (gam/ 100g H2O)
\(S = \frac{{C\% }}{{100 - C\% }} \cdot 100\) (C% là nồng độ % của dung dịch bão hòa)
\(C\% = \frac{S}{{100 + S}} \cdot 100\% \) (C% là nồng độ % của dung dịch bão hòa)
1.2. Bài toán xác định lượng kết tinh.
* Khi làm lạnh một dung dịch bão hòa chất tan rắn thì độ tan thường giảm xuống, vì vậy có một phần chất rắn không tan bị tách ra ( gọi là phần kết tinh):
+ Nếu chất kết tinh không ngậm nước thì lương nước trong hai dung dịch bão hòa bằng nhau.
+ Nếu chất rắn kết tinh có ngậm nước thì lượng nước trong dung dịch sau ít hơn trong dung dịch ban đầu:
\({m_{{H_2}O}}({\rm{dd }}sau) = {m_{{H_2}O}}{\rm{ }}({\rm{dd bđ) - }}{{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}{\rm{ (KT) }}\)
* Các bước giải toán:
|
TH1: Chất kết tinh không ngậm nước |
TH 2: Chất kết tinh ngậm nước |
|
B1: Xác định và có trong ddbh ở t0 cao. B2: Xác định có trong ddbh ở t0 thấp ( lượng nước không đổi) \({m_{ct}} = \frac{S}{{100}} \cdot {m_{{H_2}O}}\) B3: Xác định lượng chất kết tinh: mKT = mCT (nhiệt độ cao) – mCT(nhiệt độ thấp)
|
B1: Xác định và có trong ddbh ở t0 cao. B2: Đặt số mol của hiđrat bị kết tinh là a (mol) → mCT (KT) vào mH2O (KT) B3: Lập phương trình biểu diễn độ tan của dung dịch sau ( theo ẩn a) \({S_2} = \frac{{\Delta {m_{ct}}}}{{\Delta {m_{{H_2}O}}}} \cdot 100\) B4: Giải phương trình và kết luận. |
* Phương pháp giải thông minh:
Có thể giải được các bài toán xác định dượng kết tinh bằng phương pháp đường chéo. Muốn làm được điều này chúng ta phải đặt giả thiết ngược.
Rắn (KT)
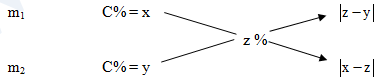
Suy ra ta có \(\frac{{{m_1}}}{{{m_2}}} = \frac{{\left| {z - y} \right|}}{{\left| {x - z} \right|}}\)
Nếu biết khối lượng dung dịch ban đầu thì ta hoàn toàn tính được khối lượng chất rắn kết tinh ( dù chất này có ngậm nước hay không ngậm nước)
Chú ý:
Muốn xác định kết tủa (của chất ít tan) có tồn tại hay không thì cần xét nồng độ của dung dịch thu được đã đến nồng độ bão hòa hay chưa. Nếu chưa thì kết tủa không tồn tại, ngược lại thì kết tủa tồn tại.
2. BÀI TẬP ÁP DỤNG:
Bài 1: Làm lạnh 600g ddbh NaCl từ 900C → 100C thì có bao nhiêu gam tinh thể NaCl tách ra. Biết độ tan của NaCl ở 900C và 100C lần lượt là : 50gam ; 35 gam.
Hướng dẫn :
* Ở 900C có T = 50 gam nên ta có : 100gam H2O + 50g NaCl → 150g ddbh
? ? 600g
\({m_{NaCl}}(\tan ) = \frac{{600 \cdot 50}}{{150}} = 200g\) → \({m_{{H_2}O}}({\rm{dung moi}}) = 600 - 200 = 400g\) (không đổi)
* Ở 100C có T = 35 g nên ta có : 100 gam H2O hoà tan được 35 g NaCl
400g → ?
→ \({m_{NaCl}}(\tan ) = \frac{{400 \cdot 35}}{{100}} = 140g\)
Khối lượng NaCl kết tinh: 200 – 140 = 60 gam
Bài 2: Độ tan của CuSO4 ở 850C và 120C lần lượt là 87,7g và 35,5g . Khi làm lạnh 1887 gam dung dịch bão hoà CuSO4 từ 800C → 120C thì có bao nhiêu gam tinh thể CuSO4.5H2O tách ra khỏi dung dịch.
Hướng dẫn:
Lưu ý vì chất kết tinh ngậm nước nên lượng nước trong dung dịch thay đổi
Ở 850C , 87,7 gam → 187,7 gam ddbh có 87,7 gam CuSO4 + 100g H2O
1887g ---------------→ 887gam CuSO4 + 1000g H2O
Gọi x là số mol CuSO4.5H2O tách ra
→ khối lượng H2O tách ra : 90x (g)
Khối lượng CuSO4 tách ra : 160x( gam)
Ở 120C, 35,5 nên ta có phương trình \(\frac{{887 - 160x}}{{1000 - 90x}} = \frac{{35,5}}{{100}}\) giải ra x = 4,08 mol
Khối lượng CuSO4 .5H2O kết tinh 250.4,08 =1020 gam
Bài 3: Cho 0,2 mol CuO tan hoàn toàn trong H2SO4 20% đun nóng, sau đó làm nguội dung dịch đến 100C. Tính khối lượng tinh thể CuSO4. 5H2O đã tách ra khỏi dung dịch, biết rằng độ tan của CuSO4 ở 100C là 14,4 gam/100g H2O.
Hướng dẫn :
CuO + H2SO4 → CuSO4 + H2O
0,2 0,2 0,2 0,2 ( mol)
Khối lượng ddH2SO4 :\(\frac{{0,2 \cdot 98 \cdot 100\% }}{{20}}\) = 98g
Khối lượng CuSO4 tạo ra : 0,2.160 = 32 gam
Gọi x là số mol CuSO4.5H2O tách ra → mdd (sau pư ) = (0,2.80) + 98 – 250x ( gam)
Vì độ tan của CuSO4 ở 100C là T = 14,4 gam , nên ta có :
\(\frac{{32 - 160x}}{{112 - 250x}} = \frac{{14,4}}{{114,4}}\) giải ra x = 0,1228 mol → \({m_{CuS{O_4}.5{H_2}O}}(KT) = 30,7\) gam
3. LUYỆN TẬP
1) Có 600 gam dung dịch KClO3 bão hoà ( 200C) nồng độ 6,5% cho bay bớt hơi nước sau đó lại giữ hỗn hợp ở 200C ta được một hỗn hợp có khối lượng chung là 413gam.
a) Tính khối lượng chất rắn kết tinh
b) Tính khối lượng nước và khối lượng KClO3 trong dung dịch còn lại.
2) Có 540 g ddbh AgNO3 ở 100C, đun nóng dd đến 600C thì phải thêm bao nhiêu gam AgNO3 để đạt bảo hoà. Biết độ tan AgNO3 ở 100C và 600C lần lượt là 170g và 525gam.
3) Xác định lượng kết tinh MgSO4.6H2O khi làm lạnh 1642g ddbh từ 800C xuống 200C. Biết độ tan của MgSO4 là 64,2 g ( 800C) và 44,5g (200C).
4) Cho biết nồng độ dd bão hòa KAl(SO4)2 ở 200C là 5,56%
a) Tính độ tan của KAl(SO4)2 ở 200C
b) Lấy m gam dung dịch bão hoà KAl(SO4)2 .12H2O ở 200C để đun nóng bay hơi 200g nước, phần còn lại làm lạnh đến 200C . Tính khối lượng tinh thể phèn KAl(SO4)2 .12H2O kết tinh.
5) Cho biết độ tan của CaSO4 là 0,2 gam/100g nước ở nhiệt độ 200C và khối lượng riêng của dung dịch bão hoà CaSO4 ở 200C là D =1g/ml. Nếu trộn 50ml dung dịch CaCl2 0,012M với 150ml dung dịch Na2SO4 0,04M ( ở 200C) thì có kết tủa xuất hiện hay không ?
6) Ở 120C có 1335gam dung dịch bão hoà CuSO4 . Đun nóng dung dịch lên đến 900C. Hỏi phải thêm vào dung dịch bao nhiêu gam CuSO4 nữa để được dung dịch bão hoà ở nhiệt độ này.
Biết độ tan CuSO4 ở 120C và 900C lần lượt là 33,5g và 80g
7) Thêm dẫn dung dịch KOH 33,6% vào 40,3ml dung dịch HNO3 37,8% ( D = 1,24 g/ml) đến khi trung hoà hoàn toàn thì thu được dung dịch A. Đưa dung dịch A về 00C thì được dung dịch B có nồng độ 11,6% và khối lượng muối tách ra là m (gam). Hãy tính m và cho biết dung dịch B đã bão hoà chưa ? vì sao ?
Trên đây là trích đoạn nội dung Bài toán về độ tan và tinh thể hyđrat môn Hóa học 10 năm 2021, để theo dõi nhiều tài liệu tham khảo hữu ích khác vui lòng đăng nhập vào hệ thống hoc247.net chọn chức năng xem online hoặc tải về máy!
Chúc các em học tập thật tốt!













