HOC247 xin giới thiệu đến quý thầy cô giáo và các em học sinh Chuyên đề về cấu tạo nguyên tử - phân tử - ion môn Hóa học 10 năm 2021, tài liệu sẽ giúp các em luyện tập, làm quen các dạng đề đồng thời đối chiếu kết quả, đánh giá năng lực bản thân từ đó có kế hoạch học tập phù hợp. Mời các em cùng tham khảo!
I. KIẾN THỨC CƠ BẢN:
1.1. Nguyên tử
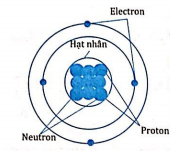
Trong đó, số electron bằng số proton.
1.2. Hạt nhân nguyên tử
Hạt nhân nguyên tử bao gồm proton mang điện tích dương và nơtron không mang điện. Hai hạt này có khối lượng xấp xỉ gần bằng nhau:
\({m_p} = 1,{6726.10^{ - 27}}kg;{m_n} = 1,{6749.10^{ - 27}}kg\)
Hạt nhân có khối lượng rất nhỏ nhưng hầu hết khối lượng nguyên tử tập trung ở hạt nhân do khối lượng của electron lớp vỏ không đáng kể (\({m_e} = 9,{1.10^{ - 31}}kg\) )
Nhận xét: Khối lượng nguyên tử xấp xỉ bằng khối lượng nguyên tử và bằng tổng khối lượng của proton và noton.
Số khối
A là số khối, N là số nơtron và P là số proton.
A = N + Z
Lưu ý: Mối quan hệ giữa proton và nơtron trong hạt nhân (áp dụng cho các đồng vị bền tương ứng với \(Z \le 82\))
\(Z \le N \le 1,52Z\)
STYDY TIP: Để việc tính toán thuận tiện, đôi khi ta lấy con số 1,52 thành 1,5 bài toán không thay đổi gì quá nhiều.
1.3. Đồng vị
Là những nguyên tố của cùng một nguyên tố hóa học, nghĩa là có cùng số proton p nhưng số khối khác nhau (cùng Z khác A → N khác nhau)
Nguyên tử khối trung bình (kí hiệu \(\overline A \)): Trong tự nhiên hầu hết các nguyên tố hóa học đều có nhiều đồng vị nên phải lấy nguyên tử khối trung bình của hỗn hợp đồng vị tính theo tỉ lệ phần trăm của mỗi đồng vị
Chú ý: Nếu nguyên tố có 2 đồng vị thì ta có công thức \(A = {A_1}x + {A_2}(1 - x)\)
II. PHƯƠNG PHÁP GIẢI CÁC DẠNG BÀI TẬP ĐIỂN HÌNH
Gọi số p,n,e trong nguyên tử lần lượt là Z, N, E (nguyên dương)
Công thức cần ghi nhớ
Z = E
Tổng số hạt (S) = Z + N + E = 2Z + N
Số hạt mang điện là: Z+E = 2Z
Số hạt không mang điện: N
2.1. Dạng 1: Bài tập cơ bản về các hạt cơn bản cấu tạo nên nguyên tử
Nếu bài toán cho dữ kiện về tổng số hạt và một vài yếu tố khác thì ta giải theo 2 cách sau:
Với đồng vị bền ( \(20 < Z \le 80\) ) hoặc \(S > 60\) thì ta có \(Z \le N \le 1,52Z\) hay \(\frac{S}{{3,52}} \le Z \le \frac{S}{3}\)
Với đồng vị bền (\(1 \le Z \le 20\)) hoặc \(S \le 60\) thì ta có \(Z \le N \le 1,22Z\) hay \(\frac{S}{{3,52}} \le Z \le \frac{S}{3}\)
Nếu bài toán cho 2 dữ kiện là tổng số hạt và tổng số hạt nhân mang điện, không mang điện thì lập các phương trình và giải bình thường.
Nếu bài cho tổng số hạt và biết số N lớn hơn số Z không nhiều hay hơn 1,2 đơn vị, ta có thể tính Z bằng cách lấy tổng số hạt trong nguyên tử chia 3. Lấy Z chính là số nguyên sát dưới kết quả vừa tính được.
Nếu bài toán cho số hạt trong ion thì ta vẫn gọi số p,n,e trong nguyên tử của nó là Z, N, E. Sau đó tính số hạt electron trong ion đó theo E và điện tích của ion:
Với ion là thì có số electron bằng E – a.
Với ion là thì có số electron bằng E + b.
STUDY TIP: Nếu bài toán cho số hạt trong 1 phân tử gồm nhiều nguyên tố khác loại hoặc ion đa nguyên tử thì ta sẽ gọi số p, n, e trong mỗi loại nguyên tử đó là sau đó tiến hành lập các phương trình đưa về phương trình 4 ẩn.
2.2. Dạng 2: Các bài tập cơ bản liên quan tới đồng vị
Nếu bài toán cho phần trăm các đồng vị yêu cầu xác định nguyên tử khối trung bình hoặc ngược lại thì ta áp dụng công thức tính nguyên tử khối trung bình để tính
a. Nguyên tử khối trung bình
Nguyên tử A có các đồng vị \({A_1},{A_2},...,{A_n}\) tương ứng lần lượt với tỉ lệ số lượng đồng vị là \({x_1},{x_2},...,{x_n}\)
\(\overline {{M_A}} = \frac{{{A_1}{x_1} + {A_2}{x_2} + ... + {A_n}{x_n}}}{{{x_1} + {x_2} + ... + {x_n}}}\) (*)
Chú ý:
- \({x_1},{x_2},...,{x_n}\) cũng có thể tương ứng là số lượng các đồng vị.
+ Nếu \({x_1},{x_2},...,{x_n}\) = 1 thì công thức (*) trở thành: \(\overline M = {A_1}{x_1} + {A_2}{x_2} + ... + {A_n}{x_n}\)
+ Nếu \({x_1},{x_2},...,{x_n}\) = 100% thì công thức (*) trở thành: \(\overline M = \frac{{{A_1}{x_1} + {A_2}{x_2} + ... + {A_n}{x_n}}}{{100}}\)
Nếu bài toán cho nguyên tử khối trung bình và phần trăm đồng các đồng vị yêu cầu tính số khối của các đồng vị thì ta căn cứ vào giả thiết lập hệ giải các ẩn A1, A2
Nếu bài toán yêu cầu tính phần trăm khối lượng đồng vị trong hợp chất thì ta là các bước như sau:
Xác định nguyên tử khối trung bình của các nguyên tố và phần trăm các đồng vị.
Tính phần trăm đồng vị: % khối lượng đồng vị = (Khối lượng đồng vị : Phân tử khối).100%
Cụ thể, nguyên tố X có nguyên tử khối là A, đồng vị X1 của nguyên tố X có số khối là A1 và phần trăm số lượng của đồng vị X1 là x1% thì phần trăm khối lượng của đồng vị X1 trong hợp chất là:
\(\% {m_{{x_1}({A_a}{B_b}{C_c})}} = \frac{{a.{x_1}\% .{A_1}}}{{{M_{{A_a}{B_b}{C_c}}}}}.100\% = \frac{{a.{x_1}\% .{A_1}}}{{a.A + b.B + c.C}}.100\% \)
b. Bài toán tìm số hợp chất được tạo thành bởi các đồng vị của 2 nguyên tố
Bài toán tổng quát: Nguyên tố X có a đồng vị. Nguyên tố Y có b đồng vị. Trong tự nhiên có thể có bao nhiêu phân tử \({X_n}{Y_m}\) cấu tạo từ các đồng vị trên.
Cách giải:
Đối với chương trình đại học thì ta thường hay gặp các phân tử
Trường hợp 1: XY
Khi đó ta có số phân tử là: a.b
Trường hợp 2: X2Y
Phương pháp 1: Liệt kê (với phân tử có số lượng các nguyên tử thì đơn giản nhưng với những phân tử có những phân tử lớn thì quá trình diễn ra phức tạp, tốn thời gian và dễ sai)
Phương pháp 2: Sử dụng toán tổ hợp xác suất
Số cách chọn 2 đồng vị của X trong số a đồng vị là
Số các chọn 1 đồng vị của Y là : b
→ Số phân tử X2Y được tạo thành từ các đồng vị của X và Y là: \((a + C_a^2).b\)
Trường hợp 3: Tương tự trường hợp 2.
STUDY TIP: Với các bạn đang học lớp 10 chưa được học phần tổ hợp xác suất thì các bạn có thể làm theo phương pháp liệt kê hoặc tạm hiểu và nhớ công thức với cách ẩn trên máy tính như sau:
Đối với máy tính Fx-570Es PLUS hoặc Fx-570 VN PLUS: a_SHIFT_+_2
Đối với máy tính Fx-500:a_nCr_2
III. VÍ DỤ MINH HỌA
Bài 1: Một nguyên tử của nguyên tố X có tổng số hạt cơ bản (e; p ; n) là 95. Xác định nguyên tử X biết rằng X có số khối chia hết cho 5.
Lời giải
Theo bài ra ta có \(Z + E + N = 95 \Rightarrow 2Z + N = 95 \Rightarrow N = 95 - 2Z\)
Mặt khác có \(Z \le N \le 1,52N \Rightarrow \left\{ \begin{array}{l}
52 - 2Z \ge Z\\
52 - 2Z \le 1,52Z
\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}
Z \le 31,67\\
Z \le 26,98
\end{array} \right.\)
Số khối của X chia hết cho 5 nên ta có:
Xét \(Z = 27 \Rightarrow A = 68\) (loại)
Xét \(Z = 28 \Rightarrow A = 67\) (loại)
Xét \(Z = 29 \Rightarrow A = 66\) (loại)
Xét \(Z = 30 \Rightarrow A = 65\) (thỏa mãn) X là Zn
Xét \(Z = 31 \Rightarrow A = 64\) (loại)
Chú ý: Đối với các dạng toán có \(20 < Z \le 82\) giá trị của Z thường giới hạn trong khoảng xác định với hiệu hai đầu mút lớn hơn 1 nên Z sẽ nhận nhiều giá trị vì vậy ta phải dựa vào dữ kiện bài toán cho để loại các trường hợp không đúng.
Bài 2: Một nguyên tử của nguyên tố X có tổng số hạt cơ bản (e; p ; n) là 52. Xác định nguyên tử X.
Lời giải
Do S < 60 nên áp dụng công thức \(\frac{S}{{3,22}} \le Z \le \frac{S}{3}\) .
Ta có \(16,149 \le Z \le 17,333 \Rightarrow Z = 17\)
Vậy Z là Cl.
Bài 3: Nguyên tử R có tổng số hạt cơ bản là 34 trong số hạt mang điện nhiều gấp 1,833 lần số hạt không mang điện. Xác định kí hiệu nguyên tử của nguyên tử R.
Lời giải
Theo giả thiết ta có:
\(\left\{ \begin{array}{l}
2Z + N = 34\\
2Z = 1,833N
\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}
Z = 11\\
N = 12
\end{array} \right. \Rightarrow A = 11 + 12 = 23\)
→ R là Na. Vậy kí hiệu nguyên tử của R là: \({}_{11}^{23}Na\)
---(Nội dung đầy đủ, chi tiết từ của tài liệu vui lòng xem tại online hoặc đăng nhập để tải về máy)---
IV. BÀI TẬP RÈN LUYỆN KỸ NĂNG
Câu 1: Đồng có 2 đồng vị (chiếm 69,1% tổng số đồng vị) và . Nguyên tử khối trung bình của Cu là:
A. 64,000 (u) B. 63,542 (u) C. 64,382 (u) D. 63,618 (u)
Câu 2: Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y, biết tổng số khối là 128. Số nguyên tử đồng vị X bằng 0,37 số nguyên tử đồng vị Y. Vậy số khối của X và Y lần lượt là
A. 65 và 67 B. 63 và 66 C. 64 và 66 D. 63 và 65
Câu 3: Nguyên tố Bo có 2 đồng vị (x1%) và (x2%). . Giá trị của x1% là:
A. 80% B. 20% C. 10,8% D. 89,2%
Câu 4: Trong tự nhiên oxi có 3 đồng vị (x1%), (x2%), (4%), nguyên tử khối trung bình của oxi là 16,14. Phần trăm đồng vị và lần lượt là:
A. 35% và 61% B. 90% và 6%
C. 80% và 16% D. 25% và 71%
Câu 5: Một nguyên tố X có 3 đồng vị (79%), (10%), (11%). Biết tổng số khối của 3 đồng vị là 75, nguyên tử khối trung bình của 3 đồng vị là 24,32. Mặt khác số nơtron của đồng vị thứ 2 nhiều hơn số nơtron đồng vị 1 là 1 đơn vị. A1, A2, A3 lần lượt là:
A. 24; 25; 26 B. 24; 25; 27
C. 23; 24; 25 D. 25; 26; 24
Câu 6: Một nguyên tử X có tổng số hạt p, n, e bằng 40. Trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Số khối của nguyên tử X là:
A. 13 B. 40 C. 14 D. 27
Câu 7: Nguyên tố X có 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm các đồng vị như nhau, các loại hạt trong X1 bằng nhau. Nguyên tử khối trung bình của X là:
A. 15 B. 14 C. 12 D. ĐA khác
Câu 8: Cho 5,85 gam muối NaX tác dụng với dung dịch AgNO3 dư ta thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị (x1%) và (x2%). Vậy giá trị của và lần lượt là:
A. 25% và 75% B. 75% và 25%
C. 65% và 35% D. 35% và 65%
Câu 9: Trong phân tử M2X có tổng số hạt p, n, e là 140, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của M lớn hơn số khối của X là 23. Tổng số hạt p, n, e trong nguyên tử M nhiều hơn trong nguyên tử X là 34 hạt. Công thức phân tử của M2X là
A. K2O B. Rb2O C. Na2O D. Li2O
Câu 10: Trong phân tử MX2 có M chiếm 46,67% về khối lượng. Hạt nhân M có số nơtron nhiều hơn số proton là 4 hạt. Trong nhân X số nơtron bằng số proton. Tổng số proton trong phân tử MX2 là 58. Công thức phân tử của MX2 là
A. FeS2 B. NO2 C. SO2 D. CO2
Câu 11: Nguyên tử của nguyên tố R có tổng số hạt p, n, e bằng 18 và tổng số hạt không mang điện bằng trung bình cộng của tổng số hạt mang điện. Vậy số electron độc thân của nguyên tử R là
A. 1 B. 2 C. 3 D. 4
Câu 12: R có tổng số hạt p, n, e bằng 34, hiệu số hạt nơtron và electron là 1. Số e độc thân của R là:
A. 3 B. 4 C. 2 D. 1
Câu 13: Tổng số hạt p, n, e của một nguyên tử bằng 155. Số hạt mang điện nhiều hơn số hạt không mang điện là 33. Số khối của nguyên tử đó là:
A. 108 B. 148 C. 188 D. 150
Câu 14: Tổng số hạt p, n, e của một nguyên tử bằng 40. Đó là nguyên tử của nguyên tố nào sau đây?
A. Ca B. Ba C. Al D. Fe
Câu 15: Nguyên tử X có tổng số hạt p, n, e là 52 và số khối là 35. Số hiệu nguyên tử của X là
A. 17 B. 18 C. 34 D.52
Câu 16: Nguyên tử X có tổng số hạt p, n, e là 34 và số khối là 23. Số lớp và số e lớp ngoài cùng lần lượt là
A. 3 và 1 B. 2 và 1 C. 4 và 1 D. 1 và 3
Câu 17: Cho 10 gam ACO3 tác dụng với dung dịch HCl dư thì thu được 2,24 lít khí CO2 (đktc). Cấu hình electron của A là (biết A có số hạt proton bằng số hạt nơtron)
A. 1s22s22p6 B. 1s22s22p63s2
C. 1s22s22p63s23p4 D. [Ar]4s2
Câu 18: Oxi có 3 đồng vị với hàm lượng phần trăm số nguyên tử tương ứng cho như bảng dưới.
|
Đồng vị |
|
|
|
|
% |
99,757% |
0,038% |
0,205% |
Nguyên tử khối trung bình của Oxi bằng
A. 16,00436 B. 15,99938
C. 16,00448 D. 15,99925
Câu 19: Tổng số hạt mang điện trong anion bằng 82. Số hạt proton trong hạt nhân nguyên tử X nhiều hơn số hạt proton trong hạt nhân nguyên tử Y là 8 hạt. Số hiệu nguyên tử của X,Y lần lượt là
A. 16 và 8. B. 15 và 7. C. 14 và 8. D. 17 và 9.
Câu 20: Hai nguyên tử X và Y có tổng số hạt cơ bản proton, nơtron, electron là 142. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 142. Trong đó tổng số hạt mang điệm nhiều hơn số hạt không mang điện là 42. Tỉ lệ số proton của ion X2+ và Y3+ ion là 10/13. Ở trạng thái cơ bản số electron độc thân của nguyên tử X và ion Y3+ lần lượt là
A. 2 và 3 B. 0 và 4 C. 0 và 5 D. 2 và 4
Câu 21: Hợp chất A được tạo từ cation M2+ và anion X2-. Tổng số hạt trong A là 84. Trong A số hạt mang điện lớn hơn số hạt không mang điện là 28 hạt. Số hạt mang điện trong ion M2+ lớn hơn số hạt mang điện trong ion X2- là 20. Xác định chất A:
A. CaO B. MgS C. CuS D. MgO
Câu 22: Tổng số proton, nơtron, electron trong phân tử XY2 là 96. Số khối của nguyên tử Y bằng 0,6 lần số proton của nguyên tử X. Số khối của nguyên tử X nhiều hơn số hạt mang điện của Y là 28. Y là
A. Cl (Z=17) B. C (Z=6)
C. S (Z=16) D. F (Z=9)
Câu 23: Tổng số proton, nơtron và electron trong nguyên tử X bằng 1,4375 lần số hạt mang điện của nguyên tử Y. Tổng số proton, nơtron, electron trong nguyên tử Y bằng 1,6 lần số hạt mang điện của nguyên tử X. Tổng số nơtron trong 1 nguyên tử X và 1 nguyên tử Y bằng số hạt mang điện của Y. Tỉ lệ số hạt mang điện giữa X và Y là
A. 15:16 B. 16:15 C. 2:5 D. 5:2
Câu 24: Tổng số proton, nơtron và electron trong nguyên tử X bằng 3,75 lần số hạt mang điện của nguyên tử Y. Tổng số proton, nơtron, electron trong nguyên tử Y bằng 0,65 lần số hạt mang điện của nguyên tử X. Tổng số nơtron trong 1 nguyên tử X và 1 nguyên tử Y bằng 1,875 lần số hạt mang điện của Y. Tỉ lệ số hạt mang điện giữa X và Y là
A. 15:16 B. 16:15 C. 2:5 D. 5:2
Câu 25: Clo có 2 đồng vị và với nguyên tử khối trung bình của clo là 35,4846. Phần trăm khối lượng trong NaClO3 (với và ) là:
A. 8,42% B. 23,68% C. 24,90% D. 10,62%
Câu 26: Trong phân tử , M chiếm (1550/63)% khối lượng. Số proton của M bằng 1,5 lần số nơtron của A. Số proton của A bằng 0,5625 lần số nơtron của M. Tổng số nơtron trong MAy là 66. Số khối của MAy là:
A. 202 B. 88 C. 161 D. 126
Câu 27: Trong tự nhiên đồng vị chiếm 24,23% số nguyên tử clo. Nguyên tử khối trung bình của clo bằng 35,5. Thành phần phần trăm về khối lượng của có trong HClO4 là (với , ):
A. 9,82%. B. 8,65%. C. 8,56% D. 8,92%
Câu 28: Trong thiên nhiên, hiđro có 3 đồng vị với số khối lần lượt là 1, 2, 3 và oxi có 3 đồng vị có số khối lần lượt là 16, 17, 18. Số loại phân tử H2O tối đa có thể hình thành từ các đồng vị trên là:
A. 12 B. 27 C. 18 D. 24
Câu 29: Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị trong 1ml nước (cho rằng trong nước chỉ có hai đồng vị và ). Biết rằng và nguyên tử khối của oxi là 16.
A. 3,01.1023. B. 6,02.1023
C. 5,35.1020 D. 2,67.1020
Câu 30: Một hỗn hợp gồm 2 đồng vị có nguyên tử lượng trung bình là 31,1 đvC, với tỉ lệ mỗi đồng vị là 90% và 10%. Tổng số các hạt trong 2 đồng vị là 93 và số hạt không mang điện bằng 0,55 lần số hạt mang điện. Tổng số nơtron có trong 2 đồng vị là:
A. 31 B. 32 C. 33 D.34
HƯỚNG DẪN GIẢI CHI TIẾT
|
1.D |
2.B |
3.A |
4.B |
5.A |
6.D |
7.D |
8.B |
9.A |
10.A |
|
11.D |
12.D |
13.A |
14.C |
15.A |
16.A |
17.D |
18.C |
19.A |
20.C |
|
21.A |
22.B |
23.A |
24.D |
25.C |
26.D |
27.D |
28.C |
29.C |
30.B |
Trên đây là một phần trích dẫn nội dung Chuyên đề về cấu tạo nguyên tử - phân tử - ion môn Hóa học 10 năm 2021. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Chúc các em học tốt!












