HỌC247 xin giới thiệu đến các em Ôn tập chuyên đề nhóm Halogen môn Hóa học 10 năm 2021. Tài liệu được biên soạn nhằm giới thiệu đến các em học sinh các bài tập trắc ngiệm, ôn tập lại kiến thức chương trình môn Hóa học. Hi vọng đây sẽ là 1 tài liệu tham khảo hữu ích trong quá trình học tập của các em.
1. KIẾN THỨC CẦN NHỚ
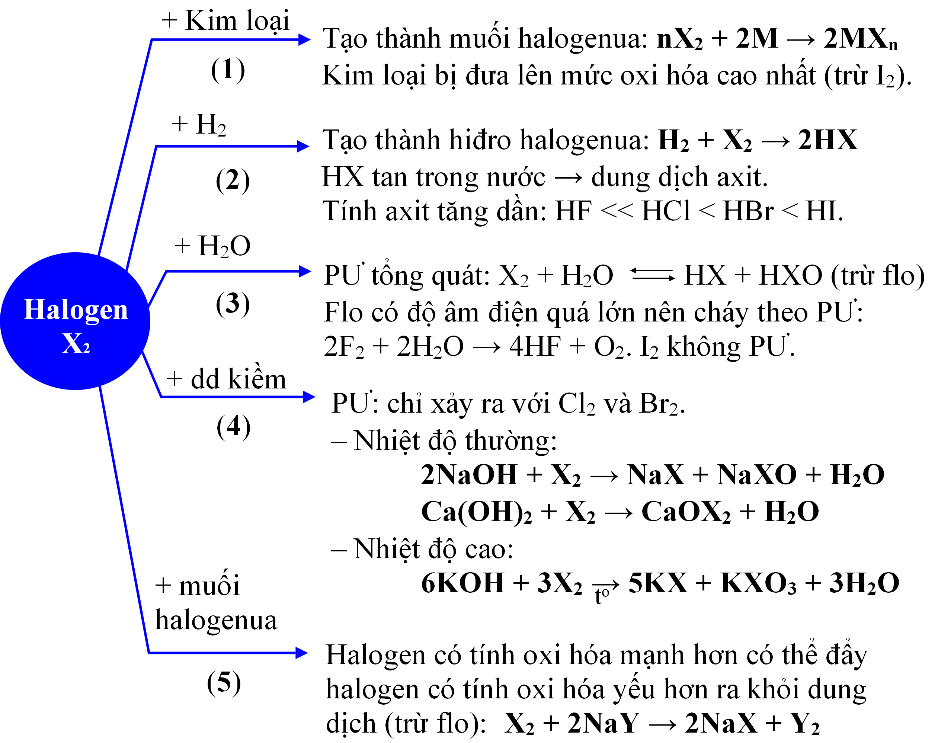
1.1. Tính chất của halogen
1.2. Tính chất của hiđro halogenua
a. Hiđro halogenua
- Tất cả đều là chất khí, tan nhiều trong nước, điện li hoàn toàn (trừ HF) tạo thành dung dịch axit mạnh.
- Thứ tự tính axit và tính khử tăng dần: HF < HCl < HBr < HI
- Tính axit mạnh của HCl, HBr và HI:
+ Làm quỳ tím chuyển thành màu đỏ.
+ Tác dụng với kim loại đứng trước H → muối trong đó kim loại có hóa trị thấp + H2.
Fe + 2HCl → FeCl2 + H2
+ Tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
(HI + muối sắt (III) → muối sắt (II) + I2)
+ Tác dụng với bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
+ Tác dụng với muối → muối mới + axit mới
Na2CO3 + 2HBr → 2NaBr + H2O + CO2
- Tính khử thể hiện khi tác dụng với các chất oxi hóa mạnh (xem phần điều chế Clo).
- HF có tính chất riêng là ăn mòn thủy tinh:
4HF + SiO2 → SiF4 + 2H2O
b. Muối halogenua
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2Cl2. Tính tan của muối bromua và iođua tương tự clorua.
- Để nhận biết ion X- có thể dùng thuốc thử là dung dịch AgNO3:
+ AgF tan trong dung dịch.
+ AgCl kết tủa trắng (AgCl tan trong dung dịch amoniac do tạo phức với NH3).
+ AgBr kết tủa vàng nhạt (không tan trong NH3 dư).
+ AgI kết tủa vàng đậm (không tan trong NH3 dư)
- Các muối AgX kết tủa thường dễ bị phân hủy bởi nhiệt hoặc ánh sáng:
2AgX → 2Ag + X2
2. BÀI TẬP VẬN DỤNG – TỰ LUYỆN
Câu 1: Nhận biết các dung dịch sau:
(a) HCl, NaOH, NaCl, H2SO4.
(b) NaF, NaCl, NaBr, NaI (chỉ dùng 1 thuốc thử).
(c) HCl, KOH, BaCl2, Ca(OH)2, H2SO4, Na2SO4.
Câu 2: Cho 10,8 gam kim loại M (hóa trị III) tác dụng với khí clo tạo thành 53,4 gam muối.
(a) Xác định tên kim loại.
(b) Tính khối lượng KMnO4 và thể tích dung dịch HCl 2 M cần dùng để điều chế được lượng
clo sử dụng cho phản ứng trên.
Câu 3: Cho 9,2 gam hỗn hợp hai kim loại Al và Zn phản ứng vừa đủ với m gam dung dịch HCl
10 %, sau phản ứng thu được dung dịch X và 5,6 lít khí H2 (ở đktc).
(a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
(b) Tính m.
(c) Tính nồng độ phần trăm của các chất có trong dung dịch X.
Câu 4: Cho 24 gam hỗn hợp rắn X gồm Mg, Cu và CuO phản ứng vừa đủ với V lít dung dịch HCl 1,5 M, sau phản ứng thu được dung dịch Y; 2,24 lít khí H2 (ở đktc) và 9,6 gam một chất rắn không tan.
(a) Viết các PTPƯ xảy ra và tính phần trăm khối lượng mỗi chất trong hỗn hợp X.
(b) Tính V.
(c) Cô cạn dung dịch Y thu được m gam chất rắn khan khan. Tính m?
Câu 5: Sục khí clo dư vào dung dich X có chứa 27,65 gam hỗn hợp muối NaBr và NaI đến khi phản ứng xảy ra hoàn toàn ta thu được 11,7 gam NaCl. Tính phần trăm khối lượng mỗi muối trong dung dịch X.
Câu 6: Hoà tan 10 gam hỗn hợp 2 muối cacbonat của kim loại hoá trị II và III bằng dung dịch HCl thu được dung dich A và 0,672 lít khí bay ra (ở đktc). Cô cạn dung dịch A thu được m gam muối khan. Tính m?
Câu 7: Cho dung dịch AgNO3 vừa đủ vào hỗn hợp hai muối NaCl và NaBr thu được lượng kết tủa bằng khối lượng AgNO3 tham gia phản ứng.
(a) Viết các PTPƯ xảy ra.
(b) Tính phần trăm khối lượng mỗi muối halogenua trong hỗn hợp ban đầu.
Trên đây là một phần trích dẫn nội dung Ôn tập chuyên đề nhóm Halogen môn Hóa học 10 năm 2021. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Chúc các em học tốt!