Mời các em học sinh cùng tham khảo nội dung Bài 7: Hoá trị và công thức hoá học môn Khoa học tự nhiên 7 SGK Kết nối tri thức được trình bày bên dưới đây để đi tìm câu trả lời cho các câu hỏi sau:
Hóa trị là gì? Cách tính hóa trị của một nguyên tố, nhóm, gốc hóa học như thế nào? Ý nghĩa của Hóa trị và hóa trị của một số nguyên tố hóa học cần nhớ giúp giải nhanh bài tập hóa trị, viết phương trình hóa học?
Hy vọng đây là tài liệu hữu ích phục vụ cho việc học tập của các em!
Tóm tắt lý thuyết
1.1. Công thức hoá học
a. Khái niệm công thức hóa học
- Công thức hoá học của một chất là cách biểu diễn chất bằng kí hiệu hoá học của nguyên tố kèm theo chỉ số ở chân bên phải kí hiệu hoá học.
Ví dụ: Công thức hoá học của oxygen và carbon dioxide lần lượt là O2 và CO2.
b. Cách viết công thức hoá học
|
Đơn chất |
Hợp chất |
|
- Các đơn chất kim loại, khí hiếm và một số phi kim thì kí hiệu hoá học của nguyên tố được coi là công thức hoá học. Ví dụ: Công thức hoá học của đồng là Cu, sắt là Fe, helium là He, carbon là C, lưu huỳnh là S,... - Một số phi kim có phần tử gồm hai hay ba nguyên tử liên kết với nhau thì thêm chỉ số này ở chân kí hiệu hoá học. Ví dụ: Công thức hoá học của hydrogen là H2, oxygen là O2, ozone là O3... |
- Công thức hoá học của hợp chất gồm kí hiệu hoá học của những nguyên tố tạo ra hợp chất kèm theo chỉ số ở chân bên phải kí hiệu hoá học. Chỉ số là những số nguyên, cho biết số nguyên tử của mỗi nguyên tố trong phân tử hợp chất. Chỉ số bằng 1 thì không ghi. Ví dụ: Công thức hoá học của khí methane là CH4, muối ăn là NaCl. |
c. Ý nghĩa của công thức hoá học
- Công thức hoá học cho biết:
+ Các nguyên tố hoá học tạo nên chất.
+ Số nguyên tử hay tỉ lệ số nguyên tử của các nguyên tố hoá học có trong phân tử.
+ Khối lượng phân tử của chất.
Ví dụ: Công thức hoá học của calcium carbonate là CaCO3 cho biết:
- Calcium carbonate gồm ba nguyên tố là Ca, C, O.
- Trong một phần tử calcium carbonate có một nguyên tử Ca, một nguyên tử C, ba nguyên tử O và tỉ lệ số nguyên tử Ca : C : O là 1 : 1 : 3.
- Khối lượng phân tử bằng 40 + 12 + 3+ 16 = 100 (amu).
- Biết công thức hoá học, tính được phần trăm khối lượng của các nguyên tố trong hợp chất:
+ Bước 1: Tính khối lượng phân tử hợp chất.
+ Bước 2: Tính phần trăm khối lượng các nguyên tố trong hợp chất:
% khối lượng nguyên tố = (khối lượng nguyên tử . số nguyên tử của nguyên tố . 100%) : khối lượng phân tử
Ví dụ: Tính phần trăm khối lượng của các nguyên tố trong phân bón KNO3
- Khối lượng phân tử KNO3 bằng: 39.1+ 1+ 1+ 16:3 = 101 (amu).
- Phần trăm khối lượng các nguyên tố trong KNO3:
\(\% K = \frac{{39.1.100\% }}{{101}} = 38,6\% \)
\(\% N = \frac{{14.1.100\% }}{{101}} = 13,9\% \)
%O = 100% - 38,6% - 13,9% = 47,5%.
1.2. Hoá trị
a. Khái niệm hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
b. Cách xác định hoá trị
- Người ta quy ước nguyên tố H luôn có hoá trị I. Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì nguyên tố đó có hoá trị bằng bấy nhiêu.
Ví dụ: Trong phân tử nước (H2O), nguyên tử của nguyên tố O liên kết được với hai nguyên tử H nên có hoá trị II.
- Oxygen cũng được quy ước có hoá trị II. Từ đó người ta xác định được hoá trị cho các nguyên tố khác trong các hợp chất có chứa H hoặc O.
Ví dụ: Trong phân tử carbon dioxide (CO2), nguyên tử của nguyên tố C liên kết được với hai nguyên tử O nên có hoá trị IV.
- Hoá trị của nhóm nguyên tử được xác định tương tự như cách xác định hoá trị của nguyên tố.
Ví dụ: Trong phân tử sulfuric acid (H2SO4), nhóm (SO4) liên kết với 2 nguyên tử hydrogen nên có hoá trị II.
c. Quy tắc hoá trị
- Quy tắc hóa trị:
+ Trong công thức hoá học của hợp chất hai nguyên tố, tích của chỉ số và hoá trị của nguyên tố này bằng tích của chỉ số và hoá trị của nguyên tố kia.
Ví dụ: \({P_2}^V{O_5}^{II}\), ta có: 2 x = 5 x II.
+ Quy tắc được vận dụng chủ yếu cho các hợp chất vô cơ.
- Hoá trị của một số nguyên tố hoá học và nhóm nguyên tử được cho trong Bảng 7.2 và Bảng 7.3.
Bảng 7.2. Hóa trị thường gặp của một số nguyên tố hóa học
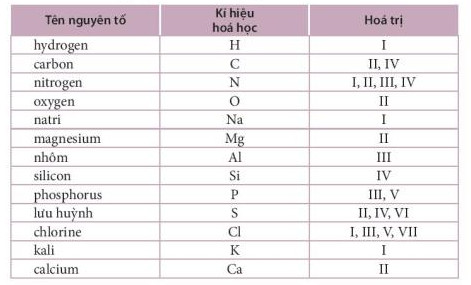
Bảng 7.3. Hóa trị của một số nguyên tử

|
- Công thức hoá học gồm kí hiệu hoá học của một nguyên tố (đơn chất) hay hai, ba, nguyên tố (hợp chất) và chỉ số ở chân mỗi kí hiệu. - Công thức hoá học cho biết: thành phần các nguyên tố hoá học tạo nên chất; số nguyên tử hay tỉ lệ số nguyên tử của các nguyên tố trong phân tử; khối lượng phân tử của chất. |
|---|
1.3. Lập công thức hoá học của hợp chất
a. Lập công thức hoá học của hợp chất khi biết hoá trị
Ví dụ: Lập công thức hoá học của hợp chất tạo bởi lưu huỳnh có hoá trị IV và oxygen.
- Viết công thức dạng chung: \({S_x}^{IV}{O_y}^{II}\)
- Theo quy tắc hoá trị: x.IV = y.II.
- Chuyển biểu thức này thành tỉ lệ: \(\frac{x}{y} = \frac{{II}}{{IV}} = \frac{1}{2}\)
- Thường thì tỉ lệ số nguyên tử trong phân tử là những số nguyên đơn giản nhất, vì vậy lấy: x =1 và y = 2.
- Công thức hoá học của hợp chất: SO2.
b. Lập công thức hoá học của hợp chất theo phần trăm các nguyên tố
Ví dụ: Lập công thức hoá học của hợp chất tạo bởi carbon và hydrogen, biết phần trăm khối lượng của C, H lần lượt là 75%, 25% và khối lượng phân tử của hợp chất là 16 amu.
- Bước 1: Viết công thức hợp chất là CxHy
- Bước 2: Khối lượng phân tử của hợp chất là: 12 x + y = 16.
- Bước 3: Lập biểu thức tính phần trăm khối lượng của C, H để tìm x và y:
\(\begin{array}{*{20}{l}}
{\% C = \frac{{12.x.100\% }}{{16}} = 75\% }\\
{\% H = \frac{{1.y.100\% }}{{16}} = 25\% }
\end{array}\)
→ x = 1; y = 4.
Vậy công thức của hợp chất là CH4
- Nguyên tố H có hoá trị I. Hoá trị của nguyên tố khác được xác định từ hoá trị của H.
Bài tập minh họa
Bài 1: Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người. Đường glucose có công thức hóa học là C6H12O6.
Hãy cho biết:
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong một phân tử glucose là bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu?
Hướng dẫn giải
a) Glucose được tạo thành từ những nguyên tố: C, H và O
b) Nguyên tố C: Có 6 nguyên tử C (khối lượng nguyên tử: 12 amu)
→ Khối lượng nguyên tố C trong 1 phân tử glucose = 12 amu x 6 = 72 amu
- Nguyên tố H: Có 12 nguyên tử H (khối lượng nguyên tử: 1 amu)
→ Khối lượng nguyên tố H trong 1 phân tử glucose = 1 amu x 12 = 12 amu
- Nguyên tố O: Có 6 nguyên tử O (khối lượng nguyên tử: 16 amu)
→ Khối lượng nguyên tố O trong 1 phân tử glucose = 16 amu x 6 = 96 amu
c) Khối lượng phân tử glucose = khối lượng nguyên tố C + khối lượng nguyên tố H + khối lượng nguyên tố O
= 72 amu + 12 amu + 96 amu = 180 amu
Bài 2: Xác định hóa trị của mỗi nguyên tố có trong các hợp chất sau đây, biết trong các hợp chất H có hóa trị I còn O có hóa trị II.
a) NH3, H2S, H3PO4
b) FeO, Na2O, SiO2
Hướng dẫn giải
a)
- Trong phân tử NH3, N có hóa trị III do một nguyên tử N liên kết được với ba nguyên tử H.
- Trong phân tử H2S, S có hóa trị II do một nguyên tử S liên kết được với hai nguyên tử H.
- Trong phân tử H3PO4 , nhóm PO4 có hóa trị III do nhóm PO4 liên kết được với ba nguyên tử H.
b)
- Trong phân tử FeO, Fe có hóa trị II do một nguyên tử Fe liên kết với một nguyên tử O.
- Trong phân tử Na2O, Na có hóa trị I do hai nguyên tử Na mới liên kết được với một nguyên tử O.
- Trong phân tử SiO2, Si có hóa trị IV do một nguyên tử Si liên kết được với hai nguyên tử O.
Bài 3: Tính hóa trị của Fe trong hợp chất.
a) FeCl2 biết Cl có hóa trị I
b) Fe2(SO4)3 biết nhóm SO4 có hóa trị II.
Hướng dẫn giải
a) Gọi hoá trị của sắt là a:
1. a = 2.I ⇒ a = II
Vậy hóa trị của Fe trong hợp chất FeCl2 là II
b. Gọi hoá trị của sắt là b:
2.b = 3.II ⇒ a = III
Vậy hóa trị của Fe trong hợp chất Fe2(SO4)3 là III
Bài 4: Lập công thức hóa học của các hợp chất sau:
a) Hợp chất tạo bởi S (VI) và oxi
b) Hợp chất tạo bởi Na (I) và (SO4) (II)
c) Hợp chất tạo bởi P (III) và H
d) Hợp chất tạo bởi Cu(II) và (SO4) (II)
e) Hợp chất tạo bởi Ca(II) và (NO3) (I)
Hướng dẫn giải
Các bước lập công thức hóa học:
- Viết CTHH dạng chung AxBy
- Gọi a,b là hóa trị lần lượt của A, B
- Áp dụng quy tắc hóa trị: x.a = b.y
- Chuyển thành tỉ lệ \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{\rm{b}}}{{\rm{a}}}{\rm{ = }}\frac{{{\rm{b'}}}}{{{\rm{a'}}}}\)
- Lấy x = b hay b’ và y = a hay a’ ( nếu a’, b’ là những số nguyên đơn giản hơn so với a, b)
- Viết Công thức hóa học của hợp chất
a) Hợp chất tạo bởi S (VI) và oxi là SO2
b) Hợp chất tạo bởi Na (I) và (SO4) (II) là Na2SO4
c) Hợp chất tạo bởi P (III) và H là là PH3
d) Hợp chất tạo bởi Cu(II) và (SO4) (II) là CuSO4
e) Hợp chất tạo bởi Ca(II) và (NO3) (I) là Ca(NO3)2
Bài 5: Hợp chất A chứa Ca, C và O. Biết thành phần phần trăm về khối lượng của các nguyên tố Ca, C, O lần lượt là: 40%, 12%, 48%. Lập công thức hóa học của A biết khối lượng phân tử của hợp chất là 100 amu.
Hướng dẫn giải
CTHH của hợp chất A có dạng CaxCyOz
Khối lượng phân tử của A là: 40x + 12y + 16z = 100
Theo đề ta có:
\(\begin{array}{l}
{\rm{\% Ca = }}\frac{{{\rm{40x}}{\rm{.100}}}}{{{\rm{100}}}}{\rm{ = 40}}\\
\Rightarrow {\rm{x = 1}}
\end{array}\)
\(\begin{array}{l}
{\rm{\% C = }}\frac{{{\rm{12y}}{\rm{.100}}}}{{{\rm{100}}}}{\rm{ = 12}}\\
\Rightarrow {\rm{y = 1}}
\end{array}\)
\(\begin{array}{l}
{\rm{\% O = }}\frac{{{\rm{16z}}{\rm{.100}}}}{{{\rm{100}}}}{\rm{ = 48}}\\
\Rightarrow {\rm{z = 3}}
\end{array}\)
Vậy CTHH của hợp chất A là CaCO3
Luyện tập Bài 7 Khoa học tự nhiên 7 KNTT
Học xong bài học này, em có thể:
- Trình bày được khái niệm về hoá trị cho chất công hoá trị.
- Biết cách viết công thức hoá học và viết được công thức hoá học của một số đơn chất và hợp chất đơn giản, thông dụng.
- Nêu được mối liên hệ giữa hoá trị của nguyên tố với công thức hoá học của hợp chất.
- Tính được phần trăm nguyên tố trong hợp chất khi biết công thức hoá học của nó.
- Xác định được công thức hoá học của hợp chất dựa vào phần trăm nguyễn tố và khối lượng phân tử.
3.1. Trắc nghiệm Bài 7 Khoa học tự nhiên 7 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Khoa học tự nhiên 7 Kết nối tri thức Chương 2 Bài 7 cực hay có đáp án và lời giải chi tiết.
-
Câu 1:
Chọn câu sai
- A. Hóa tri là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố kia
- B. Hoá trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị và hóa trị của oxi là 2 đơn vị
- C. Quy tắc hóa trị : x.a=y.b
- D. Photpho chỉ có hóa trị IV
-
- A. XY
- B. X2Y
- C. X3Y
- D. Tất cả đáp án.
-
Câu 3:
Lập công thức hóa học biết hóa trị của X là I và số p = e là 13 và Y có nguyên tử khối là 35.5
- A. NaCl
- B. BaCl2
- C. NaO
- D. MgCl
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 7 Khoa học tự nhiên 7 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Khoa học tự nhiên 7 Kết nối tri thức Chương 2 Bài 7 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi trang 41 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi trang 42 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Hoạt động trang 42 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 43 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 43 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 43 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 44 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 44 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.1 trang 26 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.2 trang 26 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.3 trang 26 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.4 trang 26 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.5 trang 26 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.6 trang 26 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.7 trang 27 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7. 8 trang 27 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.9 trang 27 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.10 trang 27 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.11 trang 27 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.12 trang 28 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.13 trang 28 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.14 trang 28 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.15 trang 28 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.16 trang 28 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 7.17 trang 28 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Hỏi đáp Bài 7 Khoa học tự nhiên 7 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







