Hôm nay các em sẽ được học về liên kết hóa học và các loại liên kết thường gặp. Đây cũng là một trong những lý thuyết quan trọng trong bộ môn Khoa học tự nhiên lớp 7. Trong bài viết sau, HOC247 sẽ cung cấp cho các em một số kiến thức trọng tâm về các loại liên kết hóa học, các em hãy cùng tìm hiểu thông qua Bài 6: Giới thiệu về liên kết hóa học chương trình SGK Kết nối tri thức nhé!
Tóm tắt lý thuyết
1.1. Cấu trúc electron bền vững của khí hiếm
- Ở điều kiện thường, các khí hiếm tồn tại dưới dạng đơn nguyên tử bền vững, khó bị biến đổi hoá học.
- Lớp electron ngoài cùng của chúng chứa 8 electron (trừ He chứa 2 electron).
- Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hoá học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron.
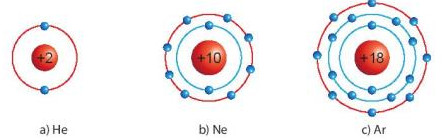
Hình 6.1. Mô hình sắp xếp electron trong vỏ nguyên tử khí hiếm
|
- Nguyên tử khí hiếm có lớp electron ngoài cùng bền vững. - Nguyên tử của các nguyên tố khác có thể đạt được lớp electron ngoài cùng của khí hiếm bằng cách tạo thành liên kết hoá học. |
|---|
1.2. Liên kết ion
- Sự hình thành liên kết ion trong phân tử muối ăn
- Khi hình thành phần tử sodium chloride (NaCl), các nguyên tử đã có sự nhường và nhận electron như sau:
- Nguyên tử natri (Na) nhường một electron ở lớp electron ngoài cùng cho nguyên tử chlorine (Cl) để tạo thành ion dương Na+ có vỏ bền vững giống vỏ nguyên tử khí hiếm Ne.
- Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion ấm Cl- có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar (xem Hình 6.2)
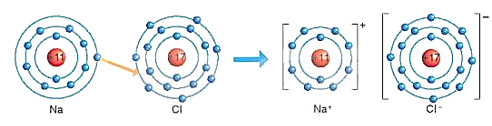
Hình 6.2. Sơ đồ mô tả sự hình thành liên kết ion trong phân tử NaCl
- Hai ion được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử muối ăn. Nói chung, khi kim loại tác dụng với phi kim, nguyên tử kim loại nhường electron cho nguyên tử phi kim. Nguyên tử kim loại trở thành ion dương và nguyên tử phi kim trở thành ion âm. Các ion dương và ấm hút nhau tạo thành liên kết trong hợp chất ion. Vậy liên kết ion là liên kết được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
- Các hợp chất con như muối ăn,... là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy và khi tan trong nước tạo thành dung dịch dẫn được điện.
|
Liên kết ion là liên kết được hình thành bởi lực hút giữa các ion mang điện tích trái dấu. |
|---|
1.3. Liên kết cộng hoá trị
- Các nguyên tử riêng rẽ của các nguyên tố hydrogen và oxygen không bền vững, chúng có xu hướng kết hợp với nguyên tử khác bằng liên kết cộng hoá trị để hình thành các phân tử.
a. Liên kết cộng hoá trị trong phần tử đơn chất
- Sự hình thành phân tử hydrogen
+ Mỗi nguyên tử H có 1 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm He, khi hình thành phân tử hydrogen, hai nguyên tử H đã liên kết với nhau bằng cách mỗi nguyên tử H góp chung 1 electron tạo thành một cặp electron dùng chung (xem Hình 6.4).
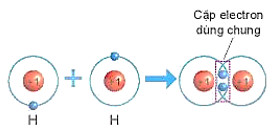
Hình 6.4. Sơ đồ mô tả sự hình thành liên kết cộng hoá trị trong phân tử hydrogen
- Sự hình thành phân tử oxygen
+ Mỗi nguyên tử O có 6 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiểm Ne, khi hình thành phần tử oxygen, hai nguyên tử O đã liên kết với nhau bằng cách mỗi nguyên tử O góp chung 2 electron tạo thành hai cặp electron dùng chung (xem Hình 6.5).
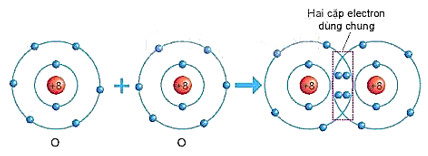
Hình 6.5. Sơ đồ mô tả sự hình thành liên kết cộng hoá trị trong phân tử oxygen
- Liên kết được hình thành trong phần tử hydrogen và oxygen là liên kết cộng hoá trị. Vậy, liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Liên kết cộng hoá trị thường gặp trong nhiều phân tử đơn chất phi kim như nitrogen, chlorine, fluorine,...
b. Liên kết cộng hoá trị trong phân tử hợp chất
- Sự hình thành phân tử nước
+ Khi hình thành phân tử nước, hai nguyên tử H đã liên kết với một nguyên tử 0 bằng cách nguyên tử 0 góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung (xem Hình 6.6).
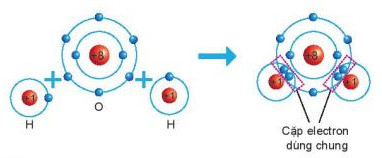
Hình 6.6. Sơ đồ mô tả sự hình thành liên kết cộng hoá trị trong phân tử nước
- Các chất hydrogen, Oxygen và nước chỉ chứa các liên kết cộng hoá trị, được gọi là chất công hoá trị. Các chất ammonia, carbon dioxide, đường ăn,... cũng là chất cộng hoá trị. Các chất cộng hoá trị có thể là chất khí, chất lỏng hay chất rắn. Các chất cộng hoá trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
|
- Liên kết cộng hoá trị được tạo nên do sự dùng. chung một hay nhiều cặp electron. - Hợp chất ion thường khó bay hơi, khó nóng chảy,...Chất cộng hoá trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp. |
|---|
Bài tập minh họa
Bài 1: Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Hướng dẫn giải
Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron.
Bài 2: Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium
Hướng dẫn giải
- Trong bảng tuần hoàn, aluminium thuộc ô màu xanh nằm ở
+ Nhóm IIIA → Có 3 electron ở lớp ngoài cùng
+ Chu kì 3 → Có 3 lớp electron
- Nguyên tố aluminium là nguyên tố kim loại có 3 electron ở lớp ngoài cùng
→ Có xu hướng nhường đi 3 electron tạo thành ion dương aluminum (Al3+)
- Sơ đồ tạo thành ion aluminium:
.jpg)
Bài 3: Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Theo em, ở điều kiện thường, potassium chloride là chất rắn, chất lỏng hay chất khí? Vì sao?
Hướng dẫn giải
- Phân tử potassium chloride là hợp chất ion được tạo bởi kim loại điển hình (K) và phi kim điển hình (Cl)
- Mà hợp chất ion có những tính chất chung sau:
+ Là chất rắn ở điều kiện thường
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao
+ Khi tan trong nước tạo ra dung dịch dẫn được điện
→ Ở điều kiện thường, potassium chloride là chất rắn
Luyện tập Bài 6 Khoa học tự nhiên 7 KNTT
Học xong bài học này, em có thể:
- Nêu được mô hình sắp xếp các electron trong vỏ nguyên tử của một số nguyên tố khí hiếm.
- Nêu được sự hình thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để tạo ra lớp electron ngoài cũng giống nguyên tử nguyên tố khí hiếm. Áp dụng được cho các phần từ đơn giản như H2, Cl2, NH3, H2O, CO2, N2...
- Nêu được sự hình thành liên kết ion theo nguyên tắc cho và nhận electrọn để tạo ra ion có lớp electron ngoài cùng giống nguyên tử nguyên tố khí hiếm. Áp dụng cho các phần tử đơn giản như NaO, MgO,..
- Chỉ ra được sự khác nhau về một số tính chất của hợp chất ion và hợp chất cộng hoá trị.
3.1. Trắc nghiệm Bài 6 Khoa học tự nhiên 7 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Khoa học tự nhiên 7 Kết nối tri thức Chương 2 Bài 6 cực hay có đáp án và lời giải chi tiết.
-
- A. Na2O
- B. HClO
- C. KCl
- D. NH4Cl
-
Câu 2:
Cho các hợp chất sau : MgCl2, Na2O, NCl3, HCl, KCl. Hợp chất nào sau có liên kết cộng hoá trị ?
- A. MgCl2 và Na2O.
- B. Na2O và NCl3.
- C. NCl3 và HCl.
- D. HCl và KCl.
-
- A. cộng hóa trị không cực.
- B. ion yếu.
- C. ion mạnh.
- D. cộng hóa trị phân cực.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 6 Khoa học tự nhiên 7 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Khoa học tự nhiên 7 Kết nối tri thức Chương 2 Bài 6 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi trang 36 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 37 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 37 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 38 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 38 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 39 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 39 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.1 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.2 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.3 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.4 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.5 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.6 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.7 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.8 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.9 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.10 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.11 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.12 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.13 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Hỏi đáp Bài 6 Khoa học tự nhiên 7 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







