Em có biết rằng nitrogen và oxygen là hai nguyên tố hóa học quan trọng, tạo thành hơn 99% khối lượng của khí quyển Trái Đất? Không chỉ như vậy, chúng còn có thể kết hợp với nhau tạo ra rất nhiều hợp chất, vậy nitrogen tạo những hợp chất nào với oxygen? Chúng được hình thành từ đâu và có những tính chất gì?
Thông qua nội dung Bài 5. Một số hợp chất với oxygen của nitrogen môn Hóa học 11 Chân Trời Sáng Tạo, các em sẽ nắm được tính chất vật lý và hoá học các oxygende của nitrogen, nitric acid và hiện tượng phú dưỡng. Hãy cùng bắt đầu khám phá bài học này để tìm hiểu thêm về mối quan hệ giữa nitrogen và oxygen nhé!
Tóm tắt lý thuyết
1.1. Các oxide của nitrogen – Hiện tượng mưa acid
a. Nguồn gốc các oxide của nitrogen
– Khí nitrogen monoxide (NO) được tạo thành trong không khí ở nhiệt độ cao.
– Ở điều kiện thường, khí NO không màu kết hợp với oxygen trong không khí tạo thành khí nitrogen dioxide (NO2) màu nâu đỏ.
2NO + O2 → 2NO2

Hình 5.1. Hiện tượng sấm sét
– Nitrogen oxide được hình thành từ những hiện tượng trong tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao.
– Các khí này độc, có thể gây ảnh hưởng nghiêm trọng đến sức khoẻ con người.
– Chúng cũng là một trong những nguyên nhân chính gây nên hiệu ứng nhà kính và hiện tượng mưa acid.
b. Hiện tượng mưa acid
– Mưa acid là hiện tượng nước mưa có pH nhỏ hơn 5,6 chủ yếu là do sự oxi hoá khí SO2, và các khí oxide của nitrogen (NOx) với xúc tác của các ion kim loại trong khói, bụi, ... Các khí này hoà tan trong nước tạo thành dung dịch H2SO4 và dung dịch HNO3.
Ví dụ:
2SO2 + O2 + 2H2O → 2H2SO4
4NO2 + O2 + 2H2O → 4HNO3
– Nguyên nhân gây ra mưa acid có thể do hoạt động của núi lửa, cháy rừng, sấm sét hoặc do con người tiêu thụ nhiều nguyên liệu tự nhiên như than đá, dầu mỏ, ...
– Hiện tượng này gây ảnh hưởng trực tiếp đến đời sống con người, động – thực vật và có thể làm thay đổi thành phần nước của sông, hồ, gây hại cho động vật sống dưới nước và các loại sinh vật khác, huỷ hoại các công trình kiến trúc, ...
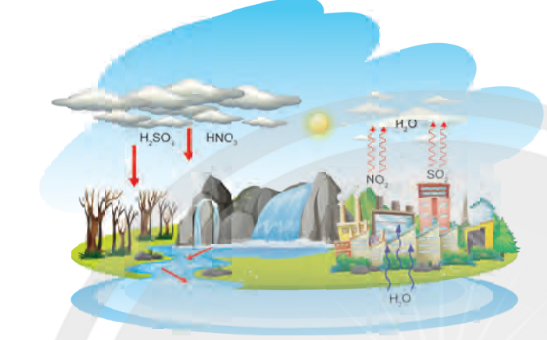
Hình 5.2. Quá trình hình thành mưa acid

Hình 5.3. Một số tác hại của mưa acid
1.2. Nitric acid
a. Cấu tạo phân tử, tính chất vật lí của nitric acid
%2C%20m%C3%B4%20h%C3%ACnh%20ph%C3%A2n%20t%E1%BB%AD%20nitric%20acid%20(b)%2C%20nitric%20acid%20%C4%91%C6%B0%E1%BB%A3c%20b%E1%BA%A3o%20qu%E1%BA%A3n%20trong%20l%E1%BB%8D%20thu%E1%BB%B7%20tinh%20t%E1%BB%91i%20m%C3%A0u%20(c).png)
Hình 5.4. Cấu tạo phân tử nitric acid (a), mô hình phân tử nitric acid (b), nitric acid được bảo quản trong lọ thuỷ tinh tối màu (c)
| Nitric acid tinh khiết kém bền, bị phân huỷ một phần giải phóng khi nitrogen dioxide (NO2) ngay ở điều kiện thường khi có ánh sáng. Khí này tan trong dung dịch acid, làm cho dung dịch HNO3 đặc có màu vàng. |
– Nitric acid tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, có khối lượng riêng là 1,53 g/cm, sôi ở 86°C.
– Nitric acid tan trong nước theo bất kì tỉ lệ nào. Nitric acid thương mại thường có nồng độ 68%, khối lượng riêng là 1,40 g/cm.
b. Tính chất hoá học của nitric acid
– Nitric acid là một trong số các acid mạnh, trong dung dịch loãng nó phân li hoàn toàn thành H+ và NO3–.
HNO3 → H+ + NO3–
– Dung dịch HNO3 làm quỳ tím hoá đỏ; tác dụng với basic oxide, base và muối của acid yếu hơn tạo thành muối nitrate.
– Nitric acid là một trong ba acid chính của ngành công nghiệp hoá chất hiện đại và có khả năng ăn mòn kim loại.
– Nitric acid là một acid có tính oxi hoá mạnh. Do đó, HNO3 oxi hoá được hầu hết các kim loại trừ vàng (Au), platinum (Pt), ...
– Trong hoá học hữu cơ, dung dịch nitric acid 68% được sử dụng để chế tạo thuốc nổ, ví dụ như trinitrotoluene (TNT); sản xuất nitrobenzene.
– Hỗn hợp nitric acid đặc và hydrochloric acid đặc có tỉ lệ thể tích 1 :3 (cũng tương ứng với tỉ lệ mol 1 :3), được gọi là dung dịch nước cường toan. Dung dịch này có khả năng hoà tan platinum và vàng.

Hình 5.5. Một số ứng dụng của HNO3 trong đời sống và sản xuất
| Một số kim loại như Al, Fe và Cr bị thụ động hoá trong dung dịch HNO3 đặc, nguội, do tạo ra màng oxide bền, bảo vệ kim loại khỏi tác dụng của acid. |
1.3. Hiện tượng phú dưỡng
| Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus). |
– Ao hồ có khả năng tự lọc nước nhờ các vi sinh vật tự nhiên.
– Các vi sinh vật này có vai trò cân bằng hệ sinh thái của hồ, sông và tạo ra các dưỡng chất.
– Các dưỡng chất này khi không được tiêu thụ hết sẽ gây ra tình trạng dư thừa, dẫn đến hiện tượng phú dưỡng, gây nhiều tác động tiêu cực cho môi trường.

Hình 5.6. Hiện tượng phú dưỡng ở ao hồ
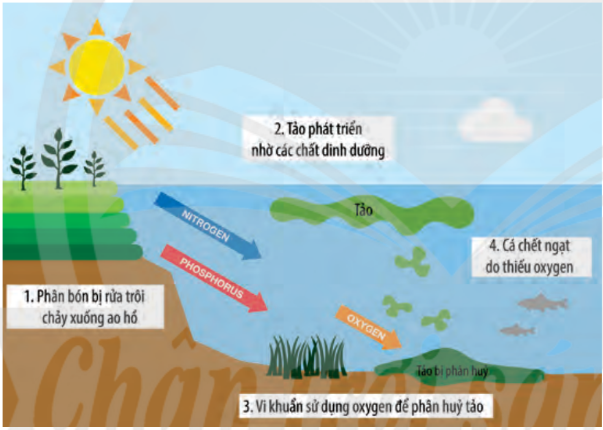
Hình 5.7. Quá trình hình thành hiện tượng phú dưỡng
– Chất thải công nghiệp, chất thải sinh hoạt, ... khi không được xử lí theo quy chuẩn, nếu thải vào sông, hồ cũng gây ra hiện tượng trên.
– Ao, hồ bị phú dưỡng làm các loại thực vật sống dưới nước (như rong, tảo, lục bình, bèo, ...) phát triển mạnh mẽ; làm tăng các chất lơ lửng, chất hữu cơ, dẫn đến sự suy giảm lượng oxygen trong nước, nhất là ở tầng sâu, gây ảnh hưởng không tốt đến chất lượng nước, làm ô nhiễm môi trường nước, .
Bài tập minh họa
Bài 1. Phú dưỡng là hiện tượng
- Ao, hồ dư quá nhiều các nguyên tố dinh dưỡng
- Ao, hồ thiếu quá nhiều các nguyên tố dinh dưỡng
- Ao, hồ dư quá nhiều các nguyên tố kim loại nặng
- Ao, hồ thiếu quá nhiều các nguyên tố kim loại nặng
Hướng dẫn giải
Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).
\(\Rightarrow\) Chọn A
Bài 2. Đâu không phải nguyên nhân chính gây ra mưa acid
- Hoạt động quang hợp của cây
- Hoạt động của núi lửa
- Cháy rừng
- Tiêu thụ nhiều nguyên liệu tự nhiên như than đá, dầu mỏ…
Hướng dẫn giải
Hoạt động quang hợp của cây không phải nguyên nhân chính gây ra mưa acid. Nguyên nhân chủ yếu là do sự oxi hoá khí SO2, và các khí oxygende của nitrogen (NOx) với xúc tác của các ion kim loại trong khói, bụi, ... Các khí này hoà tan trong nước tạo thành dung dịch H2SO4 và dung dịch HNO3.
\(\Rightarrow\) Chọn A
Luyện tập Bài 5 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Phân tích được nguồn gốc của các oxygende của nitrogen trong không khí và nguyên nhân gây hiện tượng mưa acid.
– Nêu được cấu tạo của HNO3, tính acid, tính oxi hoá mạnh trong một số ứng dụng thực tiễn quan trọng của nitric acid.
– Giải thích được nguyên nhân, hệ quả của hiện tượng phú dưỡng (eutrophication).
3.1. Trắc nghiệm Bài 5 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 5 cực hay có đáp án và lời giải chi tiết.
-
- A. Al, Zn, Cu
- B. Al, Cr, Fe
- C. Zn, Cu, Fe
- D. Al, Fe, Mg
-
- A. NH3.
- B. NO.
- C. NO2.
- D. N2O.
-
- A. 38,6
- B. 46,6.
- C. 84,6.
- D. 76,6.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 5 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 5 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 30 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 30 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 31 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 31 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 31 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 31 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 32 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 32 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 32 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 33 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 9 trang 33 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 33 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 34 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 34 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 34 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 5 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!











