Ammonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng trong đời sống và sản xuất. Ammonia có những tính chất và ứng dụng gì?
Để tìm thấy câu trả lời, mời các em cùng tham khảo lý thuyết và bài tập Bài 4: Ammonia và một số hợp chất ammonium môn Hóa học lớp 11 Chân Trời Sáng Tạo. Bài giảng được HOC247 biên soạn gồm các nội dung chính về cấu trúc, tính chất, ứng dụng và tác động của ammonia và một số hợp chất ammonium giúp các em dễ dàng nắm được nội dung chính của bài. Hãy cùng khám phá bài học này để hiểu thêm về những hợp chất quan trọng và ứng dụng của chúng đến cuộc sống của chúng ta nhé.
Tóm tắt lý thuyết
1.1. Cấu tạo phân tử của ammonia
%2C%20c%C3%B4ng%20th%E1%BB%A9c%20Lewis%20c%E1%BB%A7a%20ph%C3%A2n%20t%E1%BB%AD.png)
Hình 4.1. Cấu tạo của phân tử ammonia (a), công thức Lewis của phân tử ammonia (b) và mô hình phân tử ammonia (c)
| Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen. |
1.2. Tính chất vật lí của ammonia

Hình 4.2. Thí nghiệm về tính tan của khí NH3 trong nước
| Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia. Dung dịch ammonia đậm đặc thường có nồng độ 25%. |
1.3. Tính chất hoá học của ammonia
– Khi hoà tan vào nước, một phần nhỏ các phân tử NH3 nhận ion H+ của nước, tạo thành ion NH4+ (ion ammonium) và ion OH– (ion hydroxygende).
NH3 + H2O \(\rightleftharpoons \) NH4+ + OH–
– Ammonia (dạng khí cũng như dung dịch) kết hợp dễ dàng với acid tạo thành muối ammonium.

Hình 4.3. NH3 tác dụng với HCl
NH3 + HCl → NH3Cl
NH3Cl: ammonium chloride
2NH3 + H2SO4 → (NH4)2SO4
(NH4)2SO4: ammonium sulfate
– Ammonia cháy trong khí oxygen tạo ra khí nitrogen và hơi nước.
4NH3 + 3O2 \(\xrightarrow{{{t}^{0}}}\) 2N2 + 6H2O
– Khi oxi hoá ammonia bằng oxygen trong không khí khi có xúc tác Pt, ở nhiệt độ cao tạo thành NO và H2O.
4NH3 + 5O2 \(\xrightarrow{{{t}^{0}},\ Pt}\) 4NO + 6H2O
|
Ammonia chủ yếu thể hiện tính khử và tính base trong các phản ứng hoá học |
1.4. Tổng hợp ammonia
Vận dụng kiến thức hoá học cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber
Ammonia được tổng hợp từ khí nitrogen và khí hydrogen theo phản ứng:
N2(g) + 3H2(g) \(\rightleftharpoons \) 2NH3(g) \({{\Delta }_{r}}H_{298}^{0}\,=\,–92kJ\)
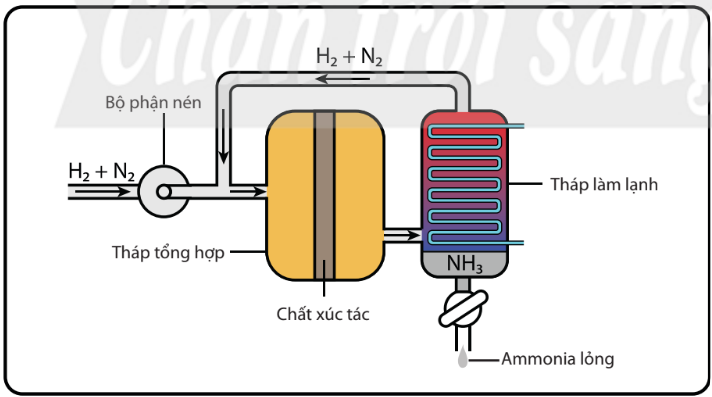
Hình 4.4. Sơ đồ thiết bị tổng hợp ammonia trong công nghiệp theo quá trình Haber
Quá trình Haber được thực hiện như sau:
– Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1 : 3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
– Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh.
– Ở đây, NH3 hoá lỏng và được tách riêng, còn hỗn hợp khí N2 và H2 chưa phản ứng được đưa trở lại tháp tổng hợp.
1.5. Muối ammonium
a. Tính chất vật lí
Muối ammonium đều được tạo bởi cation ammonium ( NH4+ ) và anion gốc acid.
Ví dụ: ammonium chloride, nitrate, ammonium, ammonium sulfate, ...

Hình 4.5. Muối ammonium chloride
| Muối ammonium là những chất tinh thể ion. Hầu hết các muối ammonium dễ tan trong nước. |
b. Tính chất hoá học
– Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khí ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
– Muối ammonium dễ bị phân huỷ khi đun nóng.

Hình 4.6. Sự phân huỷ nhiệt của NH4CI
1.6. Ứng dụng
a. Ứng dụng của ammonia

Hình 4.7. Một số ứng dụng của ammonia
| Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất. |
b. Ứng dụng của muối ammonium

Hình 4.8. Một số loại phân bón ammonium
| Muối ammonium được sử dụng rộng rãi trong đời sống và sản xuất, đặc biệt được dùng làm phân bón trong nông nghiệp. |
Bài tập minh họa
Bài 1. Ammonia là hợp chất của
- Oxygen và nitrogen
- Hydrogen và nitrogen
- Oxygen và hydrogen
- Sulfur và nitrogen
Hướng dẫn giải
Ammonia là hợp chất của hydrogen và nitrogen, có công thức là NH3.
\(\Rightarrow\) Chọn B
Bài 2. Muối ammonium đều được tạo bởi
- Cation ammonium và anion gốc acid
- Cation gốc acid và anion ammonium
- Cation kim loại và anion gốc acid
- Cation gốc acid và anion kim loại
Hướng dẫn giải
Muối ammonium đều được tạo bởi cation ammonium (NH4+) và anion gốc acid
\(\Rightarrow\) Chọn A
Luyện tập Bài 4 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Mô tả được công thức Lewis và hình học của phân tử ammonia.
– Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan), tính chất hoá học (tỉnh base, tính khử). Viết được phương trình hoá học minh hoạ.
– Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber (Ha–bơ).
– Trình bày được tính chất cơ bản của muối ammonium và nhận biết được ion ammonium trong dung dịch; ứng dụng của ammonia.
3.1. Trắc nghiệm Bài 4 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 4 cực hay có đáp án và lời giải chi tiết.
-
Câu 1:
Tính base của NH3 do
- A. Trên N còn cặp e tự do
- B. Phân tử có 3 liên kết cộng hóa trị phân cực
- C. NH3 tan được nhiều trong nước
- D. NH3 tác dụng với nước tạo NH4OH
-
- A. Cho hỗn hợp qua nước vôi trong dư
- B. Cho hỗn hợp qua bột CuO nung nóng
- C. Nén và làm lạnh hỗn hợp để hoá lỏng NH3.
- D. Cho hỗn hợp qua dung dịch H2SO4đặc
-
- A. NH4HCO3
- B. Na2CO3
- C. NH4HSO3
- D. NH4Cl
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 4 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 4 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 24 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 24 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 25 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 25 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 25 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 25 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 26 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 26 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 27 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 9 trang 27 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 10 trang 28 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 28 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 28 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 11 trang 28 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 29 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 29 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 29 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 29 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 4 trang 29 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 5 trang 29 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 4 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!











