Nitrogen là khí có hàm lượng lớn nhất trong không khí, có vai trò cung cấp đạm tự nhiên cho cây trồng. Nitrogen có tính chất gì và có những ứng dụng nào trong cuộc sống?
Nội dung lý thuyết và bài tập minh họa Bài 3: Đơn chất nitrogen môn Hóa học lớp 11 Chân Trời Sáng Tạo sẽ là chìa khoá giúp các em có được câu trả lời. Bài giảng đã được HOC247 biên soạn ngắn gọn, đầy đủ, dễ hiểu về trạng thái tự nhiên, cấu tạo nguyên tử, phân tử, tính chất vật lí, hoá học và ứng dụng của nitrogen. Hi vọng bài giảng sẽ giúp các em hệ thống được kiến thức và dễ dàng nắm được nội dung chính của bài.
Chúc các em học tốt!
Tóm tắt lý thuyết
1.1. Trạng thái tự nhiên
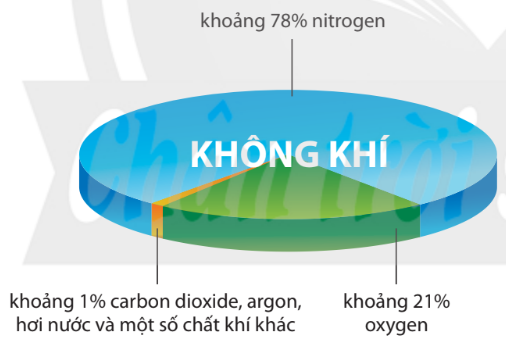
Hình 3.1. Thành phần thể tích của không khí
– Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
– Ở dạng đơn chất, nitrogen chiếm khoảng 78% thể tích của không khí.
– Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị: 14N (99,63%) và 15N (0,37%).
– Ở dạng hợp chất, nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu natri.
–Nitrogen còn có trong thành phần của protein, nucleic acid, ... và nhiều hợp chất hữu cơ khác.
1.2 Tính chất vật lí
Hình 3.3. Mô hình phân tử nitrogen và năng lượng liên kết trong phân tử nitrogen
– Ở điều kiện thường, nitrogen là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hoá lỏng ở –196°C và hoá rắn ở –210°C.
– Khí nitrogen tan rất ít trong nước (ở điều kiện thường, 1 lít nước hoà tan được 0,015 lít khí nitrogen).
– Nitrogen không duy trì sự cháy và sự hô hấp.
1.3. Tính chất hoá học
– Nguyên tử nitrogen có độ âm điện lớn, chỉ kém fluorine, oxygen, chlorine.
– Ở nhiệt độ cao, nitrogen có thể tác dụng được với nhiều chất.

Hình 3.3. Mô hình phân tử nitrogen và năng lượng liên kết trong phân tử nitrogen
Tác dụng với hydrogen:
– Ở nhiệt độ cao (380°C – 450°C), áp suất cao (25 bar – 200 bar) và có xúc tác Fe, nitrogen tác dụng với hydrogen tạo khí ammonia.

Tác dụng với oxygen:
– Ở nhiệt độ khoảng 3000°C, nitrogen tác dụng với oxygen tạo thành khí nitrogen monoxygende.
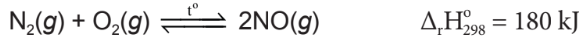
| Ở nhiệt độ thường, phân tử nitrogen rất bền, khá trơ về mặt hoá học. Trong các điều kiện thích hợp, nitrogen chủ yếu thể hiện tính oxi hoá, nitrogen thể hiện tính khử khi tác dụng với oxygen. |
1.4. Quá trình tạo và cung cấp nitrate cho đất từ nước mưa
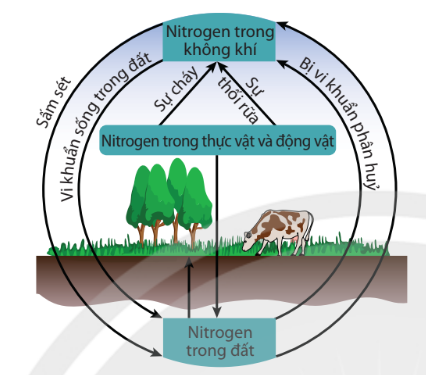
Hình 3.4. Chu trình của nitrogen trong tự nhiên
| Nguyên tố nitrogen rất cần thiết cho sự sống trên Trái Đất. Trong tự nhiên luôn diễn ra các quá trình chuyển hoá nitrogen từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín. |
1.5. Ứng dụng


Hình 3.5. Một số ứng dụng của nitrogen
Bài tập minh họa
Bài 1. Khí N2 tương đối trơ ở nhiệt độ thường là do
A. Nitrogen có bán kính nguyên tử nhỏ, phân tử không phân cực
B. Nguyên tử nitrogen có độ âm điện lớn nhất trong nhóm VA
C. Trong phân tử N2, mỗi nguyên tử còn một cặp electron chưa tham gia liên kết
D. Trong phân tử N2 chứa liên kết 3 rất bền
Hướng dẫn giải
Khí N2 tương đối trơ ở nhiệt độ thường là do trong phân tử N2 chứa liên kết 3 rất bền.
\(\Rightarrow\) Chọn D
Bài 2. Trong tự nhiên luôn diễn ra các quá trình chuyển hóa nitrogen từ dạng này sang dạng khác theo…
A. một chu trình tuần hoàn không khép kín
B. một chu trình không tuần hoàn
C. một chu trình tuần hoàn khép kín
D. một chu trình ngẫu nhiên
Hướng dẫn giải
Trong tự nhiên luôn diễn ra các quá trình chuyển hóa nitrogen từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín.

\(\Rightarrow\) Chọn C
Luyện tập Bài 3 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Phát biểu được trạng thái tự nhiên của nguyên tố nitrogen.
– Giải thích được tính trơ của đơn chất nitrogen ở nhiệt độ thường thông qua liên kết và giá trị năng lượng liên kết; các ứng dụng của đơn chất nitrogen khí và lỏng trong sản xuất, trong hoạt động nghiên cứu.
– Trình bày được sự hoạt động của đơn chất nitrogen ở nhiệt độ cao đối với hydrogen, oxygen. Liên hệ được quá trình tạo và cung cấp nitrate cho đất từ nước mưa.
3.1. Trắc nghiệm Bài 3 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 3 cực hay có đáp án và lời giải chi tiết.
-
- A. Chưng cất phân đoạn không khí lỏng
- B. Nhiệt phân NH4NO3
- C. Dùng phương pháp dời nước
- D. Nhiệt phân HNO3
-
- A. Nitrogen có bán kính nguyên tử nhỏ, phân tử không phân cực
- B. Nguyên tử nitrogen có độ âm điện lớn nhất trong nhóm VA
- C. Trong phân tử N2, mỗi nguyên tử còn một cặp electron chưa tham gia liên kết
- D. Trong phân tử N2 chứa liên kết 3 rất bền
-
- A. điều kiện thường
- B. nhiệt độ cao khoảng 100oC
- C. nhiệt độ cao khoảng 1000oC
- D. nhiệt độ khoảng 3000oC
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 3 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 3 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 20 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 20 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 20 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 21 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 22 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 23 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 3 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!












