Sulfur (sulfur) còn được gọi là lưu hoàng, sinh diêm vàng, diêm sinh, đã được biết đến từ thời cổ đại. Nguyên tố sulfur có những tính chất gì và được ứng dụng vào sản xuất, đời sống của con người như thế nào?
Nội dung chi tiết và hướng dẫn giải bài tập Bài 6: Sulfur và sulfur dioxide môn Hóa học 11 Chân Trời Sáng Tạo. Được HOC247 biên soạn dưới đây sẽ giúp các em dễ dàng nắm được kiến thức quan trọng và làm tốt bài tập về sulfur và sulfur dioxide – hai hợp chất quan trọng trong hóa học và sản xuất công nghiệp.
Hãy cùng khám phá bài học này để hiểu rõ hơn về tính chất, ứng dụng của sulfur và sulfur dioxide cũng như tác động của chúng đến môi trường và sức khỏe con người nhé. Chúc các em học tốt.
Tóm tắt lý thuyết
1.1. Đơn chất sulfur
a. Trạng thái tự nhiên của sulfur

Hình 6.1. Sulfur trong tự nhiên

Hình 6.2. Một số dạng tồn tại của sulfur trong tự nhiên
– Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét trong lòng đất.
– Sulfur ở dạng hợp chất cũng được tìm thấy trong nhiều khoáng vật trong tự nhiên.
b. Cấu tạo, tính chất vật lí cơ bản của sulfur đơn chất

Hình 6.3. Bột sulfur
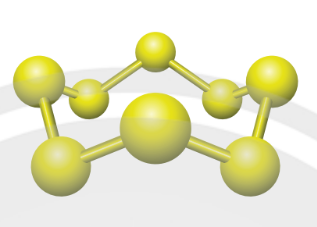
Hình 6.4. Phân tử sulfur
– Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hoá trị với nhau tạo thành mạch vòng. Để đơn giản, người ta dùng kí hiệu S mà không dùng kí hiệu S trong các phản ứng hoá học.
– Ở điều kiện thường, sulfur là chất rắn, màu vàng, không tan trong nước, tan nhiều trong các dung môi hữu cơ như benzene, carbon disulfide (CS2), ...
c. Tính chất hoá học của sulfur đơn chất
| Sulfur đơn chất vừa có tính oxi hoá, vừa có tính khử. |
Ví dụ:
Hg + S→ HgS
S+O2 \(\xrightarrow{{{t}^{0}}}\) SO2
d. Ứng dụng của sulfur đơn chất
| Sulfur là nguyên liệu quan trọng cho nhiều ngành công nghiệp: khoảng 90% lượng sulfur sản xuất được dùng để điều chế H2SO4 còn lại được dùng để lưu hoá cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,... |

Hình 6.5. Một số ứng dụng của sulfur
1.2. Sulfur dioxide
a. Tính chất hoá học và ứng dụng của sulfur dioxide
– Sulfur dioxide (SO2) là chất khí không màu, mùi xốc, độc (hít phải sẽ gây viêm đường hô hấp), nặng hơn không khí hơn hai lần, hoá lỏng ở –10°C, tan nhiều trong nước (1 thể tích nước ở 20°C hoà tan được 40 thể tích khí SO2).
– Sulfur dioxide là chất khử khi tác dụng với chất oxi hoá mạnh, như halogen, potassium permanganate, nitrogen dioxide, ...
SO2 + NO2 → SO3 + NO (1)
– Sulfur dioxide là chất oxi hoá khi tác dụng với chất khử mạnh như H2S, Mg,...
SO2 + 2H2S → 3S + 2H2O (2)
– Sulfur dioxide được dùng để sản xuất sulfuric acid; tẩy trắng giấy, bột giấy; chống nấm mốc cho lương thực, thực phẩm,…
b. Tìm hiểu sự hình thành sulfur dioxide do tác động của con người, tự nhiên, tác hại của sulfur dioxide và một số biện pháp làm giảm thiểu lượng sulfur dioxide thải vào không khí
– Sulfur dioxide được sinh ra trong tự nhiên và do tác động của con người.

Hình 6.6. Một số nguồn phát thải sulfur dioxide
– Để giảm thiểu lượng khí thải này cần kết hợp thực hiện một số các biện pháp sau, tuỳ thuộc vào nguồn thải SO2.
– Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường như hydrogen, ethanol, ... thay cho nguồn năng lượng hoá thạch.
– Khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió, mưa, sóng biển, thuỷ triều, địa nhiệt.
– Xử lí khí thải công nghiệp trước khi thải ra môi trường.
Bài tập minh họa
Bài 1. Tính chất vật lí nào sau đây không phải của sulfur
A. chất rắn màu vàng
B. không tan trong nước
C. có tnc thấp hơn ts của nước
D. tan nhiều trong benzene
Hướng dẫn giải
Sulfur tà phương nóng chảy ở 113oC, sulfur đơn tà nóng chảy ở 119oC
→ Nhiệt độ nóng chảy của S cao hơn nhiệt độ sôi của nước.
\(\Rightarrow\) Chọn C
Bài 2. So sánh tính chất cơ bản của oxygen và sulfur ta có
A. tính oxi hoá của oxygen < sulfur
B. tính khử của sulfur > oxygen
C. tính oxi hoá của oxygen = tính oxi hoá của S
D. tính khử của oxygen = tính khử của S
Hướng dẫn giải
Tính oxi hoá của oxygen mạnh hơn sulfur; tính khử của sulfur mạnh hơn oxygen.
\(\Rightarrow\) Chọn B
Luyện tập Bài 6 Hóa 11 Chân Trời Sáng Tạo
Học xong bài học này, em có thể:
– Nêu được các trạng thái tự nhiên của nguyên tố sulfur.
– Trình bày được cấu tạo, tính chất vật lí, hoá học cơ bản và ứng dụng của sulfur đơn chất, tính oxi hoá, tính khử và ứng dụng của sulfur dioxide và sự hình thành sulfur dioxide do tác động của con người, tự nhiên, tác hại của sulfur dioxide và một số biện pháp làm giảm thiểu lượng sulfur dioxide thải vào không khí
– Thực hiện được thí nghiệm chứng minh sulfur đơn chất vừa có tính oxi hoá vừa có tính khử
3.1. Trắc nghiệm Bài 6 Hóa 11 Chân Trời Sáng Tạo
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 11 CTST Bài 6 cực hay có đáp án và lời giải chi tiết.
-
- A. Cho hỗn hợp khí qua dung dịch nước vôi trong.
- B. Cho hỗn hợp khí qua dung dịch bromine dư.
- C. Cho hỗn hợp khí qua dung dịch NaOH.
- D. Cho hỗn hợp khí qua dung dịch Ba(OH)2.
-
Câu 2:
Một mẫu khí thải công nghiệp có nhiễm các khí CO; CO2; H2S. Để nhận biết H2S ta dùng dung dịch:
- A. Pb(CH3COO)2.
- B. FeSO4.
- C. NaNO3.
- D. Ca(OH)2.
-
- A. Cho mỗi khí vào nước Br2.
- B. Cho từ từ đến dư mỗi khí vào nước vôi trong.
- C. Cho mỗi khí vào dung dịch H2S.
- D. Cho mỗi khí vào dung dịch KMnO4.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 6 Hóa 11 Chân Trời Sáng Tạo
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 11 CTST Bài 6 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 35 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 1 trang 35 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 2 trang 36 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 3 trang 36 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 4 trang 36 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 5 trang 37 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hoạt động trang 37 SGK Hoá học 11 Chân trời sáng tạo – CTST
Vận dụng trang 37 SGK Hoá học 11 Chân trời sáng tạo – CTST
Thảo luận 6 trang 37 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 7 trang 38 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 8 trang 38 SGK Hóa học 11 Chân trời sáng tạo – CTST
Thảo luận 9 trang 38 SGK Hóa học 11 Chân trời sáng tạo – CTST
Vận dụng trang 39 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải Bài 1 trang 39 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 2 trang 39 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 3 trang 39 SGK Hóa học 11 Chân trời sáng tạo – CTST
Giải Bài 4 trang 39 SGK Hóa học 11 Chân trời sáng tạo – CTST
Hỏi đáp Bài 6 Hóa 11 Chân Trời Sáng Tạo
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!











