Mời quý thầy cô cùng các em học sinh tham khảo tài liệu Phương pháp giải bài tập về Sắt và hợp chất của Săt môn Hóa học 12 năm 2021-2022. Tài liệu bao gồm phần tóm tắt lý thuyết, các hỏi minh họa có đáp án và phần tự luyện tập. Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập hiệu quả và đạt điểm số cao trong kì thi sắp tới.
1. KIẾN THỨC CẦN NHỚ
a. Sắt
- Sắt nằm ở ô số 26, nhóm VIIIB, chu kì 4 của bảng tuần hoàn.
- Cấu hình electron: 1s22s22p63s23p63d64s2, viết gọn là [Ar]3d64s2.
- Nguyên tử sắt dễ dàng nhường đi 2 hoặc 3 electron để trở thành ion Fe2+ hoặc Fe3+.
- Sắt tồn tại chủ yếu ở dạng hợp chất trong tự nhiên (quặng sắt): quặng manhetit (Fe3O4), quặng hematit đỏ (Fe2O3), quặng hematit nâu (Fe2O3.nH2O), quặng xiderit (FeCO3), quặng pirit (FeS2).

b. Hợp chất của sắt

- Tính chất hóa học đặc trưng của hợp chất sắt (II) là tính khử:
Fe2+ → Fe3+ + 1e
- Tính chất hóa học đặc trưng của hợp chất sắt (III) là tính oxi hóa:
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
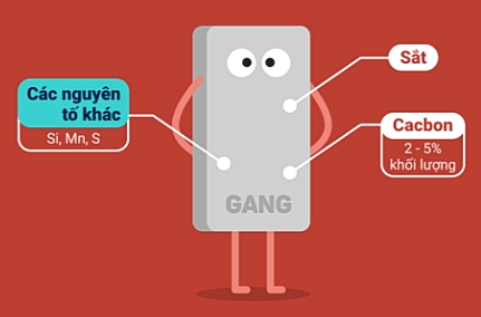
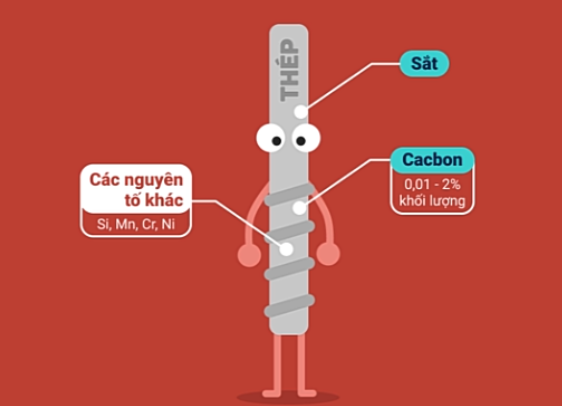
c. Hợp kim của sắt
|
|
Gang |
Thép |
|
Thành phần |
|
|
|
Điều chế |
Khử quặng sắt oxit bằng than cốc trong lò cao. |
Giảm hàm lượng các tạp chất C, S, Si, Mn,... có trong gang bằng cách oxi hóa các tạp chất đó thành oxit rồi biến thành xỉ và tách ra khỏi thép. |
2. PHƯƠNG PHÁP GIẢI
Bài 1. Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Tính khối lượng muối tạo thành.
Hướng dẫn giải
Ta có mCu = 2,94 gam, mFe = 1,96 gam, nFe = 0,035 mol; nCu = 0,046 mol.
→ Sau phản ứng còn 2,3 gam < 2,94 gam → chất rắn không tan là Cu, dung dịch sau phản ứng chứa Cu(NO3)2 và Fe(NO3)2.
Có nFe(NO3)2 = nFe = 0,035 mol;
nCu(NO3)2 = nCu pư = \(\dfrac{2,94-2,3}{64}=0,1\) mol
→ mmuối = mFe(NO3)2 + mCu(NO3)2 = 0,035.180 + 0,01. 188 = 8,18 gam.
Bài 2. Nung nóng 18,56 gam hỗn hợp X gồm FeCO3 và FexOy trong không khí tới khi phản ứng xảy ra hoàn toàn thu được CO2 và 16 gam một oxit sắt duy nhất. Cho toàn bộ lượng CO2 sinh ra hấp thụ hết vào 400 ml dung dịch Ba(OH)2 0,15M thu được 7,88 gam kết tủa. Để hòa tan hết 18,56 gam X cần ít nhất V ml dung dịch HCl 2M. Tính giá trị của V.
Hướng dẫn giải
Cho CO2 vào dung dịch Ba(OH)2 tìm được 2 giá trị của số mol CO2 là 0,04 và 0,08.
Nếu nCO2 = 0,04 → mFe2O3 + mCO2 = 16 + 1,76 = 17,76 < 18,56 (loại).
→ nCO2 = 0,08 → mFeCO3 = 0,08.116 = 9,28 gam.
→ mFexOy = 9,28 gam (a mol).
Theo ĐLBT nguyên tố với Fe:
0,08 + ax = 0,1.2 → \(\left\{{}\begin{matrix}ax=0,12\\56ax+16ay=9,28\end{matrix}\right.\) → \(\left\{{}\begin{matrix}x=3;y=4\\a=0,04\end{matrix}\right.\)
FeCO3 + 2HCl → FeCl2 + CO2 + H2O
0,08 0,16
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
0,04 0,32
→ nHCl = 0,48 mol → V = 0,48 : 2 = 0,24 lít.
Bài 3. Biết 2,3 gam hỗn hợp gồm MgO, CuO, FeO tác dụng vừa đủ với 100ml dung dịch H2SO4 0,2M. Khối lượng muối thu được là bao nhiêu?
Hướng dẫn giải
nH2SO4 = 0,1. 0,2 = 0,02 mol
RO + H2SO4 → RSO4 + H2O
1 mol oxit (RO) → 1 mol muối sunfat (RSO4) ⇒ khối lượng tăng là: 96 – 16 = 80g
Khối lượng muối thu được là: 2,3 + 80. 0,02 = 3,9 g
nH2SO4 = 0,2.0,1 = 0,02 mol
2,3g Oxit + 0,2 mol H2SO4 → muối sunfat + H2O
Ta thấy: nH2SO4 = nH2O = 0,2 mol
Áp dụng ĐLBT khối lượng: moxit + mH2SO4 = mmuối + mH2O
↔ 2,3 + 96.0,2 = mmuối + 18.0,2
↔ mmuối = 3,9 gam.
Bài 4. Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch H2SO4 loãng thu được 560 ml một chất khí ở đktc. Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 thì thu được một chất rắn. Tính khối lượng bột sắt đã dùng trong hai trường hợp nói trên và khối lượng chất rắn thu được.
Hướng dẫn giải
Số mol H2 = \(\dfrac{0,56}{22,4}\) = 0,025 mol
Fe + H2SO4 → FeSO4 + H2
Theo pt nFe = nH2 = 0,025(mol)
→ Khối lượng sắt dùng ở trường hợp 1 là: mFe = 0,025 x 56 = 1,4 gam.
TH2: Lượng Fe gấp đôi khi đó số mol Fe là: 0,025. 2 = 0,05 (mol)
Fe + CuSO4 → FeSO4 + Cu
nFe = 0,05 mol.
Khối lượng Fe đã dùng ở trường hợp 2 là: mFe = 0,05 x 56 = 2,8 gam.
Khối lượng chất rắn m = mCu = 0,05 x 64 = 3,2 gam.
3. LUYỆN TẬP
Câu 1. Nguyên tử của nguyên tố Fe có
A. Có bao nhiêu electon d à 6 electron d
B. Có bao nhiêu e lớp vỏ ngoài cùng à 8 electrong – 8 electron hóa trị
C. Hạt nhân có bao nhiêu hạt à 56 hạt gồm 26 e và 30 hạt n
Câu 2. Cấu hình của sắt
A. Cấu hình của Fe là à1s22s22p63s23p63d64s2 = [Ar]3d64s2
B. Cấu hình của Fe2+ là à [Ar]3d6 mất 2 e ở lớp ngoài trước mất e lớp trong sau
C. Cấu hình của Fe3+ là [Ar]3d5 sau khi mất 2e ở lớp ngoài, mới tiếp tục mất e của 3d
Câu 3. Chất nào sau đây không thể oxi hoá được Fe thành Fe3+.
A. S
B. Br2
C. AgNO3
D.H2SO4.
Câu 4. Cho Oxit Fe vào dung dịch H2SO4 loãng thu được dung dịch không thể hoà tan được Ni. Oxit Fe đó là:
(1) FeO
(2) Fe2O3
(3). Fe3O4.
A. (1).
B. (2),(3).
C. (1), (2), (3).
D.(2), (3).
Câu 5. Oxit Fe vào dung dịch HNO3 đặc nóng thu được dung dịch X và không thấy có khí thoát ra. Oxit Fe là:
(1) FeO
(2) Fe2O3
(3). Fe3O4.
A. (1).
B. (2),
C. (3).
D.(1), (2), (3).
Câu 6. Hoà tan oxit sắt từ vào dung dịch H2SO4 loãng dư thu được dung dịch X.
A. Có làm mất màu dung dịch thuốc tím không? à vì có sắt II => có làm mất màu thuốc tím
B. Có thể hòa tan đồng không. à có sắt III => có hòa tan được Cu
C. Cho NaOH dư vào dung dich X thu được kết tủa để lâu ngoai không khí kết tủa tăng hay giảm khối lượng
D. Dung dịch X có tác dụng với Ag2SO4 không?
Câu 7. Cho Fe vào dung dịch AgNO3 có phản ứng tạo thành Fe2+ hay Fe3+
Câu 8. Trong các phản ứng hoá học sau đây, phản ứng hoá học nào sai, sửa lại cho đúng.
(1). Fe3O4 + HCl → FeCl2 + FeCl3 + H2O.
(2). Fe(OH)3 + H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + H2.
(3). FeO + HNO3 → Fe(NO3)3 + NO + H2O.
(4). FeCl2 + HNO3 → Fe(NO3)3 + HCl + NO + H2O.
(5). Al + HNO3 → Al(NO3)3 + H2
(6). FeO + H2SO4 đặc nguội → Fe2(SO4)3 + SO2 + H2O.
Bao nhiêu phản ứng sai?
A. 1
B. 2
C. 3
D. 4
Câu 9. Có 3 chất rắn đã được nhuộm đồng màu: Fe, FeO, Fe2O3. Dung dịch nào sau đây có thể nhận biết đồng thời ba chất này.
A. HCl
B. H2SO4 đặc.
C. HNO3 loãng.
D. Tất cả đúng.
Câu 10. Fe không tan trong nước ở nhiệt độ thường nhưng ở nhiệt độ cao Fe có thể khử hơi nước . Sản phẩm của phản ứng khử hơi nước ở nhiệt độ 800oC là:
A. FeO
B. Fe(OH)2
C. Fe3O4
D. Fe2O3.
Câu 11. Quặng nào sau đây có hàm lượng Fe cao nhất.
A. Hematit đỏ ( Fe2O3).
C. Manhetit ( Fe3O4).
B. Pirit. ( FeS2)
D. Xederit ( FeCO3).
Câu 12. Thành phần nào của cơ thể người có nhiều Fe nhất.
A. Tóc.
B. Xương.
C. Máu
D. Da.
Câu 13. Xác định vai trò của sắt trong từng phản ứng là chất oxi hóa hay khử
A. FeCl2 + 2 NaOH → Fe(OH)2 + 2 NaCl
B. Fe(OH)2 + 2 HCl → FeCl2 + 2 H2O.
C. 3 FeO + 10 HNO3 → 3 Fe(NO3)3 + 5 H2O + NO
D. FeO + CO → Fe + CO2.
Câu 14. Phản ứng nào chứng minh hợp chất Fe(III) có tính oxi hóa.
A. Fe3O4 + 4H2 → 3 Fe + 4 H2O.
B. FeCl3 + 3 AgNO3 → Fe(NO3)3 + 3AgCl.
C. Fe2O3 + 6 HNO3 → 2Fe(NO3)3 + 3 H2O.
D. không có phản ứng nào.
Câu 15. Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hoá bằng H2SO4 vào dung dịch KMnO4. Mô tả hiện tượng quan sát được.
A. Dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng.
B. Dung dịch màu tím hồng bị nhạt dần đến không màu.
Câu 17. Cho mẫu Fe vào dung dịch X , khi phản ứng kết thúc thấy khối luợng của chất rắn giảm hơn so với khối lượng ban đầu. X là dung dịch nào sau đây.
A. CuCl2.
B. NiSiO4
C. AgNO3.
D. Một dung dịch khác.
Câu 18: Đọc phát biểu sau:
“Trong phản ứng giữa Fe + Mn+ → Fe2++M thì khối lượng thanh sắt sẽ tăng hay giảm tùy thuộc vào phân tử khối của M. nếu M lớn hơn sắt thì thanh sắt tăng, ngược lại.” phát biểu trên đúng cho mọi trượng hợp không? Khi nào thì nó sai?
Câu 19. Cho Fe vào trong dung dịch HNO3 loãng thì sinh ra một chất khí không màu bị hoá nâu ngoài không khí. Tỉ lệ mol Fe và HNO3 là:
A. 1:2
B. 1:1
C. 1:4
D. 1:6
Câu 20. Gang và thép là hợp kim của Fe . Tìm phát biểu đúng.
A. Gang là hợp kim Fe – C ( 5 đến 10%).
B. Thép là hợp kim Fe –C ( 2 à 5%).
C. Nguyên tắc sản suất gang là khử Fe trong oxit bằng CO, H2 hay Al ở nhiệt độ cao.
D. Nguyên tắc sản xuất thép là oxi hoá các tạp chất trong gang. (C, Si, Mn, S, P) thành oxit nhằm giảm hàm lượng của chúng.
Trên đây là một phần trích dẫn nội dung Phương pháp giải bài tập về Sắt và hợp chất của Săt môn Hóa học 12 năm 2021-2022. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
- Phương pháp giải một số dạng bài tập về Sắt và hợp chất của Sắt môn Hóa 12 năm 2020 có đáp án
- Bộ 90 câu trắc nghiệm ôn tập sắt và hợp chất của sắt môn Hóa 12 có đáp án năm 2020 Trường THPT Thành Nhân
Chúc các em học tốt!
Tài liệu liên quan
Tư liệu nổi bật tuần
- Xem thêm