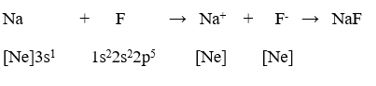Để giúp các em học sinh có thêm tài liệu học tập, rèn luyện kĩ năng làm đề, kết hợp củng cố kiến thức chuẩn bị bước vào kì thi học kì 1 sắp tới. HOC247 xin giới thiệu Đề thi HK1 môn Hóa học 10 KNTT có đáp án năm 2022-2023 Trường THPT Chu Văn An. Mời các em cùng quý thầy cô tham khảo. Chúc các em có kết quả học tập thật tốt!
|
TRƯỜNG THPT CHU VĂN AN |
ĐỀ THI HỌC KÌ 1 MÔN HÓA HỌC 10 KNTT NĂM HỌC 2022-2023 Thời gian làm bài: 45 phút |
Phần I: Trắc nghiệm
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự phân chia của tế bào.
B. Sự hô hấp của sinh vật.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Sự quang hợp của cây xanh.
Câu 2: Nguyên tử chứa các hạt mang điện là
A. proton và hạt nhân.
B. proton và neutron.
C. electron và neutron.
D. proton và electron.
Câu 3: Kí hiệu hóa học của phosphorus (số proton = 15 và số neutron = 16) là
A. \({}_{15}^{32}P\)
B. \({}_{15}^{31}P\)
C. \({}_{16}^{31}P\)
D. \({}_{15}^{30}P\)
Câu 4: Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là \({}_{29}^{63}Cu\) chiếm 73% và \({}_{29}^{65}Cu\) . Nguyên tử khối trung bình của nguyên tố Cu là
A. 63,54.
B. 64,54.
C. 64,00.
D. 64,50.
Câu 5: Lớp thứ M có số phân lớp là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 6: Số electron tối đa chứa trong lớp L là
A. 2.
B. 8.
C. 18.
D. 32.
Câu 7: Cấu hình electron của nguyên tử có Z = 15 là
A. 1s23s22p63s23p2.
B. 1s23s22p63s23p4.
C. 1s23s22p63s23p3.
D. 1s23s22p53s23p4.
Câu 8: Cho các nguyên tố sau: X (Z = 11); Y (Z = 19); T (Z = 20); Q (Z = 17). Nguyên tố phi kim là
A. X (Z = 11).
B. Q (Z = 17).
C. Y (Z = 19).
D. T (Z = 20).
Câu 9: Ion X2+ có 10 electron. Trong bảng tuần hoàn, X thuộc ô số
A. 10.
B. 12.
C. 8.
D. 9.
Câu 10: Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 7. Vậy X thuộc loại nguyên tố nào sau đây?
A. s.
B. d.
C. f.
D. p.
---(Để xem đầy đủ nội dung câu 11 đền câu 28 của Đề thi, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
Phần II: Tự luận
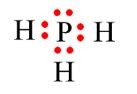
Câu 1: Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phân tử phosphine (PH3). Biết P (Z = 15); H (Z = 1).
Câu 2:
a) Viết công thức electron, công thức Lewis và công thức cấu tạo của chlorine (Cl2).
b) Biểu diễn sự tạo thành liên kết ion trong phân tử NaF.
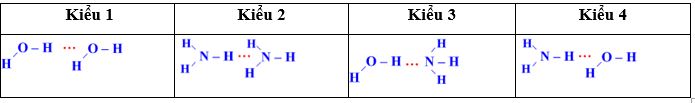
Câu 3: Amoniac là một hợp chất vô cơ có công thức phân tử NH3. Ở điều kiện tiêu chuẩn, nó là một chất khí, không màu, có mùi khai, tan nhiều trong nước do hình thành liên kết hydrogen với phân tử nước. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại bao nhiêu loại liên kết hydrogen?
ĐÁP ÁN
Phần I: Trắc nghiệm
|
1C |
2D |
3B |
4A |
5C |
6B |
7C |
8B |
9B |
10D |
|
11A |
12A |
13C |
14C |
15B |
16A |
17C |
18B |
19D |
20A |
|
21B |
22C |
23A |
24A |
25A |
26B |
27C |
28B |
Câu 1:
P (Z = 15): 1s22s22p63s23p3 ⇒⇒P có 5 electron hóa trị cần thêm 3 electron để đạt octet.
H (Z = 1): 1s1 Þ H có 1 electron hóa trị cần thêm 1 electron để đạt octet.
Khi hình thành liên kết, P góp chung 3 electron với 3 electron của 3 H ⇒ Trong PH3, xung quanh P có 8 electron giống khí hiếm Ar còn 3 H đều có 2 electron giống khí hiếm He.
Câu 2:
a)
|
Phân tử |
Công thức electron |
Công thức Lewis |
Công thức cấu tạo |
|
Cl2 |
|
|
Cl – Cl |
b) Biểu diễn sự tạo thành liên kết ion trong phân tử NaF:
Câu 3:
Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại 4 loại liên kết hydrogen:
Trên đây là một phần trích đoạn nội dung Đề thi HK1 môn Hóa học 10 KNTT có đáp án năm 2022-2023 Trường THPT Chu Văn An. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Các em quan tâm có thể tham khảo tài liệu cùng chuyên mục:
- Đề cương ôn tập HK1 môn Hóa học 10 KNTT năm 2022-2023
- Đề cương ôn tập HK1 môn Hóa học 10 CTST năm 2022-2023
Chúc các em học tập tốt !