Dưới đây là Bộ 5 đề thi HK2 môn Hóa học 10 năm 2021 Trường THPT Bắc Yên Thành. Đề thi gồm có trắc nghiệm và tự luận có đáp án sẽ giúp các em ôn tập nắm vững các kiến thức, các dạng bài tập để chuẩn bị cho kỳ thi sắp đến. Các em xem và tải về ở dưới.
|
TRƯỜNG THPT BẮC YÊN THÀNH |
ĐỀ THI HỌC KÌ 2 NĂM 2021 MÔN HÓA HỌC 10 Thời gian 45 phút |
ĐỀ SỐ 1
Câu 1: Ở điều kiện thường, chất nào sau đây có màu tím:
A. Cl2
B. I2
C. O2
D. Br2
Câu 2: Cho 10 g oxit của kim loại hóa trị II tác dụng vừa hết với 500 ml dd HCl 1,0M. Công thức
phân tử của oxit là :
A. MgO
B. CaO
C. CuO
D. FeO
Câu 3: Cho 4,05 gam một kim loại tác dụng hết với H2SO4 đặc, nóng dư thu được 5,04 lít khí SO2 (đktc). Tên kim loại là:
A. sắt
B. kẽm
C. nhôm
D. đồng
Câu 4: Dung dịch nào sau đây ăn mòn được thủy tinh
A. H2SO4 đậm đặc
B. HCl
C. HF
D. HNO3
Câu 5: Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là
A. 2,24.
B. 2,80.
C. 1,12.
D. 0,56.
Câu 6: Cho 1,58 gam KMnO4 tác dụng hoàn toàn với dung dịch HCl đặc, dư. Thể tích khí thu được ở đktc là:
|
A. 0,56 lit. |
B. 5,6 lit. |
C. 4,48 lit. |
D. 8,96 lit. |
|
|
Câu 7: Phương trình phản ứng thể hiện tính oxi hóa của SO2 là |
||||
|
A. SO2 |
+ KOH → KHSO3 |
B. 2SO2 + O2 → 2SO3 |
||
|
C. SO2 |
+ Br2 + 2H2O → H2SO4 + 2HBr |
D. SO2 + 2H2S → 3S + 2H2O |
||
|
Câu 8: Câu nào sau đây sai khi nhận xét về ozon? |
||||
|
A. Ozon có tính oxi hóa mạnh hơn oxi |
B. Ozon oxi hóa được Ag thành Ag2O |
|||
|
C. Phân tử ozon bền hơn phân tử oxi |
D. Phân tử ozon kém bền hơn phân tử oxi. |
|||
Câu 9: Trong PTN, người ta thu khí X bằng phương pháp đẩy nước. Vậy X có thể là khí nào sau đây?
A. O2
B. Cl2
C. SO2
D. H2S
Câu 10: Khí có mùi trứng thối là
A. H2S
B. SO2
C. HCl
D. Cl2
Câu 11: Thí nghiệm nào sau đây không xảy ra phản ứng
A. Sục khí CO2 vào nước Gia-ven.
B. Sục khí H2S vào dung dịch FeCl2.
C. Sục khí SO2 vào dung dịch NaOH.
D. Sục khí Cl2 vào dung dịch H2S.
Câu 12: Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng
A. xuất hiện chất rắn màu đen
B. bị vẩn đục, màu vàng
C. chuyển thành màu nâu đỏ
D. vẫn trong suốt không màu
Câu 13: Lưu huỳnh đioxit có công thức hóa học là
A. FeS2.
B. SO3
C. H2S
D. SO2.
Câu 14: Trong các phản ứng sau đây, phản ứng nào chứng minh axit HCl có tính oxi hóa?
|
A. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O |
B. 2Al + 6HCl → 2AlCl3 + 3H2 |
||
|
C. Fe2O3 + 6HCl → 2FeCl3 + 3H2O |
D. Cu(OH)2 + 2HCl → CuCl2 + 2H2O |
||
|
Câu 15: Chất nào sau đây thuộc loại muối sunfat? |
|||
|
A. K2SO3 |
B. Na2S |
C. NaCl |
D. BaSO4 |
|
Câu 16: Phương trình phản ứng viết sai là: |
|||
|
A. CuO + H2SO4 loãng → CuSO4 + H2O |
.B. Fe + H2SO4 loãng → FeSO4 + H2. |
||
|
C. Cu + H2SO4 loãng → CuSO4 + H2. |
D. FeO+ H2SO4 loãng → FeSO4 + H2O. |
||
|
Câu 17: Dãy kim loại nào sau đây thụ động trong H2SO4 đặc, nguội. |
|||
|
A. Na, Ba |
B. Mg, Zn |
C. Al, Fe |
D. Cu, Ag |
Câu 18: Chất nào sau đây khi tác dụng với axit H2SO4 đặc, nóng có thể giải phóng khí SO2 ?
A. MgO
B. ZnO
C. Al2O3
D. FeO
Câu 20: Số oxi hóa của Clo trong NaClO là
A. +1
B. +3
C. +5
D. +7
Câu 21: Chất khí được dùng để diệt trùng nước sinh hoạt, nước bể bơi… là:
A. F2
B. CO2
C. Cl2
D. N2
Câu 22: Chọn nhận xét sai:
A. Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
B. Tính oxi hóa của halogen tăng dần theo thứ tự F2 < Cl2 < Br2 < I2.
C. Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
D. Dung dịch axit flohiđric (HF) có tính axit yếu.
Câu 23: Trong hợp chất nào, nguyên tố S thể hiện tính oxi hóa và tính khử ?
A. Na2S
B. H2S2O7
C. SO2
D. H2SO4
Câu 24: Cho 10 gam hỗn hợp bột Mg và Fe tác dụng với dd HCl dư thấy có 5,6 lit khí (đktc) bay ra. Hỏi có bao nhiêu gam muối clorua tạo thành
|
A. 40,5g |
B. 45,5g |
C. 27,75g |
D. 60,5g |
|
Câu 25: Khí Clo không phản ứng với chất nào sau đây? |
|||
|
A. NaI |
B. NaOH |
C. NaBr |
D. NaCl |
|
Câu 26: Hoá chất dùng để nhận biết 4 dd: NaF, NaCl, NaBr, NaI là |
|||
|
A. H2SO4 |
B. NaOH |
C. NaNO3 |
D. AgNO3 |
|
Câu 27: Các ứng dụng của nước Gia-ven, clorua vôi chủ yếu dựa trên tính chất nào của chúng? |
|||
|
A. tính khử mạnh |
B. tính tẩy trắng. |
C. tính sát trùng. |
D. tính oxi hoá mạnh. |
Câu 28: Cho hỗn hợp gồm 6,4 gam Cu và 5,6 gam Fe vào dd H2SO4 loãng dư sinh ra V lit khí H2 (đktc). Giá trị của V là:
A. 2,24 lit.
B. 4,48 lit.
C. 1,12 lit.
D. 3,36 lit.
Câu 29: Các nguyên tố nhóm halogen có cấu hình eletron lớp ngoài cùng là
A. ns2np5
B. ns2np4
C. ns2np3
D. ns2np6
Câu 30: Để trung hòa 20 ml dung dịch HCl 0,1M cần 16 ml dung dịch NaOH nồng độ x mol/l. Giá
|
trị của x là |
|||
|
A. 0,25. |
B. 0,125. |
C. 0,34. |
D. 0,2. |
Câu 31: Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là
A. 10
B. 40
C. 20
D. 30
Câu 32: Hỗn hợp ban đầu SO2 và O2 có tỉ khối hơi đối với H2 bằng 24. Cần thêm bao nhiêu lít SO2 vào 10 lít hỗn hợp ban đầu để hỗn hợp sau có tỉ khối hơi so với H2 bằng 25,6. Các khí đo ở cùng điều kiện.
A. 2,5 lít.
B. 7,5 lít.
C. 8 lít.
D. 5 lít.
Câu 33: Có 200ml dd H2SO4 98% (D = 1,84 g/ml). Người ta muốn pha loãng thể tích H2SO4 trên
|
thành dung dịch H2SO4 49% thì thể tích nước cần pha loãng là bao nhiêu? |
|||
|
A. 621,28cm3 |
B. 368,00 cm3 |
C. 533,60 cm3 |
D. 711,28cm3 |
Câu 34: Đốt cháy hoàn toàn hỗn hợp gồm 2,7 gam Al và 3,6 gam Mg trong hỗn hợp khí X gồm Cl2 và O2 có tỉ khối so với H2 là 25,75. Sau khi các phản ứng xay ra hoàn toàn, thu được m gam hỗn hợp chất rắn gồm muối và oxit (không còn dư khí). Giá trị của m là
A. 20,22 gam.
B. 18,32 gam.
C. 16,6 gam.
D. 11,45 gam.
Câu 35: Một bình kín dung tích không đổi chứa khí ozon, sau một thời gian bị phân hủy dần, tạo thành oxi. Một học sinh nêu ra các nhận xét sau:
|
(1) |
Khối lượng hỗn hợp khí trong bình tăng lên. |
(2) |
Thể tích hỗn hợp khí trong bình tăng lên. |
||
|
(3) |
Số mol hỗn hợp khí trong bình tăng lên. |
(4) |
Tỉ khối của hỗn hợp khí trong bình tăng lên. |
||
|
Số nhận xét đúng là: |
|||||
|
A. 4 |
B. 2 |
C. 3 |
D. 1 |
||
Câu 36: Hoà tan hết 50 gam hỗn hợp gồm Cu và CuO trong dung dịch H2SO4 đặc nóng dư. Khí SO2 sinh ra làm mất màu vừa đủ 200 ml dd Br2 2M. Hàm lượng % của CuO trong hỗn hợp là:
A. 64,4%.
B. 25,6%.
C. 36%.
D. 48,8%.
Câu 37: Cho các chất sau: FeO, Cu, MnO2, CaCO3. Số chất có thể phản ứng được với dung dịch HCl loãng là
A. 1
B. 2
C. 4
D. 3
Câu 38: Hỗn hợp H gồm 2 muối X và Y là 2 muối halogenua của 2 kim loại kiềm với 2 halogen (2 kim loại kiềm và 2 halogen đều thuộc 2 chu kì liên tiếp trong bảng tuần hoàn và MX < MY). Cho 22,9 gam H tác dụng vừa đủ với 250 ml dd AgNO3 1M, sau phản ứng thu được 42,55 gam hỗn hợp kết tủa G. Tính % khối lượng của muối X trong H.
|
A. 32,53% |
B. 25,55% |
C. 38,32% |
D. 29,12% |
|
Câu 39: Thí nghiệm nào không sinh ra đơn chất: |
|||
|
A. SO2 + dung dịch H2S → |
B. F2 + H2O →; |
||
|
C. Cl2 + dung dịch H2S → |
D. O3 + dung dịch KI →; |
||
Câu 40: Cho các chất Fe, ZnS, Ag, MgO. Số chất tác dụng với H2SO4 loãng và đặc đều cho cùng một loại muối sunfat là
|
A. 1 |
B. 2 |
C. 3 |
D. 4 |
ĐÁP ÁN ĐỀ SỐ 1
|
1 |
B |
11 |
B |
21 |
C |
31 |
B |
|
2 |
A |
12 |
B |
22 |
B |
32 |
A |
|
3 |
C |
13 |
D |
23 |
C |
33 |
B |
|
4 |
C |
14 |
B |
24 |
C |
34 |
C |
|
5 |
A |
15 |
D |
25 |
D |
35 |
D |
|
6 |
A |
16 |
C |
26 |
D |
36 |
D |
|
7 |
D |
17 |
C |
27 |
D |
37 |
B |
|
8 |
C |
18 |
D |
28 |
A |
38 |
A |
|
9 |
A |
19 |
D |
29 |
A |
39 |
C |
|
10 |
A |
20 |
A |
30 |
B |
40 |
B |
ĐỀ SỐ 2
|
Câu 1: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là |
|||
|
A. ns2np4. |
B. ns2np3. |
C. ns2np5. |
D. ns2np6. |
|
Câu 2: Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen đơn chất: |
|||
|
A. tăng dần. |
B. giảm dần. |
C. không thay đổi. |
D. vừa tăng, vừa giảm. |
|
Câu 3: Công dụng nào sau đây không phải của NaCl? |
|||
|
A. Làm thức ăn cho người và gia súc. |
B. Điều chế Cl2, HCl, nước Javen. |
||
|
C. Làm dịch truyền trong y tế. |
D. Khử chua cho đất. |
||
|
Câu 4: Thuốc thử đặc trưng để nhận biết ra hợp chất halogenua trong dung dịch là: |
|||
|
A. AgNO3 |
B. Ba(OH)2 |
C. NaOH |
D. Ba(NO3)2 |
Câu 5: Cho hình vẽ mô tả thí nghiệm điều chế Clo từ MnO2 và dung dịch HCl như sau:
Khí Clo sinh ra thường lẫn hơi nước và khí hiđro clorua. Để thu được khí Clo khô thì bình (1) và bình (2) lần
lượt đựng
A. Dung dịch H2SO4 đặc và dung dịch NaCl.
B. Dung dịch NaCl và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4 đặc và dung dịch AgNO3.
D. Dung dịch NaOH và dung dịch H2SO4 đặc.
Câu 6: Hòa tan hoàn toàn 91,35 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được V lít khí Cl2 (đktc). Gía trị của V là:
|
A. 19,6. B. 23,52. C. 15,68. D. 11,76. |
|
Câu 8: Cho 75 gam hỗn hợp X gồm CaCO3 và KHCO3 tác dụng vừa đủ với m gam dung dịch HCl 20% (d=1,2g/ml). Gía trị của m là:
A. 228,12.
B. 82,5.
C. 270.
D. 273,75.
Câu 9: Cho 11,7 gam hỗn hợp bột Mg và Al tác dụng hết với dung dịch HCl dư thu được dung dịch Y và V lít khí H2 (đktc). Cô cạn dung dịch Y thu được 54,3 gam muối clorua khan. Gía trị của V là:
A. 10,08.
B. 13,44.
C. 3,36.
D. 6,72.
|
Câu 10: Tính chất hóa học của axit clohiđric là: |
|||
|
A. Là axit mạnh, có tính oxi hoá, không có tính khử. |
|||
|
B. Là axit mạnh, có tính khử, không có tính oxi hoá. |
|||
|
C. Là axit mạnh, có tính oxi hoá, có tính khử, dễ bay hơi. |
|||
|
D. Là axit mạnh, có tính oxi hoá, có tính khử. |
|||
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 30 của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 3
I. Trắc nghiệm (6 điểm)
Câu 1: SO2 thể hiện tính oxi hóa khi tác dụng với
A. O2 (xt, to).
B. dung dịch Br2.
C. dung dịch KMnO4.
D. H2S.
Câu 2: Nhận xét nào sau đây là không đúng?
A. Trong đời sống ozon dùng làm chất sát trùng nước sinh hoạt.
B. Ozon có tính oxi hóa mạnh hơn oxi.
C. Trong y học ozon được dùng để chữa sâu răng.
D. Ở điều kiện thường, ozon oxi hóa được vàng.
Câu 3: Dung dịch H2SO4 đậm đặc có thể làm khô được chất nào sau đây?
A. SO3.
B. CO2.
C. H2S.
D. HBr.
Câu 4: Chất nào sau đây không phản ứng được với Cl2?
A. H2.
B. Cu.
C. O2.
D. Mg.
Câu 5: Cho hỗn hợp gồm 6,4 gam Cu và 5,6 gam Fe tác dụng với dung dịch H2SO4 loãng dư thì thể tích khí (đktc) thu được là
A. 2,24 lít.
B. 4,48 lít.
C. 3,36 lít.
D. 5,60 lít.
Câu 6: Trong phòng thí nghiệm khí nào sau đây được thu vào bình bằng cách dời chỗ của nước?
A. O2.
B. HF.
C. SO2.
D. HCl.
Câu 7: Ở trạng thái cơ bản, số electron lớp ngoài cùng của các nguyên tố nhóm halogen bằng
A. 6.
B. 8.
C. 7.
D. 5.
Câu 8: Axit được dùng để khắc chữ lên thủy tinh là
A. HF.
B. HI.
C. HCl.
D. HBr.
Câu 9: Công thức phân tử của clorua vôi là
A. Ca(ClO)2
B. CaOCl2.
C. Ca(ClO3)2.
D. CaO2Cl.
Câu 10: Thể tích dung dịch Ba(OH)2 0,04M cần để trung hòa 25ml dung dịch HCl 0,24M là
A. 300 ml.
B. 75 ml
C. 125 ml.
D. 150 ml.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 17 của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
D |
D |
B |
C |
A |
A |
C |
A |
B |
B |
D |
C |
D |
C |
B |
ĐỀ SỐ 4
Câu 1: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là
A. ns2np4. B. ns2np3. C. ns2np5. D. ns2np6.
Câu 2: Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen đơn chất:
A. tăng dần. B. giảm dần. C. không thay đổi. D. vừa tăng, vừa giảm.
Câu 3: Công dụng nào sau đây không phải của NaCl?
A. Làm thức ăn cho người và gia súc. B. Điều chế Cl2, HCl, nước Javen.
C. Làm dịch truyền trong y tế. D. Khử chua cho đất.
Câu 4: Thuốc thử đặc trưng để nhận biết ra hợp chất halogenua trong dung dịch là:
A. AgNO3
B. Ba(OH)2
C. NaOH
D. Ba(NO3)2
Câu 5: Cho hình vẽ mô tả thí nghiệm điều chế Clo từ MnO2 và dung dịch HCl như sau:
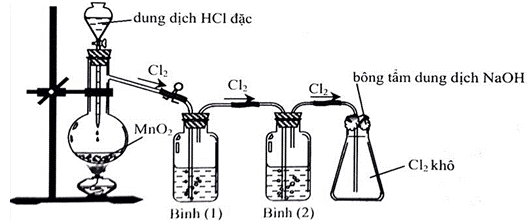
Khí Clo sinh ra thường lẫn hơi nước và khí hiđro clorua. Để thu được khí Clo khô thì bình (1) và bình (2) lần lượt đựng
A. Dung dịch H2SO4đặc và dung dịch NaCl.
B. Dung dịch NaCl và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4đặc và dung dịch AgNO3.
D. Dung dịch NaOH và dung dịch H2SO4 đặc.
Câu 6: Hòa tan hoàn toàn 91,35 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được V lít khí Cl2 (đktc). Gía trị của V là:
A. 19,6.
B. 23,52.
C. 15,68.
D. 11,76.
Câu 7: Phương trình hóa học nào sau đây không thể xảy ra?
A. KBrdung dịch + Cl2 →
B. NaIdung dịch + Br2 →
C. H2Ohơi nóng+ F2 →
D. KBrdung dịch + I2 →
Câu 8: Cho 75 gam hỗn hợp X gồm CaCO3 và KHCO3 tác dụng vừa đủ với m gam dung dịch HCl 20% (d=1,2g/ml). Gía trị của m là:
A. 228,12.
B. 82,5.
C. 270.
D. 273,75.
Câu 9: Cho 11,7 gam hỗn hợp bột Mg và Al tác dụng hết với dung dịch HCl dư thu được dung dịch Y và V lít khí H2 (đktc). Cô cạn dung dịch Y thu được 54,3 gam muối clorua khan. Gía trị của V là:
A. 10,08.
B. 13,44.
C. 3,36.
D. 6,72.
Câu 10: Tính chất hóa học của axit clohiđric là:
A. Là axit mạnh, có tính oxi hoá, không có tính khử.
B. Là axit mạnh, có tính khử, không có tính oxi hoá.
C. Là axit mạnh, có tính oxi hoá, có tính khử, dễ bay hơi.
D. Là axit mạnh, có tính oxi hoá, có tính khử.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 30 của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C |
B |
D |
A |
B |
B |
D |
D |
B |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
C |
D |
B |
A |
C |
A |
A |
C |
D |
B |
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
A |
D |
C |
A |
C |
D |
B |
B |
C |
C |
ĐỀ SỐ 5
Câu 1: Liên kết trong các phân tử đơn chất halogen là gì?
A. Cộng hóa trị không cực. B. Cộng hóa trị có cực.
C. Liên kết ion. D. Liên kết cho nhận.
Câu 2: Chất nào sau đây chỉ có tính oxi hoá, không có tính khử?
A.F2. B. Cl2. C. Br2. D. I2.
Câu 3: Trong những ứng dụng sau, ứng dụng nào không phải của nước Gia-ven?
A. Tẩy uế nhà vệ sinh.
B. Tẩy trắng vải sợi.
C. Tiệt trùng nước.
D. Tiêu diệt vi khuẩn cúm gà H5N1.
Câu 4: Có 4 dung dịch NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận được bao nhiêu dung dịch?
A. 4. B. 2. C. 3 D. 1.
Câu 5: Cho a mol chất X tác dụng hết với dung dịch HCl đặc thu được V lít (đktc) khí Cl2. Vậy X là chất nào sau đây để V có giá trị lớn nhất?
A. MnO2. B. KMnO4. C. KClO3. D. CaOCl2.
Câu 6: Đốt cháy 14,875 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 50,375 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng l
A. 8,96 lít. B. 6,72 lít. C. 17,92 lít. D. 11,2 lít.
Câu 7: Kết luận nào sau đây không đúng với flo?
A. F2 là khí có màu lục nhạt, rất độc.
B .F2 có tính oxi hóa mạnh nhất trong tất cả các phi kim
C. F2 oxi hóa được tất cả kim loại.
D. F2 cháy trong hơi H2O tạo HF và O2
Câu 8: Hòa tan hoàn toàn 30,9 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 34,2 gam hỗn hợp muối clorua. Giá trị của V là
A.3,36. B. 6,72. C. 2,685. D. 8,4.
Câu 9: Cho 26,25 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 7,84 lít khí H2 và m gam chất rắn không tan. Giá trị của m là:
A. 11,2. B. 14,875. C. 3,85. D. 3,5.
Câu 10: Kim loại nào dưới đây tác dụng với dung dịch HCl loãng và tác dụng với khí Clo cho cùng loại muối Clorua kim loại?
A. Fe. B. Zn. C. Cu. D. Ag.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 30 của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 5
|
1A |
2A |
3D |
4A |
5C |
6D |
7C |
8B |
9D |
10B |
|
11B |
12A |
13A |
14D |
15A |
16A |
17B |
18D |
19D |
20C |
|
21D |
22D |
23D |
24B |
25A |
26A |
27C |
28B |
29D |
30C |
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
Trên đây là một phần trích dẫn nội dung Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Bắc Yên Thành. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
- Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Phan Đình Phùng
- Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Yên Lạc 2
Chúc các em học tốt!














