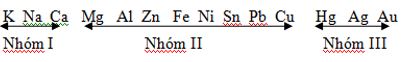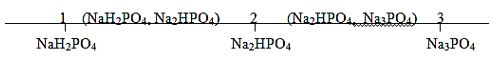Để chuẩn bị cho kì thi học kì 1 sắp tới, HOC247 giới thiệu đến các em tài liệu Đề cương ôn tập HK1 môn Hóa học 11 năm học 2022-2023 bao gồm tóm tắt lý thuyết trọng tâm và các câu hỏi trắc nghiệm Hóa 11 sẽ giúp các em ôn tập các kiến thức đã học. Mời các em tham khảo nội dung tài liệu dưới đây.
1. TÓM TẮT LÝ THUYẾT
1.1. SỰ ĐIỆN LI
A. SỰ ĐIỆN LI
- Sự điện li là quá trình phân li của các chất ra ion.
- Phân loại chất điện li:
+ Chất điện li mạnh là chất khi tan trong nước, tất cả phân tử hòa tan đều phân li ra ion.
Trong phương trình điện li, dùng mũi tên 1 chiều.
Chú ý: Các chất điện li mạnh thường là: Axit mạnh (HCl, HNO3, H2SO4, HClO4…), bazơ mạnh (NaOH, (BaOH)2, KOH, Ca(OH)2,..) và hầu hết muối tan
+ Chất điện li yếu là chất khi tan trong nước chỉ có 1 phần số phân tử hòa tan phân li ra ion.
Trong phương trình điện li, dùng mũi tên 2 chiều
Chú ý: Các chất điện li yếu thường là: Axit yếu, bazơ yếu và muối không tan.
B. AXIT, BAZƠ
Theo thuyết A-rê-ni-ut
- Axit là chất khi tan trong nước phân li ra cation H+. Ví dụ: HCl, H2SO4,…
- Bazơ là chất khi tan trong nước phân li ra anion OH-. Ví dụ: NaOH, Ba(OH)2,…
- Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Ví dụ:
Zn(OH)2 ⇄ Zn2+ + 2OH- : phân li kiểu bazơ
Zn(OH)2 ⇄ ZnO2- + 2H+ : phân li kiểu axit
Theo thuyết Bron-stet
- Axit là chất (phân tử, ion) khi tan trong nước phân li ra cation H+ (proton).
- Bazơ là chất (phân tử, ion) nhận proton.
- Chất lưỡng tính là chất (phân tử, ion) vừa có thể nhường proton, vừa có thể nhận proton.
- Chất trung tính là chất không thể nhường hoặc nhận proton.
C. MUỐI
a. Định nghĩa: Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc NH4+) và anion gốc axit.
b. Phân loại
- Muối trung hòa là muối mà anion gốc axit không còn hiđro có khả năng phân li ra ion H+
- Muối axit là muối mà anion gốc axit vẫn còn hiđro có khả năng phản li ra ion H+
D. TÍCH SỐ ION CỦA NƯỚC, PH VÀ MÔI TRƯỜNG CỦA DUNG DỊCH
Tích số ion của nước
Ở 25oC: \({K_{{H_2}O}} = [{{\rm{H}}^ + }].[O{H^ - }] = {10^{ - 14}}\)
pH của dung dịch
Để đánh giá độ axit và độ kiềm của dung dịch, người ta dùng pH với quy ước: [H+] = 10-pH hay pH = - log[H+]
- Môi trường axit: pH < 7
- Môi trường trung tính: pH = 7
- Môi trường bazơ: pH > 7
Thang pH thường dùng có giá trị từ 1 đến 14
- Các dung dịch có pH < 7 ngoài dung dịch axit còn có muối tạo từ kim loại yếu và gốc axit mạnh ví dụ: FeCl2; CuSO4….
- Các dung dịch có pH > 7 ngoài dung dịch bazơ còn có muối tạo từ kim loại mạnh và gốc axit yếu ví dụ: HCOONa; K2CO3…
- Các dung dịch có pH = 7 ngoài nước còn có muối tạo từ axit mạnh và bazơ mạnh ví dụ: NaCl, K2SO4,..
E. PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
- Phản ứng trao dổi ion trong dung dịch các chất diện li chỉ xảy ra khi thỏa mãn một trong các điều kiện sau:
+ tạo thành chất kết tủa
+ tạo thành chất khí
+ tạo thành chất điện li yếu
1.2. NITO – PHOTPHO
A. NITƠ
- Cấu hình electron N (Z = 7): 1s22s22p3
=> Vị trí ô thứ 7, chu kì 2 nhóm VA trong bảng tuần hoàn.
- Số oxi hóa có thể có : -3; 0; +1; +2; +3; +4; +5
- Cấu tạo và tính chất:
- Cấu tạo: N≡N → N2 rất bền
- Ở điều kiện thường N2 là chất khí không màu, không mùi, không vị, không duy trì sự cháy, sự hô hấp.
- Nhiệt độ thường, N2 khá trơ về mặt hóa học.
- Nhiệt độ cao, N2 vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
+ Tính oxi hóa:
\(\mathop {{N_2}}\limits^0 {\mkern 1mu} + 3Mg\mathop \to \limits^{{t^0}} M{g_3}\mathop {{N_2}}\limits^{ - 3} \)
+ Tính khử:
\(\mathop {{N_2}}\limits^0 {\mkern 1mu} + {O_2}\mathop \to \limits^{{t^0},xt} 2\mathop N\limits^{ + 2} {\mkern 1mu} O\)
- Điều chế:
- Trong công nghiệp: chưng cất phân đoạn không khí lỏng.
- Trong PTN:
NH4Cl + NaNO2 → NaCl + N2↑+ 2H2O
B. AMONIAC (NH3)
Tính chất vật lý:
- Chất khí không màu, có mùi khai và sốc, nhẹ hơn không khí
- Tan rất nhiều trong nước tạo thành dung dịch NH3 không thu bằng phương pháp dời chỗ của nước.
Tính chất hóa học:
- Tính bazơ yếu:
NH3 + H2O ⇄ NH4+ +OH- (NH3 làm quỳ ẩm chuyển sang màu xanh)
NH3(k) + HCl(k) → NH4Cl(r)
3NH3 + 3H2O + AlCl3 → 3NH4Cl + Al(OH)3
- Tính khử:
\(\begin{array}{l}
2\mathop {{\rm{\;}}N}\limits^{ - 3} {\mkern 1mu} {H_3} + 3C{l_2} \to \mathop {{N_2}}\limits^0 {\mkern 1mu} + 6HCl\\
2\mathop {{\rm{\;}}N}\limits^{ - 3} {\mkern 1mu} {H_3} + 3CuO \to \mathop {{N_2}}\limits^0 {\mkern 1mu} + 3{H_2}O + 3Cu
\end{array}\)
Điều chế:
Cho muối amoni tác dụng với dung dịch bazơ
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
C. MUỐI AMONI (NH4Cl, NH4NO3, (NH4)2SO4…)
- Tác dụng với dung dịch kiềm
NH4+ + OH- → NH3 + H2O (phản ứng này dùng để nhận biết ion NH4+ )
- Phản ứng nhiệt phân: Các muối amoni dễ bị nhiệt phân
+ Muối amoni mà gốc axit không còn khả năng oxi hóa nhiệt phân tạo NH3
\({\left( {N{H_4}} \right)_2}C{O_3}\;\mathop \to \limits^{{t^0}} N{H_3}\; + {\rm{ }}C{O_2}\; + {\rm{ }}{H_2}O\)
+ Muối amoni mà gốc axit có khả năng oxi hóa nhiệt phân tạo N2 hoặc N2O
\(\begin{array}{l}
\mathop N\limits^{ - 3} {H_4}N{O_2}\mathop \to \limits^{{t^0}} \mathop {{N_2}}\limits^0 + 2{H_2}O\\
\mathop N\limits^{ - 3} {H_4}N{O_3}\mathop \to \limits^{{t^0}} \mathop {{N_2}}\limits^{ + 1} O + 2{H_2}O
\end{array}\)
D. AXIT NITRIC (HNO3)
- Tính axit mạnh:
- Làm đỏ quỳ tím.
- Tác dụng với bazơ, oxit bazơ, muối
- Tính oxi hóa mạnh: HNO3 oxi hóa hầu hết các kim loại kể cả những kim loại đứng sau H như Cu, Ag (trừ Pt, Au), oxi hóa kim loại lên số oxi hóa dương cao nhất, oxi hóa nhiều phi kim và hợp chất.
- Sản phẩm khử: thông thường là NO ngoài ra còn có thể là NO2, N2, N2O, (NH4NO3)
Chú ý: Fe, Al, Cr thụ động với HNO3 đặc, nguội.
- Điều chế:
- Trong PTN:
NaNO3(tinh thể) + H2SO4(đặc) → NaHSO4 + HNO3
- Trong công nghiệp:
\(N{H_3}\mathop \to \limits^{ + {O_2}} NO\mathop \to \limits^{ + {O_2}} N{O_2}\mathop \to \limits^{ + {O_2} + {H_2}O} HN{O_3}\)
E. MUỐI NITRAT (Chứa ion NO3-)
Tính chất hóa học
- Dễ bị phân hủy bởi nhiệt
Nhóm I nhiệt phân tạo muối nitrơ và O2:
Nhóm II nhiệt phân tạo oxit, NO2 và O2:
Nhóm III nhiệt phân tạo kim loại, NO2 và O2:
- Nhận biết ion NO3-: sử dụng: Cu + H2SO4 (hoặc HCl) (xuất hiện dd xanh lam và khí không màu hóa nâu)
Ứng dụng: Thuốc nổ đen(thuốc nổ có khói): KNO3 + S + C
F. PHOTPHO
Tính chất vật lí
- Photpho trắng: Rất độc, gây bỏng nặng khi rơi vào da, ở nhiệt độ thường phát quang màu lục nhạt trong bóng tối, bốc cháy trong không khí ở nhiệt độ > 400C
- Photpho đỏ: Là chất bột màu đỏ, dễ hút ẩm và chảy rữa, cấu trúc polime → khó nóng chảy và khó bay hơi hơn photpho trắng, không tan trong các dung môi thông thường, bền trong không khí ở nhiệt độ thường, bốc cháy ở nhiệt độ > 2500C
Tính chất hóa học
Photpho hoạt động hóa học mạnh hơn nitơ
- Tính oxi hóa:
P + kim loại hoạt động → photphua kim loại
- Tính khử
P + oxi
P + halogen
Ứng dụng:
- Sản xuất axit photphoric
- Sản xuất diêm, bom, đạn…
Sản xuất:
\(C{a_3}{\left( {P{O_4}} \right)_2}\; + {\rm{ }}3Si{O_2}\; + {\rm{ }}5C\mathop \to \limits^{{{120}^0}} \;3CaSi{O_3}\; + {\rm{ }}2P{\rm{ }} + {\rm{ }}5CO\)
G. AXIT PHOTPHORIC (H3PO4)
Tính chất vật lí
- Là chất rắn dạng tinh thể, trong suốt, không màu, rất háo nước => dễ chảy rữa
- Axit photphoric thường dùng là dung dịch đặc, sánh
Tính chất hóa học:
- Tính oxi hóa – khử:
Photpho có mức oxi hóa +5 bền hơn nitơ => axit H3PO4 khó bị khử => không có tính oxi hóa như axit HNO3
- Tính axit:
+ Axit H3PO4 là axit ba lần axit, có độ mạnh trung bình => Có đầy đủ tính chất chung của axit
+ Tác dụng với bazơ: Sản phẩm tạo thành phụ thuộc vào x
Đặt \({\rm{x = }}\frac{{{{\rm{n}}_{{\rm{NaOH}}}}}}{{{{\rm{n}}_{{{\rm{H}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}}}}}\)
Điều chế
- Trong phòng thí nghiệm:
\(P{\rm{ }} + {\rm{ }}5HN{O_3}_{\left( d \right)}\mathop \to \limits^{{t^0}} {H_3}P{O_4}\; + {\rm{ }}5N{O_2}\; \uparrow {\rm{ }} + {\rm{ }}{H_2}O\)
- Trong công nghiệp:
\(C{a_3}{\left( {P{O_4}} \right)_2}\; + {\rm{ }}3{H_2}S{O_{4(d)}}\;\mathop \to \limits^{{t^0}} 3CaS{O_4} \downarrow {\rm{ }} + {\rm{ }}2{H_3}P{O_4}\)
H. MUỐI PHOTPHAT (PO43-)
Tính tan:
- Tất cả các muối đihiđrophotphat đều tan trong nước
- Muối photphat trung hòa và muối hiđrophotphat: trừ muối Na+, K+, NH4+ là dễ tan, còn lại đều không tan hoặc ít tan trong nước.
Nhận biết ion photphat:
Dùng thuốc thử AgNO3 :
3Ag+ + PO43- → Ag3PO4màu vàng
1.3. CACBON – SILIC
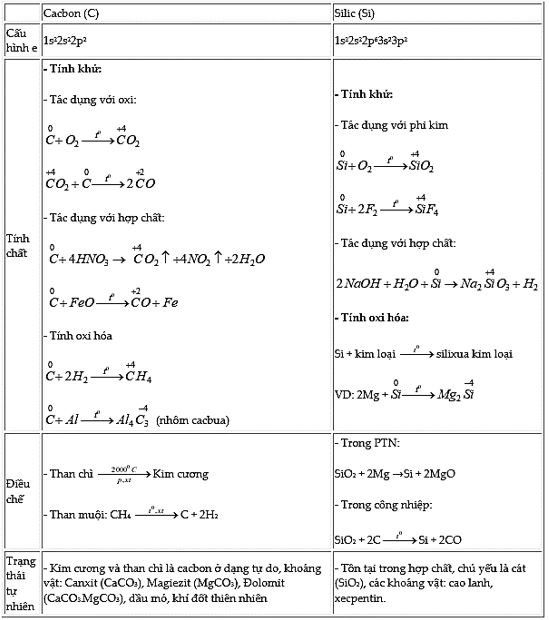
A. Nhóm Cacbon:
- Vị trí: nhóm IVA; thành phần: C, Si, Ge, Sn, Pb
- Cấu hình e: ns2np2
- Các tính chất biến đổi có quy luật của đơn chất và hợp chất: C → Pb
B. Đơn chất
C. Hợp chất
|
Tên |
CTHH |
Tính chất |
|
Cacbon đioxit |
CO2 |
- Khí, nặng hơn KK, không cháy, không duy trì sự cháy - Là một oxit axit tác dụng với bazơ: OH- + CO2 → CO32- +H2O. OH + CO2 → HCO3- Đặt \({\rm{x = }}\frac{{{{\rm{n}}_{{\rm{O}}{{\rm{H}}^{\rm{ - }}}}}}}{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}}}\) Sản phẩm tạo thành phụ thuộc vào x Tính oxi hóa yếu |
|
Cacbon monooxit |
CO |
- Khí, bền, độc - Là một oxit trung tính. - Là chất khử mạnh: chỉ khử được các oxit của kim loại yếu hơn Al |
|
Axit cacbonic |
H2CO3 |
- Là axit rất yếu và kém bền - Phân li 2 nấc - Dễ bị phân hủy: H2CO3 → CO2↑ + H2O |
|
Muối cacbonat |
CO32-
HCO3- |
- Dễ tan - Tính chất hóa học: + Muối CO32- có tính bazơ: CO32- + 2H+ → H2O + CO2 + Muối HCO3- có tính lưỡng tính: HCO3- + H+ → H2O + CO2 HCO3- + OH- → CO32- + H2O - Phản ứng nhiệt phân: 2NaHCO3 \(\mathop \to \limits^{{t^0}} \) Na2CO3 + CO2↑ + H2O CaCO3 \(\mathop \to \limits^{{t^0}} \) CaO + CO2↑ |
|
Silic đioxit |
SiO2 |
- Không tan trong nước, chất ở dạng tinh thể thạch anh. - Tính chất: + Tính chất oxit axit: SiO2 + 2NaOH(nóng chảy) \(\mathop \to \limits^{{t^0}} \) Na2SiO3 + H2O - Tác dụng với HF: SiO2 + 4HF → SiF4 + 2H2O → Dùng HF khắc chữ lên thủy tinh |
|
Axit Silixic |
H2SiO3 |
- Là axit rất yếu tồn tại ở thể rắn (< H2CO3) Na2SiO3 + CO2 + H2O → H2SiO3↓ + Na2CO3 |
|
Muối Silicat |
SiO32- |
- Thủy tinh lỏng: Na2SiO3 và K2SiO3 - Phản ứng thủy phân: Na2SiO3 + 2H2O → 2NaOH + H2SiO3 |
1.4. ĐẠI CƯƠNG HÓA HỮU CƠ
A. MỞ ĐẦU VỀ HÓA HỌC HỮU CƠ
Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, muối cacbonat…).
- Hóa học hữu cơ là nghành hóa học nghiên cứu các hợp chất hữu cơ.
Phân loại hợp chất hữu cơ
- Thường chia thành hai loại
+ Hiđrocacbon
+ Dẫn xuất hiđrocacbon
Đặc điểm chung của hợp chất hữu cơ
- Đặc điểm cấu tạo: Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Tính chất vật lý:
+ Nhiệt độ nóng chảy, nhiệt độ sôi thấp.
+ Phần lớn không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ.
- Tính chất hóa học:
+ Các hợp chất hữu cơ thường kém bền với nhiệt và dễ cháy.
+ Phản ứng hóa học của các hợp chất hữu cơ thường xảy ra chậm và theo nhiều hướng khác nhau, nên tạo ra hỗn hợp nhiều sản phẩm.
Sơ lược về phân tích nguyên tố
a. Phân tích định tính:
Chuyển các nguyên tố trong hợp chất hữu cơ thành các chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
b. Phân tích định lượng
Cân chính xác khối lượng hợp chất hữu cơ, sau đó chuyển nguyên tố C → CO2, H → H2O, N → N2, sau đó xác định chính xác khối lượng hoặc thể tích của các chất tạo thành, từ đó tính % khối lượng các nguyên tố.
\(\begin{array}{l}
\% C{\rm{ }} = {\rm{ }}\frac{{{m_C}.100}}{a}\\
\% H{\rm{ }} = {\rm{ }}\frac{{{m_H}.100}}{a}\\
\% H{\rm{ }} = {\rm{ }}\frac{{{m_N}.100}}{a}
\end{array}\)
%O = 100 - %C - %H - %N
2. BÀI TẬP
Câu 1: Metol C10H20O và menton C10H18O chúng đều có trong tinh dầu bạc hà. Biết phân tử metol không có nối đôi, còn phân tử menton có 1 nối đôi. Vậy kết luận nào sau đây là đúng ?
A. Metol có cấu tạo vòng, menton có cấu tạo mạch hở.
B. Metol và menton đều có cấu tạo mạch hở.
C. Metol có cấu tạo mạch hở, menton có cấu tạo vòng.
D. Metol và menton đều có cấu tạo vòng.
Câu 2: Để điều chế CO2 trong phòng thí nghiệm người ta cho dung dịch HCl tác dụng với CaCO3 trong bình kíp. Do đó CO2 thu được thường có lẫn một ít hiđroclorua và hơi nước. Có thể dùng hoá chất theo thứ tự nào sau đây để thu được CO2 tinh khiết ?
A. P2O5 và KHCO3.
B. H2SO4 đặc và NaOH.
C. P2O5 và NaOH.
D. K2CO3 và P2O5.
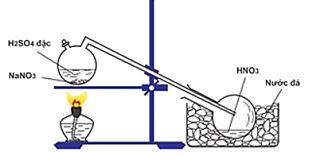
Câu 3: Cho sơ đồ điều chế HNO3 trong phòng thí nghiệm:
Phát biểu nào sau đây là sai khi nói về quá trình điều chế HNO3?
A. Đốt nóng bình cầu bằng đèn cồn để phản ứng xảy ra nhanh hơn.
B. HNO3 có nhiệt độ sôi thấp (830C) nên dễ bị bay hơi khi đun nóng.
C. HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối.
D. HNO3 sinh ra dưới dạng hơi nên cần làm lạnh để ngưng tụ.
Câu 4: Cho 1,32 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là
A. NH4H2PO4 và (NH4)2HPO4.
B. (NH4)3PO4.
C. NH4H2PO4.
D. (NH4)2HPO4.
Câu 5: pH dung dịch X gồm NaOH 0,04M và KOH 0,06M bằng
A. 13
B. 12
C. 1
D. 2
Câu 6: Phương trình ion rút gọn của phản ứng cho biết:
A. Những ion nào tồn tại trong dung dịch.
B. Bản chất của phản ứng trong dung dịch các chất điện li.
C. Nồng độ những ion nào trong dung dịch lớn nhất.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 7: Hoà tan hết 18,8 gam hỗn hợp Fe; FeO; Fe3O4; Fe2O3 trong dung dịch HNO3 đặc nóng dư được 3,36 lít khí NO2 (đktc, sản phẩm khử duy nhất) và dd Y. Cô cạn dung dịch Y được m gam muối. Giá trị của m:
A. 65,3
B. 60,5
C. 64,9
D. 28,1
Câu 8: Dẫn luồng khí CO du qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (dun nóng) sau khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm :
A. Al2O3, Cu, Mg, Fe.
B. Al2O3, Cu, MgO, Fe.
C. Al, Fe, Cu, Mg
D. Al2O3, Fe2O3, Cu, MgO.
Câu 9: Phân lân supephotphat đơn có thành phần hóa học là:
A. Ca3(PO4)2
B. Ca(H2PO4)2 và Ca3(PO4)3
C. Ca(H2PO4)2
D. Ca(H2PO4)2 và CaSO4.2H2O
Câu 10: Hãy nêu khái niệm đúng nhất về hóa học hữu cơ.
A. Hóa học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV)oxit.
B. Hóa học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ các muối cacbonat.
C. Hóa học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon.
D. Hóa học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV)oxit và các muối cacbonat.
ĐÁP ÁN
|
1 |
D |
6 |
B |
11 |
B |
16 |
B |
21 |
A |
26 |
C |
|
2 |
A |
7 |
B |
12 |
A |
17 |
AC |
22 |
C |
27 |
C |
|
3 |
C |
8 |
B |
13 |
D |
18 |
A |
23 |
B |
28 |
B |
|
4 |
C |
9 |
D |
14 |
B |
19 |
D |
24 |
D |
29 |
D |
|
5 |
A |
10 |
D |
15 |
D |
20 |
B |
25 |
B |
30 |
D |
Trên đây là một phần trích đoạn nội dung Đề cương ôn tập HK1 môn Hóa học 11 năm học 2022-2023. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.