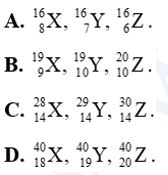HỌC247 xin giới thiệu đến các em học sinh Đề cương ôn tập giữa HK1 môn Hóa học 10 KNTT năm 2022-2023 bao gồm các kiến thức trọng tâm và câu hỏi ôn tập có đáp án hướng dẫn chi tiết giúp các em ôn tập rèn luyện kĩ năng, củng cố kiến thức, chuẩn bị cho kì thi giữa HK1 sắp tới. Chúc các em đạt được kết quả học tập tốt!
ĐỀ CƯƠNG ÔN TẬP GIỮA HỌC KÌ I
MÔN HÓA HỌC 10 KNTT
NĂM HỌC 2022-2023
1. TÓM TẮT LÝ THUYẾT
1.1. THÀNH PHẦN CỦA NGUYÊN TỬ
Cấu tạo nguyên tử
- Thành phần cấu tạo của nguyên tử gồm:
+ Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp ).
+ Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
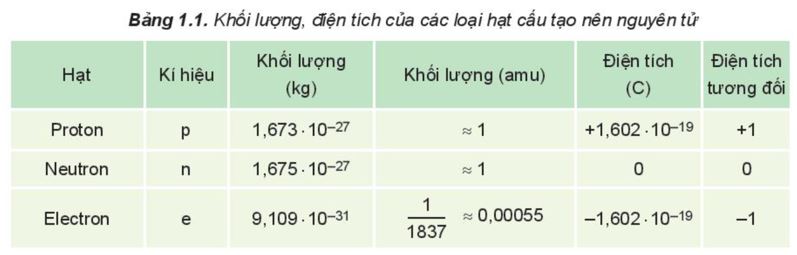
- Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử:
Chú ý: Trong nguyên tử, số proton bằng số electron.
Kích thước và khối lượng nguyên tử
- Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử
- Khối lượng nguyên tử tập trung ở hạt nhân (do khối lượng của electron rất nhỏ so với khối lượng của proton và neutron).
1.2. NGUYÊN TỐ HÓA HỌC
Số khối
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Kí hiệu nguyên tử
Đồng vị
- Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
- Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ) của hỗn hợp các đồng vị của nguyên tố đó.
1.3. CẤU TRÚC LỚP VỎ ELECTRON NGUYÊN TỬ
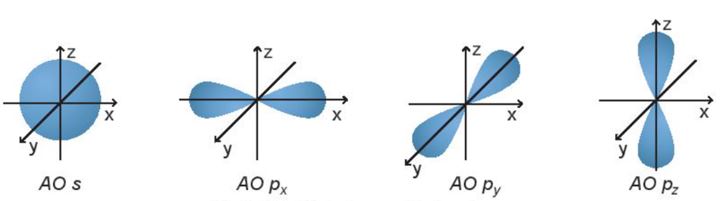
Hình dạng orbital nguyên tử
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
Lớp và phân lớp electron
|
n |
1 |
2 |
3 |
4 |
|
Lớp electron |
K |
L |
M |
N |
|
Phân lớp |
1s |
2s, 2p |
3s, 3p, 3d |
4s, 4p, 4d, 4f |
|
Số AO (n2) |
1 |
4 |
9 |
16 |
|
Số electron tối đa (2n2) |
2 |
8 |
18 |
32 |
Chú ý:
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Trong lớp electron thứ n có n2 AO (n ≤ 4).
1.4. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
- Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
- Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s2s2p3s3p4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
|
Đặc điểm của lớp electron ngoài cùng |
|||||
|
Số electron |
1, 2, 3 |
4 |
5, 6, 7 |
8 |
|
|
Loại nguyên tố |
Kim loại |
Kim loại hoặc phi kim |
Phi kim |
Khí hiếm (trừ He) |
|
1.5. CẤU TẠO BẢNG TUẦN HOÀN
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron → cùng chu kì (hàng).
- Cùng số electron hóa trị → cùng nhóm (cột).
Trong bảng tuần hoàn (đến năm 2016) có 118 nguyên tố, 7 chu kì và 18 nhóm.
Chú ý:
Số proton = số electron = số hiệu nguyên tử = số Z
Số thứ tự chu kì = số lớp electron
Số thứ tự nhóm A = số electron lớp ngoài cùng
1.6. XU HƯỚNG BIẾN ĐỔI TRONG BẢNG TUẦN HOÀN
Bán kính nguyên tử
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Giá trị độ âm điện
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
Tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
Tính acid – base của các oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
1.7. ĐỊNH LUẬT TUẦN HOÀN
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
2. BÀI TẬP
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A. Tốc độ ánh sáng trong chân không.
B. Cấu tạo của chất và sự biến đổi của chất.
C. Quá trình phân chia tế bào.
D. Sự hình thành hệ Mặt Trời.
Câu 2: Trong thành phần nguyên tử, những hạt mang điện tích là
A. proton và alpha.
B. proton và neutron.
C. proton và electron.
D. electron và neutron.
Câu 3: Nguyên tử không mang điện vì
A. có tổng số hạt proton bằng tổng số hạt electron.
B. có tổng số hạt electron bằng tổng số hạt neutron.
C. tổng số hạt neutron bằng tổng số hạt proton.
D. được tạo nên bởi các hạt không mang điện.
Câu 4: Nếu đường kính của hạt nhân nguyên tử khoảng 10-2 pm thì đường kính của nguyên tử khoảng
A. 102 pm.
B. 10-4 pm.
C. 10-2 pm.
D. 104 pm.
Câu 5: Trong tự nhiên, argon có các đồng vị 40Ar, 38Ar, 36Ar chiếm tương ứng khoảng 99,604%, 0,063% và 0,333% số nguyên tử. Nguyên tử khối trung bình của Ar gần nhất với đáp án là
A. 36,99.
B. 38,99.
C. 39,66.
D. 39,99.
Câu 6: Nguyên tử potassium (K) có 19 electron; 19 proton và 20 neutron. Số khối của nguyên tử potassium là
A. 20.
B. 19.
C. 39.
D. 58.
Câu 7: Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
Câu 8: Tất cả các nguyên tử có số đơn vị điện tích hạt nhân là 8 đều thuộc nguyên tố nào sau đây?
A. Hydrogen.
B. Helium.
C. Carbon.
D. Oxygen.
Câu 9: Orbital nguyên tử (kí hiệu là AO) là
A. khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy proton trong khu vực đó là lớn nhất (khoảng 90%).
B. khu vực không gian trong hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
C. khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là nhỏ nhất (khoảng 10%).
D. khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Câu 10: Mỗi orbital nguyên tử chứa tối đa bao nhiêu electron?
A. 1 electron.
B. 2 electron.
C. 3 electron.
D. 4 electron.
Câu 11: Lớp M có số phân lớp electron là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 12: Orbital p có dạng hình gì?
A. Hình cầu.
B. Hình tròn.
C. Hình bầu dục.
D. Hình số tám nổi.
Câu 13: Nguyên tử của nguyên tố neon (Z = 10) có cấu hình electron là
A. 1s22s22p63s2.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p43s2.
Câu 14: Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số electron độc thân là
A. 1.
B. 2.
C. 0.
D. 3.
Câu 15: Mendeleev sắp xếp các nguyên tố hóa học vào bảng tuần hoàn dựa theo quy luật về
A. số hiệu nguyên tử.
B. số khối.
C. khối lượng nguyên tử.
D. cấu hình electron.
Câu 16: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
A. chu kì.
B. ô nguyên tố.
C. nhóm.
D.bảng tuần hoàn.
Câu 17: Nguyên tố Mg thuộc chu kì 3 của bảng tuần hoàn. Nguyên tử nguyên tố Mg có số lớp electron là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 18: Bảng tuần hoàn hiện nay có bao nhiêu cột?
A. 2.
B. 8.
C. 18.
D. 32.
Câu 19: Trong các nguyên tố O, F, Cl, Se, nguyên tố có tính phi kim mạnh nhất là
A. O.
B. F.
C. Se.
D. Cl.
Câu 20: Xét ba nguyên tử nguyên tố có cấu hình electron lần lượt là
X: 1s22s22p63s1
Q: 1s22s22p63s2
Z: 1s22s22p63s23p1
Tính base tăng dần của các hydroxide là
A. XOH < Q(OH)2 < Z (OH)3.
B. Z(OH)3 < XOH < Q (OH)2.
C. Z(OH)3 < Q(OH)2 < XOH.
D. XOH < Z(OH)2 < Q(OH)2.
Câu 21: Phát biểu nào sau đây là sai?
A.Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
B. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
C. Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
D. Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron
Câu 22: Trong các hydroxide dưới đây. Hydroxide lưỡng tính là
A. Al(OH)3.
B. Mg(OH)2.
C.NaOH.
D.LiOH.
Câu 23: X là nguyên tố nhóm IIA. Công thức oxide ứng với hóa trị cao nhất của X là
A. XO.
B. XO2.
C. X2O.
D. X2O2.
Câu 24: Nguyên tố X thuộc chu kì 3 nhóm VIIA. Công thức hóa học của hydroxide (ứng với hóa trị cao nhất) của X là
A. H2XO3.
B. HX.
C. H2XO4.
D. HXO4.
Câu 25: Nguyên tử X có 15 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
A. 4.
B. 2.
C. 5.
D. 3.
Câu 26: Yếu tố nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Tính kim loại.
B. Tính acid – base của các hydroxide.
C. Khối lượng nguyên tử.
D. Tính phi kim.
Câu 27: Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố Ca là 20.
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Hạt nhân của nguyên tử Ca có 20 proton
D. Nguyên tố Ca là một nguyên tố phi kim.
Câu 28: Đại lượng đặc trưng cho khả năng hút electron của một nguyên tử khi tạo thành liên kết hóa học là
A. bán kính nguyên tử.
B. độ âm điện.
C. năng lượng ion hóa.
D. điện tích hạt nhân.
Câu 29: Nguyên tố M thuộc chu kì 3, nhóm VA của bảng tuần hoàn. Số hiệu nguyên tử của nguyên tố M là
A. 16.
B. 14.
C. 15.
D. 13.
Câu 30: Cấu hình eletron lớp ngoài cùng của nguyên tố X là 3s1. Oxide cao nhất của X có tính chất nào sau đây?
A. Tính kim loại.
B. Tính phi kim.
C. Tính acid.
D. Tính base.
ĐÁP ÁN
|
1-B |
2-C |
3-A |
4-A |
5-D |
6-C |
7-C |
8-D |
9-D |
10-B |
|
11-C |
12-D |
13-B |
14-A |
15-C |
16-A |
17-C |
18-C |
19-B |
20-C |
|
21-C |
22-A |
23-A |
24-D |
25-D |
26-C |
27-D |
28-B |
29-C |
30-D |
Trên đây là toàn bộ nội dung tài liệu Đề cương ôn tập giữa HK1 môn Hóa học 10 KNTT năm 2022-2023. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Đề cương ôn tập giữa HK1 môn Công nghệ 10 KNTT năm 2022-2023
- Đề cương ôn tập giữa HK1 môn Sinh học 10 KNTT năm 2022-2023
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.


.JPG)