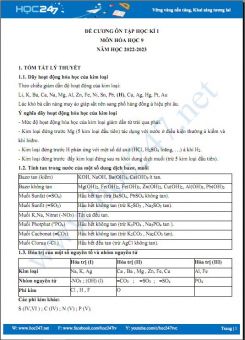
HOC247 giới thiệu đến các em học sinh tài liệu Bộ 5 đề thi HK1 môn Hóa học 9 có đáp án năm 2022-2023 Trường THCS Lê Quý Đôn được HOC247 biên soạn và tổng hợp giúp các em ôn tập kiến thức và củng cố kĩ năng làm bài tập Hóa học 9. Hi vọng tài liệu này giúp các em ôn tập hoàn thành tốt bài kiểm tra trong kì thi HK1 sắp tới. Chúc các em học tập tốt!
1. ĐỀ SỐ 1
I. Trắc nghiệm
Câu 1. Oxit nào sau đây là oxit axit ?
A. NO.
B. MgO.
C. Al2O3.
D. SO2.
Câu 2. Chất không phản ứng với dung dịch H2SO4 loãng là
A. Ag.
B. Al.
C. CuO.
D. Fe.
Câu 3. Công thức hóa học của sắt (III) hiđroxit là
A. Fe(OH)2.
B. Fe2O3.
C. Fe(OH)3.
D. Fe3O4.
Câu 4. Canxi oxit được dùng để làm khô chất khí nào dưới đây ?
A. H2.
B. CO2.
C. SO2.
D. HCl.
Câu 5. Cho các phát biểu sau:
(a) Nhỏ dung dịch HCl vào CaCO3 có bọt khí thoát ra.
(b) Nhỏ dung dịch H2SO4 vào dung dịch Cu(NO3)2 có kết tủa tạo thành.
(c) Nhỏ dung dịch NaOH vào dung dịch MgSO4 có kết tủa tạo thành.
(d) Trong công nghiệp NaOH được điều chế bằng phương pháp điện phân (có màng ngăn) dung dịch NaCl bão hòa.
(e) Dùng quỳ tím có thể phân biệt được ba dung dịch riêng biệt: NaOH, H2SO4, Na2SO4.
Số phát biểu đúng là
A. 5.
B. 2.
C. 4.
D. 3.
II. Tự luận
Câu 1. Hoàn thành các phương trình hóa học biểu diễn dãy chuyển đổi hóa học sau :
Fe → Fe3O4 → FeCl3 → Fe(OH)3 → Fe2O3
Câu 2. Cho 3,1 gam natri oxit tác dụng với nước, thu được 1 lít dung dịch A.
a) Dung dịch A là dung dịch axit hay bazơ? Tính nồng độ mol/lít của dung dịch A.
b) Tính thể tích dung dịch H2SO4 9,6%, khối lượng riêng 1,14 g/ml cần dùng để trung hoà dung dịch A. Biết: Fe (56), H (1), S (32), O (16), Na (23).
Câu 3. Đọc đoạn thông tin sau và trả lời câu hỏi
CaO được sản xuất bằng lò nung vôi thủ công và lò nung vôi công nghiệp. Hàng năm thế giới sản xuất hàng trăm triệu tấn CaO (nước Anh có sản lượng 2 triệu tấn/năm, Mỹ: 20 triệu tấn/năm, ...). Việc sử dụng CaO hàng năm trên thế giới được thống kê như sau : 45% dùng cho công nghiệp luyện kim (chủ yếu là gang và thép); 30% dùng làm nguyên liệu cho công nghiệp hóa học; 10% dùng làm chất bảo vệ môi trường; 10% dùng trong ngành xây dựng; 5% dùng chế tạo vật liệu chịu lửa.
a) Dựa vào đoạn thông tin trên, nêu ứng dụng của CaO.
b) Trình bày ưu điểm lò nung vôi công nghiệp và nhược điểm của lò nung vôi thủ công. Tại sao không nên đặt lò nung vôi thủ công gần khu dân cư ?.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 01, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 1
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
|
D |
A |
C |
A |
C |
B |
|
7 |
8 |
9 |
10 |
11 |
12 |
|
B |
C |
D |
B |
D |
C |
Câu 1. Hoàn thành các phương trình hóa học biểu diễn dãy chuyển đổi hóa học sau :
\(\begin{array}{l}
(1) 3Fe + 2{O_2}\mathop \to \limits^{{t^o}} F{e_3}{O_4}\\
(2) F{e_3}{O_4} + 8HCl \to FeC{l_2} + 2FeC{l_3} + 4{H_2}O\\
(3) FeC{l_3} + 3NaOH \to Fe{(OH)_3} \downarrow + 3NaCl\\
(4) 2Fe{(OH)_3}\mathop \to \limits^{{t^o}} F{e_2}{O_3} + 3{H_2}O
\end{array}\)
Câu 2.
a) Phương trình hóa học xảy ra:
\(N{{a}_{2}}O+{{H}_{2}}O\to 2NaOH\)
Dung dịch A là dung dịch bazơ.
Số mol của Na2O:
\({{n}_{N{{a}_{2}}O}}=\frac{3,1}{62}=0,05 (mol)\)
Theo phương trình ta có:
\({{n}_{NaOH}}=2{{n}_{N{{a}_{2}}O}}=0,1 (mol)\)
Nồng độ mol/l của dung dịch A:
\({{C}_{NaOH}}=\frac{0,1}{1}=0,1 (mol/l)\)
b)
Phương trình hóa học xảy ra:
\(\begin{array}{l} 2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O\\ 0,1mol 0,05 mol \end{array}\)
Khối lượng H2SO4:
\({{m}_{{{H}_{2}}S{{O}_{4}}}}=0,05\times 98=4,9 (g)\)
Khối lượng dung dịch H2SO4:
\({{m}_{dd}}=\frac{4,9}{9,6%}\times 100%=51,042 (g)\)
Thể tích dung dịch H2SO4:
\({{V}_{dd}}=\frac{51,046}{1,14}=44,77 (ml)\)
2. ĐỀ SỐ 2
I. Trắc nghiệm
Câu 1: Khí CO2 làm đục dung dịch nào sau đây?
A. CuSO4
B. HCl
C. Ca(OH)2
D. CuCl2
Câu 2: Nhóm bazơ mà dung dịch nào làm quỳ tím chuyển sang màu xanh
A. Ba(OH)2, NaOH, KOH.
B. Fe(OH)3, Cu(OH)2, Al(OH)3
C. Ba(OH)2, NaOH, Fe(OH)3
D. Cu(OH)2, Al(OH)3, KOH.
Câu 3: Dung dịch muối CuSO4 có thể phản ứng được với chất nào sau đây?
A. NaOH
B.CuCl2
C. AgNO3
D. Cu(OH)2
Câu 4: Một trong những thuốc thử nào sau đây có thể dùng để phân biệt dung dịch muối Na2CO3 và Na2SO4?
A. ddMgCl2
B. Pb(NO3)2
C.dd AgNO3
D. dd HCl
Câu 5: Để điều chế NaOH trong công nghiệp cần điện phân hợp chất nào sau đây?:
A.CaCO3
B. NaCl
C. Al2O3
D.H2O
II. Tự luận
Câu 1. Viết phương trình hóa học hoàn thành sơ đồ chuyển hóa sau( ghi rõ điều kiện nếu có)
Al → Al2O3 → Al2(SO4)3 → Al(OH)3 → AlCl3.
Câu 2.
Thả một mảnh Cu vào các ống nghiệm có chứa các dung dịch sau:
a) AgNO3
b) H2SO4 loãng
c) H2SO4 đăc, nóng
d) MgSO4.
Em hãy cho biết hiện tượng xảy ra trong các trường hợp trên.Viết phương trình hóa học nếu có.
Câu 3. Cho một khối lượng mạt sắt dư vào 50 ml dung dịch HCl. Phản ứng xong, thu được 3,36 lít khí (đktc).
a) Viết phương trình hóa học.
b) Tính khối lượng mạt sắt đã tham gia phản ứng.
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Câu 4.Cho 13,5 gam kim loại M có hoá trị III tác dụng vói Cl2 dư thu được 66,75 gam muối . Hãy xác định kim loại đã dùng.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 02, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
C |
A |
A |
D |
B |
C |
D |
B |
Câu 1
4Al + 3O2 \(\mathop \to \limits^{{t^o}} \) 2Al2O3
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3 H2O
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3 + 3 BaSO4
Al(OH)3 + 3 HCl → AlCl3 + 3 H2O
Câu 2
- Trường hợp a: Có chất rắn màu trắng xám bám vào mảnh đồng dung dịch dần dần chuyển sang màu xanh đó là Cu(NO3)2.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
- Trường hợp b: Không có hiện tượng gì xảy ra vì Cu đứng sau H trong dãy hoạt động hóa học nên không phản ứng với dung dịch H2SO4 loãng
- Trường hợp c: Khi cho đồng vào H2SO4 đặc đun nóng có khí thoát ra, khí này có mùi hắc và dung dịch chuyển thành màu xanh đó là đồng sunfat CuSO4
Cu + 2H2SO4 (đ) → CuSO4 + 2H2O + SO2
- Trường hợp d : không có hiện tượng gì xảy ra vì Cu đứng sau kim loại Mg trong dãy HĐHH nên không đẩy được Mg ra khỏi dung dịch muối
3. ĐỀ SỐ 3
I. Trắc nghiệm
Câu 1. Dãy tất cả các chất gồm oxit axit là
A. CO2, SO2, NO.
B. CO2, SO3, Na2O.
C. SO2, P2O5, NO2.
D. H2O, CO, NO.
Câu 2. Đâu là ứng dụng của CaO?
A. Sản xuất H2SO4.
B. Khử chua đất.
C. Tẩy trắng gỗ.
D. Gây mưa axit.
Bài 3. Hòa tan hết 8,4 gam CaO vào 100 gam nước thu được dung dịch A. Nồng độ % của A là
A. 12,45%.
B. 12%.
C. 11,36%.
D. 10,06%.
Câu 4. Phản ứng hóa học nào sau đây viết sai?
A. Ca + H2SO4 à CaSO4 + H2.
B. NaOH + HCl à NaCl + H2O.
C. 2Ag + H2SO4 à Ag2SO4 + H2.
D. FeO + 2HCl à FeCl2 + H2O.
Câu 5. Muốn pha loãng axit sunfuric đặc ta phải
A. Rót nước vào axit đặc.
B. Rót từ từ nước vào axit đặc.
C. Rót nhanh axit đặc vào nước.
D. Rót từ từ axit đặc vào nước.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 03, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
|
C |
B |
A |
C |
D |
|
6 |
7 |
8 |
9 |
10 |
|
C |
A |
C |
A |
B |
|
11 |
12 |
13 |
14 |
15 |
|
C |
B |
B |
B |
A |
Câu 1:
- Trích mẫu thử có đánh dấu tương ứng
- Cho dung dịch Phenolftalein vào các mẫu thử
=> Nhận ra dd NaOH vì làm Phenolftalein hoá hồng
- Cho dung dịch KOH vừa nhận biết được ở trên vào 2 mẩu thử còn lại
+ Có xuất hiện kết tủa trắng là MgCl2
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
( trắng)
+ Mẩu thử không có hiện tượng gì là KCl
Câu 2
Phương trình hóa học:
\(Fe + CuS{O_4} \to FeS{O_4} + C{u^{}}\)
\(\begin{array}{l} {n_{Fe}} = \frac{{5,6}}{{56}} = 0,1(mol)\\ {m_{CuS{O_4}}} = \frac{{24}}{{160}} = 0,15mol \end{array}\)
Theo (1) nFe : nCuSO4 = 1 : 1
Thực tế : nFe : nCuSO4 = 0,1 : 0,15
Fe hết, CuSO4 dư. Chất rắn X là Cu
Từ (1) suy ra: nCu(1) = nCuSO4 = nFe = 0,1(mol)
m X = m Cu = 64.0,1 = 6,4 gam
4. ĐỀ SỐ 4
I. Trắc nghiệm
Câu 1. Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg?
A. ZnCl2, Fe(NO3)2 và CuSO4
B. CaCl2, NaCl và Cu(NO3)2
C. CaCl2, NaNO3 và FeCl3
D. Ca(NO3)2, FeCl2 và CuSO4
Câu 2. Để phân biệt được các dung dịch HCl, H2SO4 và Ba(OH)2 chỉ cần dùng kim loại nào sau đây?
A. K
B. Na
C. Ba
D. Cu
Câu 3. Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn
B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag
D. Ag, Fe, Zn, K
Câu 4. Nhỏ từ từ dung dịch axit clohiđric vào cốc đựng một mẩu đá vôi cho đến dư axit. Hiện tượng nào sau đây xảy ra?
A. Sủi bọt khí, đá vôi không tan
B. Đá vôi tan dần, không sủi bọt khí.
C. Không sủi bọt khí, đá vôi không tan
D. Sủi bọt khí, đá vôi tan dần.
Câu 5. Cặp chất nào dưới đây không thể tồn tại trong cùng một dung dịch.
A. NaNO3 và HCl
B. NaNO3 và BaCl2
C. K2SO4 và BaCl2
D. BaCO3 và NaCl
II Tự luận
Câu 1. Hoàn thành sơ đồ phản ứng hóa học sau:
S → SO2 → SO3 → H2SO4 → SO2 → H2SO3 → Na2SO3 → SO2
Câu 2. Có 3 lọ mất nhãn chứa 3 dung dịch HCl, H2SO4, BaCl2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Câu 3. Cho 2,56 gam Cu vào cốc đựng 40 ml dung dịch AgNO3 1 M. Sau phản khi phản ứng xảy ra hoàn toàn thu được dung dịch X và m gam chất rắn Y.
a) Xác định các chất trong dung dịch X và chất rắn Y.
b) Tính nồng độ mol chất tan trong X và giá trị của m. Giả sử thể tích dung dịch thay đổi không đáng kể.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 04, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
I. Trắc nghiệm
|
1A |
2C |
3D |
4D |
|
5C |
6A |
7D |
8C |
Câu 1
(1) S + O2 \(\mathop \to \limits^{{t^o}} \) SO2
(2) SO2 + O2 \(\mathop \to \limits^{{t^o}} \) SO3
(3) SO3 + H2O → H2SO4
(4) H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
(5) SO2 + H2O→ H2SO3
(6) H2SO3 + 2NaOH → Na2SO3 + 2H2O
(7) H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
Câu 2. Trích mẫu thử và đánh số thứ tự.
- Bước 1: Nhúng quỳ tím vào 3 dung dịch trên.
+ Dung dịch không làm đổi màu quỳ là BaCl2
+ Dùng dịch làm quỳ chuyển sang đỏ là: HCl, H2SO4
- Bước 2: Nhỏ dung dịch BaCl2 vừa nhận biết được ở trên vào 2 dung dịch axit
+ Dung dịch không xảy ra phản ứng là HCl
+ Dung dịch phản ứng tạo kết tủa trắng là H2SO4 loãng
BaCl2 +H2SO4 → BaSO4 ↓+ 2HCl
5. ĐỀ SỐ 5
I. Trắc nghiệm
Câu 1. Dẫn hỗn hợp khí gồm CO2, CO, SO2 lội qua dung dịch nước vôi trong (dư), khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Câu 2. Phản ứng giữa hai chất nào dưới đây không tạo thành khí lưu huỳnh đioxit?
A. Na2SO3 và HCl
B. Na2SO3 và Ca(OH)2
C. S và O2 (đốt S)
D. FeS2 và O2 (đốt quặng pirit sắt)
Câu 3. Dãy các chất đều phản ứng được với dung dịch FeCl2 là:
A. NaCl, Zn, AgNO3, KOH
B. Al2O3, Mg, NaOH, Na2CO3
C. HCl, BaO, Al, CuSO4
D. AgNO3, KOH, Al, H3PO4
Câu 3. Diêm tiêu có nhiều ứng dụng quan trọng như: chế tạo thuốc nổ đen, làm phân bón, cung cấp nguyên tố nito và kali cho cây trồng,... Công thức hóa học của diêm tiêu là
A. KCl
B. K2CO3
C. KClO3
D. KNO3
Câu 4. Dãy kim loại nào sau đây được sắp xếp các kim loại theo thứ tự mức hoạt động hóa học giảm dần
A. K, Al, Mg, Cu, Fe
B. Na, K, Al, Zn, Ag
C. K, Mg, Fe, Cu, Au
D. Na, Cu, Al, Fe, Zn
Câu 5. Dung dịch AlCl3 bị lẫn dung dịch FeCl2. Dùng kim loại nào dưới đây để loại bỏ lương FeCl2 ra khỏi dung dịch AlCl3 là tốt nhất?
A. Fe
B. Cu
C. Al
D. Zn
II Tự luận
Câu 1. Viết các phương trình hoàn thành dãy chuyển hóa sau:
FeS2 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → Fe2O3
Câu 2
a) Trình bày phương pháp hóa học nhận biết 3 chất rắn dạng bột, riêng biệt sau: Fe, Ag, Al
b) Nêu hiện tượng xảy ra khi cho 1 mẩu Na vào dung dịch CuSO4. Viết phương trình hóa học xảy ra
Câu 3 Hòa tan hoàn toàn 7,04 gam hỗn hợp K và Ba vào nước thu được 400 ml dung dịch X và 1,344 lít khí H2 (đktc)
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 05, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 5
I. Trắc nghiệm
|
1A |
2B |
3D |
4C |
5C |
6A |
|
7B |
8A |
9C |
10A |
11D |
12A |
II Tự luận
Câu 1.
4FeS2 + 11O2 \(\mathop \to \limits^{{t^o}} \) 2Fe2O3 + 8SO2
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
2Fe(OH)3 \(\mathop \to \limits^{{t^o}} \) Fe2O3 + 3H2O
Câu 2
Cho 3 chất bột trên tác dụng với dung dịch NaOH, chất nào xảy ra phản ứng, có khí thoát ra là Al, Fe và Ag không phản ứng với dung dịch NaOH.
2Al + NaOH + 2H2O → 2NaAlO2 + 3H2
Cho 2 kim loại còn lại tác dụng với dung dịch HCl, chất nào xảy ra phản ứng, có khí thoát ra là Fe, Ag không tác dụng với dung dịch HCl
Fe + 2HCl → FeCl2 + H2
b) Khi cho mẩu Na vào dung dịch CuSO4, Na sẽ phản ứng với H2O trong dung dịch tạo thành NaOH và có khí H2 thoát ra.
2Na + H2O → 2NaOH + H2
Sau đó, NaOH tạo thành với dung dịch CuSO4, tạo thành Cu(OH)2 kết tủa màu xanh lơ.
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Trên đây là một phần trích đoạn nội dung Bộ 5 đề thi HK1 môn Hóa học 9 có đáp án năm 2022-2023 Trường THCS Lê Quý Đôn. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Bộ 5 đề thi HK1 môn Hóa học 9 có đáp án năm 2022-2023 Trường THCS Lý Thường Kiệt
- Bộ 5 đề thi HK1 môn Hóa học 9 có đáp án năm 2022-2023 Trường THCS Nguyễn Khuyến
Hy vọng bộ đề thi này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong kì thi sắp tới.