HŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c ChŲ░ŲĪng 2 B├Āi 6 Giß╗øi thiß╗ću vß╗ü li├¬n kß║┐t h├│a hß╗Źc sß║Į gi├║p c├Īc em hß╗Źc sinh nß║»m vß╗»ng phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp v├Ā ├┤n luyß╗ćn tß╗æt kiß║┐n thß╗®c.
-
Giß║Żi c├óu hß╗Åi trang 36 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Quan s├Īt H├¼nh 6.1, so s├Īnh sß╗æ electron lß╗øp ngo├Āi c├╣ng cß╗¦a He, Ne v├Ā Ar
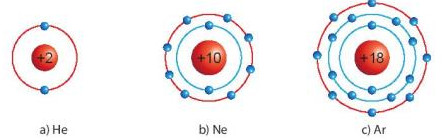
H├¼nh 6.1. M├┤ h├¼nh sß║»p xß║┐p electron trong vß╗Å nguy├¬n tß╗Ł kh├Ł hiß║┐m
-
Giß║Żi c├óu hß╗Åi 1 trang 37 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Quan s├Īt H├¼nh 6.2 v├Ā so s├Īnh sß╗æ electron ß╗¤ lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł Na, Cl vß╗øi ion Na+, Cl-.
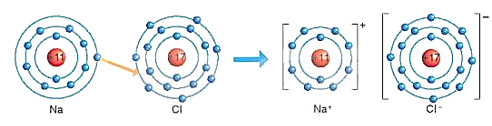
H├¼nh 6.2. SŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t ion trong ph├ón tß╗Ł NaCl
-
Giß║Żi c├óu hß╗Åi 2 trang 37 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Cho sŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t ion trong ph├ón tß╗Ł magnesium oxide nhŲ░ sau:
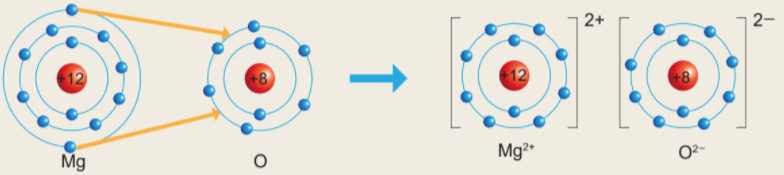
H├¼nh 6.3. SŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t ion trong ph├ón tß╗Ł MgO
H├Ży cho biß║┐t nguy├¬n tß╗Ł Mg ─æ├Ż nhŲ░ß╗Øng hay nhß║Łn bao nhi├¬u electron
-
Giß║Żi c├óu hß╗Åi 1 trang 38 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Quan s├Īt H├¼nh 6.4 v├Ā H├¼nh 6.5, cho biß║┐t sß╗æ electron lß╗øp ngo├Āi c├╣ng cß╗¦a H v├Ā O trŲ░ß╗øc v├Ā sau khi tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ
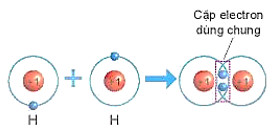
H├¼nh 6.4. SŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ph├ón tß╗Ł hydrogen
-
Giß║Żi c├óu hß╗Åi 2 trang 38 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
H├Ży m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong ph├ón tß╗Ł kh├Ł chlorine, kh├Ł nitrogen
-
Giß║Żi c├óu hß╗Åi 1 trang 39 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Quan s├Īt H├¼nh 6.6 v├Ā cho biß║┐t khi nguy├¬n tß╗Ł O li├¬n kß║┐t vß╗øi hai nguy├¬n tß╗Ł H theo c├Īch d├╣ng chung electron th├¼ lß╗øp vß╗Å cß╗¦a nguy├¬n tß╗Ł oxygen giß╗æng lß╗øp vß╗Å cß╗¦a nguy├¬n tß╗Ł kh├Ł hiß║┐m n├Āo?
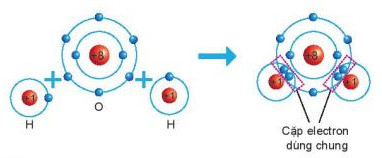
H├¼nh 6.6. SŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ph├ón tß╗Ł nŲ░ß╗øc
-
Giß║Żi c├óu hß╗Åi 2 trang 39 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
H├Ży m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong ph├ón tß╗Ł carbon dioxide, ammonia.
-
Giß║Żi b├Āi 6.1 trang 23 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
a) ─Éiß╗ün c├Īc th├┤ng tin c├▓n thiß║┐u ─æß╗ā ho├Ān th├Ānh bß║Żng sau vß╗ü c├Īc kim loß║Īi.

b) H├Ży nhß║Łn x├®t vß╗ü sß╗æ thß╗® tß╗▒ cß╗¦a nh├│m trong bß║Żng tuß║¦n ho├Ān v├Ā ─æiß╗ćn t├Łch cß╗¦a c├Īc ion kim loß║Īi tß║Īo th├Ānh.
-
Giß║Żi b├Āi 6.2 trang 23 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
a) ─Éiß╗ün c├Īc th├┤ng tin c├▓n thiß║┐u ─æß╗ā ho├Ān th├Ānh bß║Żng sau vß╗ü c├Īc phi kim.

b) H├Ży nhß║Łn x├®t vß╗ü mß╗æi quan hß╗ć giß╗»a sß╗æ thß╗® tß╗▒ cß╗¦a nh├│m trong bß║Żng tuß║¦n ho├Ān v├Ā ─æiß╗ćn t├Łch cß╗¦a c├Īc ion phi kim tß║Īo th├Ānh.
-
Giß║Żi b├Āi 6.3 trang 23 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
a) Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ l├Ā g├¼?
b) Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ kh├Īc vß╗øi li├¬n kß║┐t ion nhŲ░ thß║┐ n├Āo?
c) Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ v├Ā li├¬n kß║┐t ion c├│ ─æiß╗ām g├¼ tŲ░ŲĪng tß╗▒ nhau?
-
Giß║Żi b├Āi 6.4 trang 23 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Ph├ón tß╗Ł methane gß╗ōm mß╗Öt nguy├¬n tß╗Ł carbon li├¬n kß║┐t vß╗øi bß╗æn nguy├¬n tß╗Ł hydrogen. Khi h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong methane, nguy├¬n tß╗Ł carbon g├│p chung bao nhi├¬u electron vß╗øi mß╗Śi nguy├¬n tß╗Ł hydrogen?
A. Nguy├¬n tß╗Ł carbon g├│p chung 1 electron vß╗øi mß╗Śi nguy├¬n tß╗Ł hydrogen.
B. Nguy├¬n tß╗Ł carbon g├│p chung 2 electron vß╗øi mß╗Śi nguy├¬n tß╗Ł hydrogen.
C. Nguy├¬n tß╗Ł carbon g├│p chung 3 electron vß╗øi mß╗Śi nguy├¬n tß╗Ł hydrogen.
D. Nguy├¬n tß╗Ł carbon g├│p chung 4 electron vß╗øi mß╗Śi nguy├¬n tß╗Ł hydrogen.
-
Giß║Żi b├Āi 6.5 trang 24 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Li├¬n kß║┐t giß╗»a c├Īc nguy├¬n tß╗Ł trong ph├ón tß╗Ł nŲ░ß╗øc l├Ā li├¬n kß║┐t
A. cß╗Öng h├│a trß╗ŗ.
B. ion.
C. kim loß║Īi.
D. phi kim.
-
Giß║Żi b├Āi 6.6 trang 24 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Li├¬n kß║┐t h├│a hß╗Źc giß╗»a c├Īc nguy├¬n tß╗Ł oxygen v├Ā hydrogen trong ph├ón tß╗Ł nŲ░ß╗øc ─æŲ░ß╗Żc h├¼nh th├Ānh bß║▒ng c├Īch
A. nguy├¬n tß╗Ł oxygen nhß║Łn electron, nguy├¬n tß╗Ł hydrogen nhŲ░ß╗Øng electron.
B. nguy├¬n tß╗Ł oxygen nhŲ░ß╗Øng electron, nguy├¬n tß╗Ł hydrogen nhß║Łn electron.
C. nguy├¬n tß╗Ł oxygen v├Ā nguy├¬n tß╗Ł hydrogen g├│p chung electron.
D. nguy├¬n tß╗Ł oxygen v├Ā nguy├¬n tß╗Ł hydrogen g├│p chung proton.
-
Giß║Żi b├Āi 6.7 trang 24 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Trong ph├ón tß╗Ł oxygen (O2), khi hai nguy├¬n tß╗Ł oxygen li├¬n kß║┐t vß╗øi nhau, ch├║ng
A. g├│p chung proton.
B. chuyß╗ān electron tß╗½ nguy├¬n tß╗Ł n├Āy sang nguy├¬n tß╗Ł kia.
C. chuyß╗ān proton tß╗½ nguy├¬n tß╗Ł n├Āy sang nguy├¬n tß╗Ł kia.
D. g├│p chung electron.
-
Giß║Żi b├Āi 6.8 trang 24 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
Trong ph├ón tß╗Ł KCl, nguy├¬n tß╗Ł K (potassium) v├Ā nguy├¬n tß╗Ł Cl (chlorine) li├¬n kß║┐t vß╗øi nhau bß║▒ng li├¬n kß║┐t
A. cß╗Öng h├│a trß╗ŗ.
B. ion.
C. kim loß║Īi.
D. phi kim.
-
Giß║Żi b├Āi 6.9 trang 24 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
H├Ży vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t ion trong c├Īc ph├ón tß╗Ł sau, sß╗Ł dß╗źng c├Īc dß║źu chß║źm ─æß╗ā biß╗āu diß╗ģn c├Īc electron (tŲ░ŲĪng tß╗▒ h├¼nh 6.2 trang 37 SGK):
a) Lithium fluoride (LiF).
b) Calcium oxide (CaO).
c) Potassium oxide (K2O).
-
Giß║Żi b├Āi 6.10 trang 25 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
─Éiß╗ün c├Īc sß╗æ th├Łch hß╗Żp v├Āo c├Īc ├┤ c├▓n trß╗æng ─æß╗ā ho├Ān th├Ānh bß║Żng sau:

-
Giß║Żi b├Āi 6.11 trang 25 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
H├Ży vß║Į sŲĪ ─æß╗ō biß╗āu diß╗ģn sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong c├Īc ph├ón tß╗Ł sau, sß╗Ł dß╗źng c├Īc dß║źu chß║źm ─æß╗ā biß╗āu diß╗ģn c├Īc electron (tŲ░ŲĪng tß╗▒ nhŲ░ h├¼nh 6.5 trang 38 SGK):
a) Chlorine (Cl2).
b) Hydrogen sulfide (H2S).
c) Carbon dioxide (CO2).
-
Giß║Żi b├Āi 6.12 trang 25 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
H├Ży giß║Żi th├Łch c├Īc c├óu sau dß╗▒a tr├¬n t├Łnh chß║źt cß╗¦a li├¬n kß║┐t (ion hay cß╗Öng ho├Ī trß╗ŗ) giß╗»a c├Īc nguy├¬n tß╗Ł trong ph├ón tß╗Ł c├Īc chß║źt.
a) V├¼ sao ammonia l├Ā chß║źt kh├Ł ß╗¤ nhiß╗ćt ─æß╗Ö ph├▓ng.
b) V├¼ sao nhiß╗ćt ─æß╗Ö n├│ng chß║Ży cß╗¦a sodium chloride v├Ā iodine rß║źt kh├Īc nhau? Nhiß╗ćt ─æß╗Ö n├│ng chß║Ży cß╗¦a chß║źt n├Āo cao hŲĪn?
-
Giß║Żi b├Āi 6.13 trang 25 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Kß║┐t nß╗æi tri thß╗®c - KNTT
─ÉŲĪn chß║źt magnesium v├Ā ─æŲĪn chß║źt chlorine phß║Żn ß╗®ng vß╗øi nhau tß║Īo th├Ānh hß╗Żp chß║źt magnesium chloride, l├Ā hß╗Żp chß║źt c├│ cß║źu tr├║c tinh thß╗ā.
a) Vß║Į sŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t ion trong hß╗Żp chß║źt MgCl tß╗½ c├Īc nguy├¬n tß╗Ł Mg v├Ā Cl (xem h├¼nh 6.2, trang 37 SGK). Cho biß║┐t sß╗æ proton trong hß║Īt nh├ón cß╗¦a Mg l├Ā 12 v├Ā cß╗¦a Cl l├Ā 17.
b) Lß║Łp bß║Żng m├┤ tß║Ż mß╗Öt sß╗æ t├Łnh chß║źt cß╗¦a ─æŲĪn chß║źt magnesium, ─æŲĪn chß║źt chlorine v├Ā hß╗Żp chß║źt magnesium chloride. C├Īc t├Łnh chß║źt bao gß╗ōm:
(i) thß╗ā cß╗¦a chß║źt ß╗¤ nhiß╗ćt ─æß╗Ö ph├▓ng (25 ┬░C).
(ii) t├Łnh tan trong nŲ░ß╗øc (hoß║Ęc phß║Żn ß╗®ng vß╗øi nŲ░ß╗øc).
(iii) m├Āu sß║»c.
(iv) t├Łnh dß║½n ─æiß╗ćn.






