Hướng dẫn Giải bài tập Hóa học 11 CTST Bài 3 Đơn chất nitrogen môn Hóa học lớp 11 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Mở đầu trang 20 SGK Hóa học 11 Chân trời sáng tạo – CTST
Nitrogen là khí có hàm lượng lớn nhất trong không khí, có vai trò cung cấp đạm tự nhiên cho cây trồng. Nitrogen có tính chất gì và có những ứng dụng nào trong cuộc sống?

-
Thảo luận 1 trang 20 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 3.1, cho biết trong không khí, khí nào chiếm tỉ lệ thể tích lớn nhất.
-
Thảo luận 2 trang 20 SGK Hóa học 11 Chân trời sáng tạo – CTST
Ngoài đơn chất nitrogen thì nguyên tố nitrogen còn tồn tại dưới dạng nào? Lấy ví dụ.
-
Thảo luận 3 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 3.2, nêu hiện tượng xảy ra. Giải thích.
-
Thảo luận 4 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Nitrogen nặng hơn hay nhẹ hơn không khí? Tại sao?
-
Hoạt động trang 21 SGK Hoá học 11 Chân trời sáng tạo – CTST
Người ta có thể thu khí nitrogen trong phòng thí nghiệm bằng phương pháp đẩy nước. Hãy giải thích điều này.
-
Thảo luận 5 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 3.3 và từ dữ kiện năng lượng liên kết trong phân tử N2, dự đoán về độ bền phân tử và khả năng phản ứng của nitrogen ở nhiệt độ thường.

-
Thảo luận 6 trang 21 SGK Hóa học 11 Chân trời sáng tạo – CTST
Xác định tính oxi hoá, tính khử của nitrogen trong phản ứng của N2 với H2 và O2. Cho biết các phản ứng này thu nhiệt hay toả nhiệt.
-
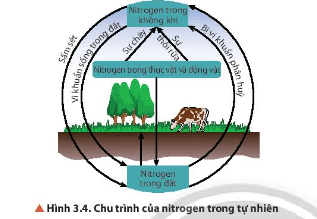
Thảo luận 7 trang 22 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 3.4, cho biết con người có thể can thiệp vào chu trình của nitrogen trong tự nhiên bằng cách nào. Nếu sự can thiệp đó vượt ngưỡng cho phép thì ảnh hưởng gì đến môi trường?
-
Thảo luận 8 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Quan sát Hình 3.5 và dựa vào các tính chất của nitrogen, hãy giải thích vì sao nitrogen có những ứng dụng đó.

.png)
-
Vận dụng trang 23 SGK Hoá học 11 Chân trời sáng tạo – CTST
Giải thích vì sao người ta bơm khí nitrogen vào những lọ vaccine.
-
Giải Bài 1 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Trình bày cấu tạo của phân tử N2. Giải thích vì sao ở điều kiện thường, N2 khá trơ về mặt hoá học.
-
Giải Bài 2 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Viết phương trình hoá học chứng minh tính oxi hoá và tính khử của nitrogen. Cho biết số oxi hoá của nitrogen thay đổi như thế nào trong các phản ứng hoá học đó.
-
Giải Bài 3 trang 23 SGK Hóa học 11 Chân trời sáng tạo – CTST
Dựa vào giá trị năng lượng liên kết (Eb), hãy dự đoán ở điều kiện thường, chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hoá học nhất. Vì sao?
a) N2 (g) → 2N (g) Eb = 945 kJ/mol.
b) H2 (g) → 2H (g) Eb = 432 kJ/mol.
c) O2 (g) → 2O (g) Eb = 498 kJ/mol.
d) Cl2 (g) → 2Cl (g) Eb = 243 kJ/mol.








