Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 17 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA môn Hóa học lớp 10 CTST giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 106 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 17.1, cho biết vị trí nhóm halogen trong bảng tuần hoàn
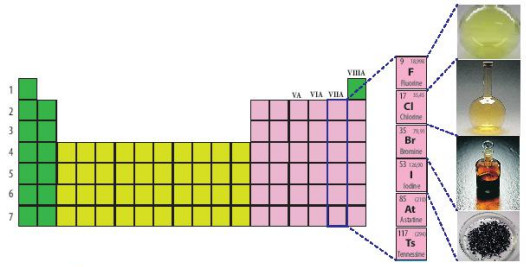
Hình 17.1. Vị trí nhóm halogen trong bảng tuần hoàn
-
Giải câu hỏi 2 trang 106 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hãy kể tên một số chất chứa nguyên tố halogen
-
Giải câu hỏi 3 trang 106 SGK Hóa học 10 Chân trời sáng tạo - CTST
Từ các thông tin và quan sát Hình 17.2, nhận xét dạng tồn tại của các nguyên tố halogen trong tự nhiên
.jpg)
(a) Fluorite (b) Sylvite (c) Cryolite
Hình 17.2. Một số khoáng chất chứa ion halide
-
Luyện tập trang 107 SGK Hóa học 10 Chân trời sáng tạo - CTST
Khoảng 71% bề mặt Trái Đất được bao phủ bởi biển và đại dương, phần còn lại là các lục địa và đảo. Theo em, hàm lượng nguyên tố halogen nào nhiều nhất trong tự nhiên?
-
Giải câu hỏi 4 trang 107 SGK Hóa học 10 Chân trời sáng tạo - CTST
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen.
-
Giải câu hỏi 5 trang 107 SGK Hóa học 10 Chân trời sáng tạo - CTST
Từ đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, nhận xét xu hướng hình thành liên kết trong phân tử halogen.
-
Giải câu hỏi 6 trang 108 SGK Hóa học 10 Chân trời sáng tạo - CTST
Dựa vào Bảng 17.1, nhận xét sự biến đổi về màu sắc, thể các chất ở điều kiện thường, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen
Bảng 17.1. Một số đặc điểm của các nguyên tố nhóm Halogen

-
Giải câu hỏi 7 trang 108 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải thích sự biến đổi nhiệt độ nóng chảy, nhiệt độ sôi từ fluorine đến iodine.
-
Luyện tập trang 108 SGK Hóa học 10 Chân trời sáng tạo - CTST
Ở điều kiện thường, hãy dự đoán astatine tồn tại ở thể khí, thể lỏng hay thể rắn. Giải thích
-
Giải câu hỏi 8 trang 109 SGK Hóa học 10 Chân trời sáng tạo - CTST
Từ cấu tạo phân tử halogen và đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, nhận xét xu hướng hình thành liên kết của nguyên tử halogen trong các phản ứng hóa học
-
Giải câu hỏi 9 trang 109 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trong phản ứng với kim loại, nhận xét sự biến đổi số oxi hóa của nguyên tử các nguyên tố halogen và viết các quá trình khử xảy ra.
-
Giải câu hỏi 10 trang 110 SGK Hóa học 10 Chân trời sáng tạo - CTST
Dựa vào điều kiện phản ứng với hydrogen và giá trị năng lượng liên kết của phân tử H – X, giải thích khả năng phản ứng của các halogen với hydrogen
-
Giải câu hỏi 11 trang 110 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trong phản ứng với dung dịch kiềm, nhận xét sự biến đổi số oxi hóa của chlorine và cho biết phản ứng này thuộc loại phản ứng gì?
-
Giải câu hỏi 12 trang 111 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tiến hành thí nghiệm 1, quan sát và ghi nhận hiện tượng
-
Giải câu hỏi 13 trang 111 SGK Hóa học 10 Chân trời sáng tạo - CTST
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 1
-
Giải câu hỏi 14 trang 111 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tiến hành thí nghiệm 2, quan sát và ghi nhận hiện tượng.

-
Giải câu hỏi 15 trang 112 SGK Hóa học 10 Chân trời sáng tạo - CTST
Dựa vào phương trình hóa học của các phản ứng, giải thích kết quả thí nghiệm 2.
-
Luyện tập trang 112 SGK Hóa học 10 Chân trời sáng tạo - CTST
Viết phương trình hóa học của các phản ứng sau:
Cu + Cl2 → (1)
Al + Br2 → (2)
Ca(OH)2 + Cl2 → (3)
KOH + Br2 \(\xrightarrow{{ > {{70}^o}C}}\) (4)
Cl2 + KBr → (5)
Br2 + NaI → (6)
-
Vận dụng trang 112 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tính tẩy màu của khí chlorine ẩm được ứng dụng vào lĩnh vực nào trong đời sống?
-
Giải câu hỏi 16 trang 113 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nhận xét vai trò của halogen trong đời sống, sản xuất và y tế.
-
Giải câu hỏi 17 trang 113 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tìm hiểu thêm những ứng dụng khác của halogen trong thực tế?
-
Vận dụng trang 113 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tại sao có thể sử dụng nước Javel để tẩy những vết mực trên áo trắng, nhưng lại không nên sử dụng trên vải quần, áo có màu?
-
Giải bài 1 trang 113 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hoàn thành các phương trình minh họa tính chất hóa học của các nguyên tố halogen
a) Cl2 + H2 →
b) F2 + Cu →
c) I2 + Na →
d) Cl2 + Fe →
e) Br2 + Ca(OH)2 →
f) Cl2 + KOH \(\xrightarrow{{{{100}^o}C}}\)
g) Br2 + KI →
-
Giải bài 2 trang 113 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải thích vì sao các nguyên tố halogen không tồn tại ở dạng đơn chất trong tự nhiên.
-
Giải bài 3 trang 113 SGK Hóa học 10 Chân trời sáng tạo - CTST
Chlorine B (C6H5ClNNaO2S) là chất thường được sử dụng để sát khuẩn trên các bề mặt, vật dụng hoặc dùng để khử trùng, sát khuẩn, xử lí nước sinh hoạt. Ở nồng độ cao, chloramine B có tác dụng diệt nấm mốc, vi khuẩn, virus gây bệnh cho người. Chloramine B có dạng viên nén (mỗi viên có khối lượng 0,3 – 2,0 gam) và dạng bột. Chloramine B 25% (250 mg chlorine hoạt tính trong một viên nén như hình bên) được dùng phổ biến, vì tiện dụng khi pha chế và bảo quản
.jpg)
a) Nồng độ chloramine B khi hòa tan vào nước đạt 0,001% có tác d ụng sát khuẩn dùng trong xử lí nước sinh hoạt. Cần dùng bao nhiêu viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước?
b) Chloramine B nồng độ 2% dùng để xịt trên các bề mặt vật dụng nhằm sát khuẩn, virus gây bệnh. Để pha chế dung dịch này, sử dụng chloramine B 25% dạng bột, vậy cần bao nhiêu gam bột chloramine B 25% pha với 1 lít nước để được dung dịch sát khuẩn 2%
-
Giải bài 17.1 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong bảng tuần hoàn các nguyên tố hoá học, halogen thuộc nhóm
A. IA.
B. IIA.
C. VIIA.
D. VIIIA.
-
Giải bài 17.2 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Halogen tồn tại thể lỏng ở điều kiện thường là
A. fluorine.
B. bromine.
C. iodine.
D. chlorine.
-
Giải bài 17.3 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Đơn chất halogen ở thể khí, màu vàng lục là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
-
Giải bài 17.4 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tố có tính oxi hoá yếu nhất thuộc nhóm VIIA là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
-
Giải bài 17.5 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cấu hình electron nguyên tử thuộc nguyên tố halogen là
A. ns2np2.
B. ns2np3.
C. ns2np5.
D. ns2np6.
-
Giải bài 17.6 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Ứng dụng nào sau đây không phải của Cl2?
A. Xử lí nước bể bơi.
B. Sát trùng vết thương trong y tế.
C. Sản xuất nhựa PVC.
D. Sản xuất bột tẩy trắng.
-
Giải bài 17.7 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Halogen nào được dùng trong sản xuất nhựa Teflon?
A. Chlorine.
B. Iodine.
C. Fluorine.
D. Bromine.
-
Giải bài 17.8 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tố halogen được dùng trong sản xuất nhựa PVC là
A. chlorine.
B. bromine.
C. phosphorus.
D. carbon.
-
Giải bài 17.9 trang 75 SBT Hóa học 10 Chân trời sáng tạo - CTST
Halogen được điều chế bằng cách điện phân có màng ngăn dung dịch muối ăn là
A. fluorine.
B. chlorine.
C. bromine.
D. iodine.
-
Giải bài 17.10 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
-
Giải bài 17.11 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Halogen nào tạo liên kết ion bền nhất với sodium?
A. Chlorine.
B. Bromine.
C. Iodine.
D. Fluorine.
-
Giải bài 17.12 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Liên kết trong phân tử đơn chất halogen là
A. liên kết van der Waals.
B. liên kết cộng hoá trị.
C. liên kết ion.
D. liên kết cho nhận.
-
Giải bài 17.13 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Theo chiều từ F → Cl → Br → I, bán kính của nguyên tử
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. không có quy luật.
-
Giải bài 17.14 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Đặc điểm của halogen là
A. nguyên tử chỉ nhận thêm 1 electron trong các phản ứng hoá học.
B. tạo liên kết cộng hoá trị với nguyên tử hydrogen.
C. nguyên tử có số oxi hoá –1 trong tất cả hợp chất.
D. nguyên tử có 5 electron hoá trị.
-
Giải bài 17.15 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Phát biểu nào sau đây là không đúng?
A. Trong tự nhiên, không tồn tại đơn nhất halogen.
B. Tính oxi hoá của đơn chất halogen giảm dần từ F2 đến I2.
C. Khí chlorine ẩm và nước chlorine đều có tính tẩy màu.
D. Fluorine có tính oxi hoá mạnh hơn chlorine, oxi hoá Cl- trong dung dịch NaCl thành Cl2.
-
Giải bài 17.16 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giá trị độ âm điện của halogen và hydrogen trong bảng sau:
Nguyên tố
H
F
Cl
Br
I
Giá trị độ âm điện
2,20
3,98
3,16
2,96
2,66
Dựa vào giá trị độ âm điện, sắp xếp theo thứ tự giảm dần khả năng liên kết của halogen với hydrogen. So sánh độ phân cực của các phân tử hydrogen halide.
-
Giải bài 17.17 trang 76 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho phương trình hoá học của 2 phản ứng như sau:
Cl2 + 2NaBr → 2NaCl + Br2
Br2+ 2Nal → 2NaBr + I2
Phương trình chứng minh tính chất nào của halogen?
-
Giải bài 17.18 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hoàn thành phương trình hoá học của các phản ứng chứng minh tính chất halogen:
a) Br2 + K →
b) F2 + H2O →
c) Cl2 + Ca(OH)2 →
d) Cl2 + NaI →
Nhận xét vai trò của halogen trong các phản ứng trên.
-
Giải bài 17.19 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Muối NaCl có lẫn một ít NaI. Nhận biết sự có mặt của muối NaI có trong hỗn hợp.
-
Giải bài 17.20 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong hợp chất, số oxi hoá của halogen (trừ F) thường là −1, +1, +3, +5, +7. Tại sao các số oxi hoá chẵn không đặc trưng đối với halogen trong hợp chất?
-
Giải bài 17.21 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hoá −1, còn các nguyên tố chlorine, bromine, iodine là −1, +1, +3, +5, +7?
-
Giải bài 17.22 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tại sao đơn chất halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4)?
-
Giải bài 17.23 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tại sao chỉ có tên gọi nước chlorine, bromine, iodine nhưng không có nước fluorine?
-
Giải bài 17.24 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Một học sinh thực hiện thí nghiệm và cho kết quả như sau:
- Bước 1: Lấy 2 mL dung dịch NaBr vào ống nghiệm, dung dịch không màu.
- Bước 2: Lấy tiếp 1 mL hexane vào ống nghiệm, lắc mạnh để quan sát khả năng hoà tan của 2 chất lỏng. Nhận thấy 2 chất lỏng không tan vào nhau và phân tách lớp.
- Bước 3: Thêm 1 mL nước Cl2 vào ống nghiệm, lắc đều rồi để yên. Quan sát thấy lớp chất lỏng phía trên có màu da cam.
Viết phương trình hoá học của phản ứng. Thí nghiệm trên chứng minh tính chất vật lí và hoá học nào của halogen tương ứng?
-
Giải bài 17.25 trang 77 SBT Hóa học 10 Chân trời sáng tạo - CTST
Xác nhận đúng, sai cho các phát biểu trong bảng sau:
Xác nhận
STT
Phát biểu
Đúng
Sai
1
Halogen vừa có tính oxi hoá, vừa có tính khử
2
Nước chlorine và Javel đều có tính tẩy màu
3
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên
4
Cl2 có tính oxi hoá mạnh hơn Br2
5
Cl2 khử được I- trong dung dịch NaI thành I2
6
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen
7
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon
-
Giải bài 17.26 trang 78 SBT Hóa học 10 Chân trời sáng tạo - CTST
Các hợp chất hypochlorite hay Chlorine (NaClO, Ca(ClO)2) là các hoá chất có tính oxi hoá rất mạnh, có khả năng sát trùng, sát khuẩn, làm sạch nguồn nước (Chlonine được nhắc đến là tên thương mại, không phải đơn chất Cl2). Chlorine ở nồng độ xác định có khả năng tiêu diệt một số mầm bệnh như:
Mầm bệnh
Thời gian tiêu diệt
E. coli O157: H7 (gây tiêu chảy ra máu, suy thận)
<1 phút
Hepatilis A virus (gây bệnh viêm gan siêu vi A)
16 phút
Kí sinh trùng Giardia (gây tiêu chảy, đau bụng và sụt cân)
45 phút
Chlorine cần dùng là tổng lượng chlorine cần thiết để tiêu diệt mầm bệnh và oxi hoá các chất khử trong nước như iron, manganese, hydrogen sulfide và lượng chlorine tự do còn lại sau khoảng thời gian nhất định. Một nhà máy xử lí nước muốn làm sạch 1 lít nước thì lượng chlorine cần dùng trong 1 ngày là 11 mg để duy trì lượng chlorine tự do từ 0,1 đến 0,2 mg/L tại vòi sử dụng. Một ngày, nhà máy phải cung cấp 3000 m3 nước xử lí, thì lượng chlorine cần dùng là bao nhiêu?
-
Giải bài 17.27 trang 78 SBT Hóa học 10 Chân trời sáng tạo - CTST
Việt Nam là nước xuất khẩu thuỷ sản thứ 3 trên thế giới, sau Na Uy và Trung Quốc (Theo Bộ Nông nghiệp và Phát triển nông thôn Việt Nam, tháng 12/2021), xuất khẩu tới hơn 170 nước trên thế giới, trong đó có thị trường lớn như Mỹ và Châu Âu, được xem là thị trường khó tính, nên tiêu chuẩn chất lượng được kiểm soát chặt chẽ trước khi nhập nguyên liệu và sau khi thành phẩm, đóng gói. Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Cl2 + 2KI → 2KCl + I2.
I2 được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu.
Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01 M, thể tích Na2S2O3 dùng hết 0,28 mL (dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại microburet 1 mL, vạch chia 0,01 mL). Mẫu sản phẩm trên đủ tiêu chuẩn về dư lượng chlorine cho phép để xuất khẩu không? Giải thích.






