Nß╗Öi dung b├Āi giß║Żng B├Āi 17: T├Łnh chß║źt vß║Łt l├Ł v├Ā h├│a hß╗Źc c├Īc ─æŲĪn chß║źt nh├│m VIIA chŲ░ŲĪng tr├¼nh SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn b├¬n dŲ░ß╗øi ─æ├óy sß║Į gi├║p c├Īc em hß╗Źc sinh ─æi t├¼m hiß╗āu vß╗ü Vß╗ŗ tr├Ł nh├│m halogen trong bß║Żng tuß║¦n ho├Ān; Sß╗▒ biß║┐n ─æß╗Ģi mß╗Öt sß╗æ t├Łnh chß║źt vß║Łt l├Ł cß╗¦a c├Īc nguy├¬n tß╗æ trong nh├│m; Cß║źu h├¼nh lß╗øp electron ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ halogen tŲ░ŲĪng tß╗▒ nhau. T├Łnh chß║źt ho├Ī hß╗Źc cŲĪ bß║Żn cß╗¦a c├Īc nguy├¬n tß╗æ halogen l├Ā t├Łnh oxi ho├Ī mß║Īnh; Sß╗▒ biß║┐n ─æß╗Ģi t├Łnh chß║źt h├│a hß╗Źc cß╗¦a c├Īc ─æŲĪn chß║źt trong nh├│m halogen.
T├│m tß║»t l├Į thuyß║┐t
1.1. Vß╗ŗ tr├Ł cß╗¦a nh├│m Halogen trong bß║Żng tuß║¦n ho├Ān
* X├Īc ─æß╗ŗnh vß╗ŗ tr├Ł cß╗¦a nh├│m halogen trong bß║Żng tuß║¦n ho├Ān
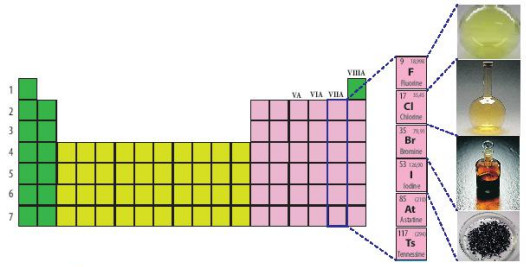
H├¼nh 17.1. Vß╗ŗ tr├Ł nh├│m halogen trong bß║Żng tuß║¦n ho├Ān
- Nh├│m halogen gß╗ōm nhß╗»ng nguy├¬n tß╗æ thuß╗Öc nh├│m VIIA trong bß║Żng tuß║¦n ho├Ān c├Īc nguy├¬n tß╗æ ho├Ī hß╗Źc: fluorine (F), chlorine (CI), bromine (Br), iodine (I), astatine (At) v├Ā tennessine (Ts).
- Astatine l├Ā nguy├¬n tß╗æ ph├│ng xß║Ī, ─æŲ░ß╗Żc tß║Īo ra bß║▒ng c├Īch bß║»n phß║Ż ─æß╗ōng vß╗ŗ 209Bi bß╗¤i c├Īc hß║Īt a trong m├Īy gia tß╗æc hß║Īt (cyclotron), tß║Īo ra hai neutron v├Ā ─æß╗ōng vß╗ŗ 211At. Astatine trong tß╗▒ nhi├¬n ─æŲ░ß╗Żc t├¼m thß║źy dŲ░ß╗øi dß║Īng trung gian cß╗¦a chuß╗Śi ph├ón r├Ż ph├│ng xß║Ī uranium v├Ā thorium. N─ām 2020, c├Īc nh├Ā khoa hß╗Źc ─æ├Ż nghi├¬n cß╗®u v├Ā ─æŲ░a v├Āo ß╗®ng dß╗źng 211At trong ─æiß╗üu trß╗ŗ ung thŲ░, ─æß╗ōng thß╗Øi ph├Īt triß╗ān dŲ░ß╗Żc phß║®m ph├│ng xß║Ī sß╗Ł dß╗źng ─æß╗ōng vß╗ŗ n├Āy.
- Tennessine (117Ts) c┼®ng l├Ā nguy├¬n tß╗æ ph├│ng xß║Ī, ─æŲ░ß╗Żc ph├Īt hiß╗ćn n─ām 2010 v├Ā IUPAC ph├¬ duyß╗ćt t├¬n tennessine cho nguy├¬n tß╗æ thß╗Ł 117 v├Āo n─ām 2016. V├¼ chß╗ē c├│ v├Āi nguy├¬n tß╗Ł ─æŲ░ß╗Żc tß║Īo ra n├¬n T5 chŲ░a c├│ ß╗®ng dß╗źng thß╗▒c tß║┐ ngo├Āi mß╗źc ─æ├Łch nghi├¬n cß╗®u.
1.2. ß╗× trß║Īng th├Īi tß╗▒ nhi├¬n cß╗¦a c├Īc Halogen
- T├¼m hiß╗āu trß║Īng th├Īi tß╗▒ nhi├¬n cß╗¦a c├Īc halogen Halogen trong tß╗▒ nhi├¬n kh├┤ng tß╗ōn tß║Īi ß╗¤ dß║Īng ─æŲĪn chß║źt, chß╗¦ yß║┐u tß╗ōn tß║Īi dŲ░ß╗øi dß║Īng muß╗æi cß╗¦a c├Īc ion halide (F-,Cl-, Br-, I-).
- Ion fluoride ─æŲ░ß╗Żc t├¼m thß║źy trong c├Īc kho├Īng chß║źt nhŲ░ fluorite (CaF2); fluorapatite (Ca5(PO4)3F) v├Ā cryolite (Na3AlF6). Ion chloride c├│ nhiß╗üu trong nŲ░ß╗øc biß╗ān, trong quß║Ęng kalite (NaCl, thŲ░ß╗Øng gß╗Źi l├Ā muß╗æi mß╗Å), sylvite (KCl). Ion bromide c├│ trong quß║Żng bromargyrite (AgBr); ion iodide trong iodargyrite (AgI), ... c├Īc ion n├Āy c┼®ng c├│ trong nŲ░ß╗øc biß╗ān v├Ā c├Īc mß╗Å muß╗æi.
.jpg)
(a) Fluorite (b) Sylvite (c) Cryolite
H├¼nh 17.2. Mß╗Öt sß╗æ kho├Īng chß║źt chß╗®a ion halide
| Trong tß╗▒ nhi├¬n, halogen chß╗ē tß╗ōn tß║Īi ß╗¤ dß║Īng hß╗Żp chß║źt. Hß╗Żp chß║źt chß╗¦ yß║┐u cß╗¦a halogen l├Ā muß╗æi halide. |
|---|
1.3. Cß║źu h├¼nh electron lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ Halogen. ─Éß║Ęc ─æiß╗ām cß║źu tß║Īo ph├ón tß╗Ł Halogen
* T├¼m hiß╗āu cß║źu h├¼nh electron lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł v├Ā ─æß║Ęc ─æiß╗ām cß║źu tß║Īo ph├ón tß╗Ł halogen
- Lß╗øp electron ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ halogen ─æß╗üu c├│ 7 electron: ph├ón lß╗øp 5 c├│ 2 electron, ph├ón lß╗øp P c├│ 5 electron.
- Do c├│ 7 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, chŲ░a ─æß║Īt cß║źu h├¼nh bß╗ün vß╗»ng nhŲ░ kh├Ł hiß║┐m, n├¬n ß╗¤ trß║Īng th├Īi tß╗▒ do, hai nguy├¬n tß╗Ł halogen g├│p chung mß╗Öt cß║Ęp electron ─æß╗ā h├¼nh th├Ānh ph├ón tß╗Ł.
.jpg)
- Vß╗øi X l├Ā k├Ł hiß╗ću c├Īc nguy├¬n tß╗æ halogen.
- C├┤ng thß╗®c cß║źu tß║Īo cß╗¦a ph├ón tß╗Ł halogen: X ŌĆō X.
| ─ÉŲĪn chß║źt halogen tß╗ōn tß║Īi ß╗¤ dß║Īng ph├ón tß╗Ł X2 li├¬n kß║┐t trong ph├ón tß╗Ł l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c. |
|---|
1.4. T├Łnh chß║źt vß║Łt l├Ł cß╗¦a c├Īc Halogen
* T├¼m hiß╗āu v├Ā giß║Żi th├Łch mß╗Öt sß╗æ t├Łnh chß║źt vß║Łt l├Ł cß╗¦a halogen
- C├Īc halogen ├Łt tan trong nŲ░ß╗øc, tan nhiß╗üu trong dung m├┤i hß╗»u cŲĪ kh├┤ng ph├ón cß╗▒c nhŲ░ hexane (C6H14), carbon tetrachloride (CCl4),...
Bß║Żng 17.1. Mß╗Öt sß╗æ ─æß║Ęc ─æiß╗ām cß╗¦a c├Īc nguy├¬n tß╗æ nh├│m Halogen

|
- Tß╗½ fluorine den iodine: + Trß║Īng th├Īi tß║Łp hß╗Żp cß╗¦a ─æŲĪn chß║źt ß╗¤ 20┬░C thay ─æß╗Ģi: fluorine v├Ā chlorine thß╗ā kh├Ł, bromine ß╗¤ thß╗ā lß╗Ång, iodine ß╗¤ thß╗ā rß║»n. + M├Āu sß║»c ─æß║Łm dß║¦n: fluorine c├│ m├Āu lß╗źc nhß║Īt, chlorine c├│ m├Āu v├Āng lß╗źc, bromine c├│ m├Āu n├óu ─æß╗Å, iodine c├│ m├Āu ─æen t├Łm. + Nhiß╗ćt ─æß╗Ö n├│ng chß║Ży v├Ā nhiß╗ćt ─æß╗Ö s├┤i t─āng dß║¦n. - Nhiß╗ćt ─æß╗Ö n├│ng chß║Ży v├Ā nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a ─æŲĪn chß║źt halogen bß╗ŗ ß║Żnh hŲ░ß╗¤ng bß╗¤i tŲ░ŲĪng t├Īc van der Waals giß╗»a c├Īc ph├ón tß╗Ł. Tß╗½ fluorine ─æß║┐n iodine, khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł v├Ā b├Īn k├Łnh nguy├¬n tß╗Ł t─āng, l├Ām t─āng tŲ░ŲĪng t├Īc van der Waals, dß║½n ─æß║┐n nhiß╗ćt ─æß╗Ö n├│ng chß║Ży, nhiß╗ćt ─æß╗Ö s├┤i t─āng. |
|---|
1.5. T├Łnh chß║źt h├│a hß╗Źc cß╗¦a c├Īc Halogen
* T├¼m hiß╗āu t├Łnh chß║źt ho├Ī hß╗Źc ─æß║Ęc trŲ░ng cß╗¦a halogen
- Halogen c├│ cß║źu h├¼nh electron lß╗øp ngo├Āi c├╣ng l├Ā ns2np5 n├¬n nguy├¬n tß╗Ł c├│ xu hŲ░ß╗øng nhß║Łn th├¬m 1 electron hoß║Ęc d├╣ng chung electron vß╗øi nguy├¬n tß╗Ł kh├Īc ─æß╗ā ─æß║Īt cß║źu h├¼nh electron bß╗ün vß╗»ng cß╗¦a kh├Ł hiß║┐m tŲ░ŲĪng ß╗®ng.
- SŲĪ ─æß╗ō tß╗Ģng qu├Īt: X + 1e ŌåÆ X-
a. T├Īc dß╗źng vß╗øi kim loß║Īi
- C├Īc halogen phß║Żn ß╗®ng vß╗øi kim loß║Īi thß╗ā hiß╗ćn c├Īc mß╗®c ─æß╗Ö kh├Īc nhau (H├¼nh 17.3).
- Fluorine t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi tß║źt cß║Ż kim loß║Īi. V├Ł dß╗ź: 2Ag + F2 ŌåÆ 2AgF
- Chlorine t├Īc dß╗źng vß╗øi hß║¦u hß║┐t c├Īc kim loß║Īi (trß╗½ Au, Pt). V├Ł dß╗ź: 2Fe + 3Cl2 ŌåÆ2FeCl3
- Bromine phß║Żn ß╗®ng vß╗øi nhiß╗üu kim loß║Īi, nhŲ░ng khß║Ż n─āng phß║Żn ß╗®ng yß║┐u hŲĪn so vß╗øi fluorine v├Ā chlorine. V├Ł dß╗ź: 2Na+ Br2 ŌåÆ 2NaBr
- Iodine phß║Żn ß╗®ng vß╗øi kim loß║Īi yß║┐u hŲĪn so vß╗øi bromine, chlorine v├Ā fluorine. V├Ł dß╗ź trong phß║Żn ß╗®ng vß╗øi aluminium, bromine phß║Żn ß╗®ng mß║Īnh ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, iodine cß║¦n nŲ░ß╗øc l├Ām x├║c t├Īc ─æß╗ā phß║Żn ß╗®ng xß║Ży ra: 2Al + 3I2 ŌåÆ 2AlI3

Cl2 phß║Żn ß╗®ng vß╗øi Fe I2 phß║Żn ß╗®ng vß╗øi Al, x├║c t├Īc nŲ░ß╗øc
H├¼nh 17.3. Th├Ł nghiß╗ćm halogen phß║Żn ß╗®ng vß╗øi kim loß║Īi
b. T├Īc dß╗źng vß╗øi hydrogen
- Khi t├Īc dß╗źng vß╗øi hydrogen, fluorine phß║Żn ß╗®ng nß╗Ģ mß║Īnh ngay cß║Ż trong b├│ng tß╗æi, nhiß╗ćt ─æß╗Ö rß║źt thß║źp (-252┬░C); chlorine phß║Żn ß╗®ng trong ─æiß╗üu kiß╗ćn cß║¦n chiß║┐u s├Īng hoß║Ęc ─æun n├│ng; bromine phß║Żn ß╗®ng khi ─æun n├│ng 200 - 400oC; iodine phß║Żn ß╗®ng kh├│ kh─ān hŲĪn, cß║¦n ─æun n├│ng 350-500oC, chß║źt x├║c t├Īc Pt v├Ā phß║Żn ß╗®ng xß║Ży ra thuß║Łn nghß╗ŗch
H2 + F2 ŌåÆ 2HF
H2 + Cl2 ŌåÆ 2HCl
H2 + Br2 ŌåÆ 2HBr
H2 + I2 Ōćö 2HI
Bß║Żng 17.2. N─āng lŲ░ß╗Żng li├¬n kß║┐t cß╗¦a HX
.jpg)
c. T├Īc dß╗źng vß╗øi dung dß╗ŗch kiß╗üm
- Halogen phß║Żn ß╗®ng vß╗øi dung dß╗ŗch kiß╗üm, sß║Żn phß║®m tß║Īo th├Ānh phß╗ź thuß╗Öc v├Āo nhiß╗ćt ─æß╗Ö phß║Żn ß╗®ng. V├Ł dß╗ź, chlorine phß║Żn ß╗®ng vß╗øi dung dß╗ŗch NaOH ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng v├Ā nhiß╗ćt ─æß╗Ö tr├¬n 70┬░C:
Cl2 + 2NaOH ŌåÆ NaCl + NaClO +H2O
3Cl2 + NaOH ŌåÆ 5NaCl + NaClO3 + 3H2O
- Hß╗Śn hß╗Żp dung dß╗ŗch NaCl v├Ā NaClO ─æŲ░ß╗Żc gß╗Źi l├Ā nŲ░ß╗øc Javel, c├│ t├Łnh oxi ho├Ī mß║Īnh n├¬n ─æŲ░ß╗Żc d├╣ng l├Ām chß║źt tß║®y m├Āu v├Ā s├Īt tr├╣ng.
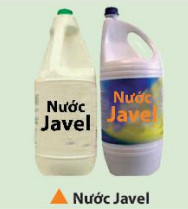
- Phß║Żn ß╗®ng cß╗¦a chlorine vß╗øi dung dß╗ŗch kiß╗üm ─æŲ░ß╗Żc d├╣ng ─æß╗ā sß║Żn xuß║źt c├Īc chß║źt tß║®y rß╗Ła, s├Īt tr├╣ng, tß║®y trß║»ng trong ng├Ānh dß╗ćt, da, bß╗Öt giß║źy, ... nhŲ░ calcium hypochlorite (Ca(ClO)2); calcium oxychloride (CaOCl2),...
d. T├Īc dß╗źng vß╗øi dung dß╗ŗch muß╗æi halide
* Thß╗▒c h├Ānh th├Ł nghiß╗ćm so s├Īnh t├Łnh chß║źt ho├Ī hß╗Źc cß╗¦a halogen
Th├Ł nghiß╗ćm 1: So s├Īnh t├Łnh chß║źt ho├Ī hß╗Źc cß╗¦a halogen
- Ho├Ī chß║źt: dung dß╗ŗch NaBr, Nam, nŲ░ß╗øc chlorine, nŲ░ß╗øc bromine v├Ā dung dß╗ŗch hß╗ō tinh bß╗Öt.
- Dß╗źng cß╗ź: ß╗æng nghiß╗ćm, ß╗æng h├║t nhß╗Å giß╗Źt, kß║╣p gß╗Ś, gi├Ī ─æß╗ā ß╗æng nghiß╗ćm.
- Tiß║┐n h├Ānh: Thß╗▒c hiß╗ćn c├Īc bŲ░ß╗øc theo Bß║Żng 17.3.
Bß║Żng 17.3. C├Īc bŲ░ß╗øc tiß║┐n h├Ānh th├Ł nghiß╗ćm 1
.jpg)
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng:
Cl2 + 2NaBr ŌåÆ 2NaCl + Br2
Br2 + 2Nal ŌåÆ 2NaBr + I2
e. T├Łnh tß║®y m├Āu cß╗¦a kh├Ł chlorine ß║®m
* Thß╗▒c h├Ānh th├Ł nghiß╗ćm t├¼m hiß╗āu t├Łnh tß║®y m├Āu cß╗¦a kh├Ł chlorine ß║®m
Th├Ł nghiß╗ćm 2: T├Łnh tß║®y m├Āu cß╗¦a kh├Ł chlorine ß║®m
- Ho├Ī chß║źt: tinh thß╗ā potassium permanganate (KMnO4), dung dß╗ŗch HCl ─æß║Ęc, giß║źy m├Āu, nŲ░ß╗øc cß║źt.
- Dß╗źng cß╗ź: ß╗æng nghiß╗ćm 2 nh├Īnh, n├║t cao su, gi├Ī ─æß╗Ī, th├¼a thuß╗Ę tinh, ß╗æng h├║t nhß╗Å giß╗Źt.
- Tiß║┐n h├Ānh:
+ BŲ░ß╗øc 1: D├╣ng th├¼a thuß╗Ę tinh lß║źy mß╗Öt ├Łt tinh thß╗ā KMnO4 cho v├Āo nh├Īnh d├Āi cß╗¦a ß╗æng nghiß╗ćm. D├╣ng ß╗æng h├║t nhß╗Å giß╗Źt lß║źy khoß║Żng 1 ml dung dß╗ŗch HCl ─æß║Ęc cho v├Āo nh├Īnh ngß║»n cß╗¦a ß╗æng nghiß╗ćm. Lß║»p dß╗źng cß╗ź ─æiß╗üu chß║┐ kh├Ł Cl2 ß║®m nhŲ░ H├¼nh 17.4. LŲ░u ├Į: Kiß╗ām tra n├║t cao su phß║Żi ─æŲ░ß╗Żc ─æß║Ły k├Łn trŲ░ß╗øc khi thß╗▒c hiß╗ćn bŲ░ß╗øc 2.
+ BŲ░ß╗øc 2: Nghi├¬ng ß╗æng nghiß╗ćm sao cho dung dß╗ŗch HCl tiß║┐p x├║c vß╗øi KMnO4.
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng ─æiß╗üu chß║┐ kh├Ł Cl2
2KMnO4 + 16HCl ŌåÆ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
.jpg)
H├¼nh 17.4. Bß╗Ö dß╗źng cß╗ź ─æiß╗üu chß║┐ v├Ā thß╗Ł t├Łnh tß║®y m├Āu cß╗¦a khß╗ē chlorine ß║®m
|
- Halogen c├│ 7 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, n├¬n nguy├¬n tß╗Ł halogen c├│ xu hŲ░ß╗øng nhß║Łn th├¬m 1 electron ─æß╗ā tß║Īo hß╗Żp chß║źt ion hoß║Ęc d├╣ng chung electron ─æß╗ā tß║Īo hß╗Żp chß║źt cß╗Öng ho├Ī trß╗ŗ. - T├Łnh chß║źt ho├Ī hß╗Źc ─æß║Ęc trŲ░ng cß╗¦a halogen l├Ā t├Łnh oxi ho├Ī mß║Īnh, t├Łnh oxi ho├Ī giß║Żm dß║¦n tß╗½ fluorine den iodine. |
|---|
1.6. ß╗©ng dß╗źng cß╗¦a Halogen
* T├¼m hiß╗āu ß╗®ng dß╗źng cß╗¦a halogen
- Fluorine: ─ÉŲ░ß╗Żc sß╗Ł dß╗źng trong sß║Żn xuß║źt c├Īc chß║źt dß║╗o ma s├Īt thß║źp, nhŲ░ teflon phß╗¦ tr├¬n bß╗ü mß║Ęt chß║Żo chß╗æng d├Łnh d├╣ng cho thiß║┐t bß╗ŗ nh├Ā bß║┐p, dß╗źng cß╗ź th├Ł nghiß╗ćm, ... Mß╗Öt sß╗æ hß╗Żp chß║źt kh├Īc cß╗¦a fluorine nhŲ░ Cryolite d├╣ng trong sß║Żn xuß║źt nh├┤m; Sodium fluoride sß╗Ł dß╗źng nhŲ░ mß╗Öt loß║Īi thuß╗æc trß╗½ s├óu, chß╗æng gi├Īn; mß╗Öt sß╗æ muß╗æi fluoride kh├Īc ─æŲ░ß╗Żc th├¬m v├Āo thuß╗æc ─æ├Īnh r─āng, tß║Īo men r─āng, ...
ß╗©ng dß╗źng cß╗¦a fluorine trong sß║Żn xuß║źt kem ─æ├Īnh r─āng
- Chlorine: L├Ā chß║źt oxi ho├Ī mß║Īnh, ─æŲ░ß╗Żc sß╗Ł dß╗źng l├Ām chß║źt tß║®y trß║»ng v├Ā khß╗Ł tr├╣ng nŲ░ß╗øc. Mß╗Öt lŲ░ß╗Żng lß╗øn chlorine ─æŲ░ß╗Żc d├╣ng ─æß╗ā sß║Żn xuß║źt c├Īc dung m├┤i nhŲ░ carbon tetrachloride (CCl4), chloroform (CHCl3), 1,2-dichloroethylene (C2H2Cl2),...
ß╗©ng dß╗źng cß╗¦a chlorine trong sß║Żn xuß║źt dung m├┤i hß╗»u cŲĪ
- Bromine: ─ÉŲ░ß╗Żc sß╗Ł dß╗źng ─æß╗ā ─æiß╗üu chß║┐ thuß╗æc an thß║¦n, thuß╗æc trß╗½ s├óu, thuß╗æc nhuß╗Öm, mß╗▒c in; silver bromide (AgBr) l├Ā chß║źt nhß║Īy vß╗øi ├Īnh s├Īng, d├╣ng ─æß╗ā tr├Īng phim ß║Żnh, phß╗ź gia chß╗æng ─ān m├▓n cho x─āng, ...

ß╗©ng dß╗źng cß╗¦a bromine trong sß║Żn xuß║źt phim cuß╗Ön
- Iodine: L├Ā nguy├¬n tß╗æ vi lŲ░ß╗Żng cß║¦n thiß║┐t cho dinh dŲ░ß╗Īng cß╗¦a con ngŲ░ß╗Øi, thiß║┐u iodine c├│ thß╗ā g├óy n├¬n t├Īc hß║Īi cho sß╗®c khoß║╗ nhŲ░ g├óy bß╗ćnh bŲ░ß╗øu cß╗Ģ, thiß╗āu n─āng tr├Ł tuß╗ć, hß╗Śn hß╗Żp ethanol v├Ā iodine l├Ā chß║źt s├Īt tr├╣ng phß╗Ģ biß║┐n. C├Īc hß╗Żp chß║źt iodide ─æŲ░ß╗Żc sß╗Ł dß╗źng l├Ām chß║źt x├║c t├Īc, dŲ░ß╗Żc phß║®m v├Ā thuß╗æc nhuß╗Öm.
B├Āi tß║Łp minh hß╗Źa
B├Āi 1: Trong ─æ├©n halogen, bao quanh d├óy t├│c l├Ām bß║▒ng wolfram l├Ā c├Īc kh├Ł hiß║┐m nhŲ░ krypton, xenon v├Ā mß╗Öt lŲ░ß╗Żng nhß╗Å halogen nhŲ░ bromine hoß║Ęc iodine, gi├║p t─āng tuß╗Ģi thß╗Ź v├Ā duy tr├¼ ─æß╗Ö trong suß╗æt cß╗¦a vß╗Å b├│ng ─æ├©n. ─É├©n halogen ─æŲ░ß╗Żc sß╗Ł dß╗źng trong c├Īc m├Īy sŲ░ß╗¤i, l├▓ nŲ░ß╗øng, bß║┐p halogen hß╗ōng ngoß║Īi,ŌĆ” do ─æß║Ęc ─æiß╗ām tß╗Åa nhiß╗üu nhiß╗ćt.
Nhu cß║¦u vß╗ü nŲ░ß╗øc sß║Īch l├Ā thiß║┐t yß║┐u v├Ā cß║źp b├Īch cß╗¦a con ngŲ░ß╗Øi, nŲ░ß╗øc sß║Īch ─æŲ░ß╗Żc d├╣ng cho sinh hoß║Īt, ─ān uß╗æng v├Ā sß║Żn xuß║źt. C├Īch xß╗Ł l├Ł nŲ░ß╗øc phß╗Ģ biß║┐n hiß╗ćn nay l├Ā sß╗Ł dß╗źng nŲ░ß╗øc chlorine hoß║Ęc c├Īc chß║źt c├│ chß╗®a chlorine ─æß╗ā khß╗Ł tr├╣ng nŲ░ß╗øc
Nh├│m halogen gß╗ōm nhß╗»ng nguy├¬n tß╗æ n├Āo? Halogen c├│ nhß╗»ng t├Łnh chß║źt v├Ā ß╗®ng dß╗źng trong l─®nh vß╗▒c n├Āo?
HŲ░ß╗øng dß║½n giß║Żi
- Nh├│m halogen gß╗ōm nhß╗»ng nguy├¬n tß╗æ nh├│m VIIA: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), astatine (At), tennessine (Ts)
- T├Łnh chß║źt: t├Īc dß╗źng vß╗øi kim loß║Īi, hydrogen, dung dß╗ŗch kiß╗üm, muß╗æi halide
- ß╗©ng dß╗źng:
+ Fluorine: chß║Żo chß╗æng d├Łnh, kem ─æ├Īnh r─āng
+ Chlorine: s├Īt khuß║®n, khß╗Ł tr├╣ng
+ Bromine: thuß╗æc an thß║¦n, tr├Īng phim ß║Żnh
+ Iodine: chß╗æng bŲ░ß╗øu cß╗Ģ, chß║źt x├║c t├Īc, dŲ░ß╗Żc phß║®m, thuß╗æc nhuß╗Öm
B├Āi 2. V├¼ sao clo ß║®m c├│ t├Łnh tß║®y trß║»ng c├▓n clo kh├┤ th├¼ kh├┤ng?
HŲ░ß╗øng dß║½n giß║Żi
Cl + H2 O ŌåÆ HCl + HClO ( Axit hipoclorŲĪ)
HClO c├│ t├Łnh tß║®y trß║»ng
B├Āi 3. Viß║┐t 3 phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng chß╗®ng tß╗Å clo c├│ t├Łnh oxi h├│a, 2 phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng chß╗®ng tß╗Å clo c├│ t├Łnh khß╗Ł.
HŲ░ß╗øng dß║½n giß║Żi
3 phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng chß╗®ng tß╗Å Clo c├│ t├Łnh oxi h├│a:
2Na + Cl2 ŌåÆ 2NaCl
2Fe + 3Cl2 ŌåÆ 2FeCl3
H2 + Cl2 ŌåÆ 2HCl
2 phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng chß╗®ng tß╗Å Clo c├│ t├Łnh khß╗Ł:
Cl + H2 O ŌåÆ HCl+ HClO ( Axit hipoclorŲĪ)
Cl2 + 2NaOH ŌåÆ NaCl + NaClO + H2 O
B├Āi 4.
a) Tß╗½ MnO2 , HCl ─æß║Ęc, Fe h├Ży viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng ─æiß╗üu chß║┐ Cl2 , FeCl2 v├Ā FeCl3 .
b) Tß╗½ muß╗æi ─ān, nŲ░ß╗øc v├Ā c├Īc thiß║┐t bß╗ŗ cß║¦n thiß║┐t, h├Ży viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng ─æiß╗üu chß║┐ Cl2 , HCl v├Ā nŲ░ß╗øc Javel .
HŲ░ß╗øng dß║½n giß║Żi
a, MnO2 + 4HCl ŌåÆ MnCl2 + Cl2 + 2H2 O
Fe + HCl ŌåÆ FeCl2 + H2 Ōåæ
FeCl2 + 2Cl2 ŌåÆ 2FeCl3
b, 2NaCl + 2H2 O ŌåÆ H2 + 2NaOH + Cl2
Cl2 + H2 ŌåÆ 2HCl
Cl2 + NaOH ŌåÆ NaCl + NaClO + H2
Luyß╗ćn tß║Łp B├Āi 17 H├│a 10 CTST
Sau b├Āi hß╗Źc n├Āy, hß╗Źc sinh sß║Į:
- Ph├Īt biß╗āu ─æŲ░ß╗Żc trß║Īng th├Īi tß╗▒ nhi├¬n cß╗¦a c├Īc nguy├¬n tß╗æ halogen.
- M├┤ tß║Ż ─æŲ░ß╗Żc trß║Īng th├Īi, m├Āu sß║»c, nhiß╗ćt ─æß╗Ö n├│ng chß║Ży, nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc ─æŲĪn chat halogen.
- Giß║Żi th├Łch ─æŲ░ß╗óC sß╗▒ biß║┐n ─æß╗Ģi nhiß╗ćt ─æß╗Ö n├│ng chß║Ży, nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc ─æŲĪn chß║źt halogen dß╗▒a v├Āo tŲ░ŲĪng t├Īc van der Waals.
- Tr├¼nh b├Āy ─æŲ░ß╗Żc xu hŲ░ß╗øng nhß║Łn th├¬mlelectron (tß╗½ kim loß║Īi) hoß║Ęc d├╣ng chung electron (vß╗øi phi kim) ─æß╗ā tß║Īo hß╗Żp chß║źt ion hoß║Ęc hß╗Żp chß║źt cß╗Öng ho├Ī trß╗ŗ dß╗▒a theo cß║źu h├¼nh electron.
- Giß║Żi th├Łch ─æŲ░ß╗Żc xu hŲ░ß╗øng phß║Żn ß╗®ng cß╗¦a c├Īc ─æŲĪn chß║źt halogen vß╗øi hydrogen theo khß║Ż n─āng hoß║Īt ─æß╗Öng cß╗¦a halogen v├Ā n─āng lŲ░ß╗Żng li├¬n kß║┐t H-X.
- Viß║┐t ─æŲ░ß╗Żc phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng tß╗▒ oxi ho├Ī - khß╗Ł cß╗¦a chlorine trong phß║Żn ß╗®ng vß╗øi dung dß╗ŗch sodium hydroxide ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng v├Ā khi ─æun n├│ng, ß╗®ng dß╗źng cß╗¦a phß║Żn ß╗®ng n├Āy trong sß║Żn xuß║źt chß║źt tß║®y rß╗Ła.
- Thß╗▒c hiß╗ćn ─æŲ░ß╗Żc (hoß║Ęc quan s├Īt video) th├Ł nghiß╗ćm chß╗®ng minh ─æŲ░ß╗Żc xu hŲ░ß╗øng giß║Żm dß║¦n t├Łnh oxi ho├Ī cß╗¦a c├Īc halogen; chß╗®ng minh t├Łnh oxi ho├Ī mß║Īnh cß╗¦a c├Īc halogen v├Ā so s├Īnh t├Łnh oxi ho├Ī giß╗»a ch├║ng.
3.1. Trß║»c nghiß╗ćm B├Āi 17 H├│a 10 CTST
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 17 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. Clo
- B. Brom
- C. Flo
- D. Iot
-
- A. I
- B. Br
- C. Cl
- D. F
-
- A. Lß╗øp electron ngo├Āi c├╣ng ─æß╗üu c├│ 7 electron.
- B. Nguy├¬n tß╗Ł ─æß╗üu c├│ khß║Ż n─āng nhß║Łn th├¬m 1 electron.
- C. Chß╗ē c├│ sß╗æ oxi h├│a -1 trong c├Īc hß╗Żp chß║źt.
- D. C├Īc hß╗Żp chß║źt vß╗øi hi─æro ─æß╗üu l├Ā hß╗Żp chß║źt cß╗Öng h├│a trß╗ŗ.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 17 H├│a 10 CTST
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 17 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Giß║Żi c├óu hß╗Åi 1 trang 106 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 2 trang 106 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 3 trang 106 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 107 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 4 trang 107 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 5 trang 107 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 6 trang 108 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 7 trang 108 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 108 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 8 trang 109 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 9 trang 109 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 10 trang 110 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 11 trang 110 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 12 trang 111 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 13 trang 111 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 14 trang 111 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 15 trang 112 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 112 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Vß║Łn dß╗źng trang 112 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 16 trang 113 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 17 trang 113 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Vß║Łn dß╗źng trang 113 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 1 trang 113 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 2 trang 113 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3 trang 113 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.1 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.2 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.3 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.4 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.5 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.6 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.7 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.8 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.9 trang 75 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.10 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.11 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.12 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.13 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.14 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.15 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.16 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.17 trang 76 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.18 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.19 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.20 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.21 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.22 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.23 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.24 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.25 trang 77 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.26 trang 78 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 17.27 trang 78 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Hß╗Åi ─æ├Īp B├Āi 17 H├│a hß╗Źc 10 CTST
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!







