Th├┤ng qua nß╗Öi dung chi tiß║┐t cß╗¦a B├Āi 3: Nguy├¬n tß╗æ h├│a hß╗Źc lß╗øp 10 SGK Ch├ón trß╗Øi s├Īng tß║Īo ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn b├¬n dŲ░ß╗øi ─æ├óy c├Īc em hß╗Źc sinh sß║Į nß║»m ─æŲ░ß╗Żc kh├Īi niß╗ćm ─æß╗ōng vß╗ŗ, nguy├¬n tß╗Ł khß╗æi, biß║┐t c├Īch t├Łnh ─æŲ░ß╗Żc nguy├¬n tß╗Ł khß╗æi trung b├¼nh mß╗Öt c├Īch th├Ānh thß║Īo nhß║źt.
Mß╗Øi c├Īc em tham khß║Żo nß╗Öi dung chi tiß║┐t!
T├│m tß║»t l├Į thuyß║┐t
1.1. Hß║Īt nh├ón nguy├¬n tß╗Ł
a. T├¼m hiß╗āu vß╗ü ─æiß╗ćn t├Łch hß║Īt nh├ón
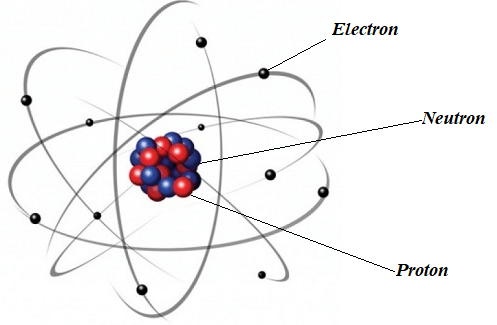
H├¼nh 3.1. M├┤ h├¼nh nguy├¬n tß╗Ł nitrogen theo Rutherford
|
- Sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón (Z) = sß╗æ proton (P) = sß╗æ electron (E). - ─Éiß╗ćn t├Łch hß║Īt nh├ón = +Z. |
|---|
b. T├¼m hiß╗āu vß╗ü sß╗æ khß╗æi cß╗¦a nguy├¬n tß╗Ł
Bß║Żng 3.1. Sß╗æ lŲ░ß╗Żng c├Īc hß║Īt cŲĪ bß║Żn v├Ā sß╗æ khß╗æi cß╗¦a nguy├¬n tß╗Ł mß╗Öt sß╗æ nguy├¬n tß╗æ
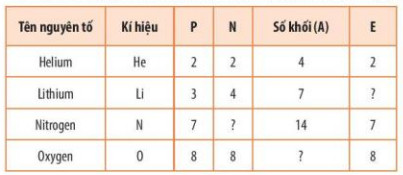
| Số khối (A) = số proton (P) + số neutron (N) |
|---|
1.2. Nguy├¬n tß╗æ H├│a hß╗Źc
a. T├¼m hiß╗āu vß╗ü sß╗æ hiß╗ću nguy├¬n tß╗Ł
- Sß╗æ hiß╗ću nguy├¬n tß╗Ł cß╗¦a mß╗Öt nguy├¬n tß╗æ ─æŲ░ß╗Żc quy Ų░ß╗øc bß║▒ng sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ ─æ├│.
- Sß╗æ hiß╗ću nguy├¬n tß╗Ł (k├Ł hiß╗ću l├Ā Z) cho biß║┐t:
+ Sß╗æ proton trong hß║Īt nh├ón nguy├¬n tß╗Ł.
+ Sß╗æ electron trong nguy├¬n tß╗Ł.
|
- Sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón nguy├¬n tß╗Ł cß╗¦a mß╗Öt nguy├¬n tß╗æ ─æŲ░ß╗Żc gß╗Źi l├Ā sß╗æ hiß╗ću nguy├¬n tß╗Ł (Z) cß╗¦a nguy├¬n tß╗æ ─æ├│. - Mß╗Śi nguy├¬n tß╗æ ho├Ī hß╗Źc c├│ mß╗Öt sß╗æ hiß╗ću nguy├¬n tß╗Ł. |
|---|
b. T├¼m hiß╗āu kh├Īi niß╗ćm nguy├¬n tß╗æ ho├Ī hß╗Źc
Protium, deuterium v├Ā tritium l├Ā c├Īc loß║Īi nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ hydrogen.
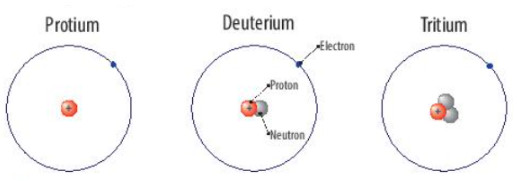
H├¼nh 3.2. C├Īc loß║Īi nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ hydrogen
| Nguy├¬n tß╗æ ho├Ī hß╗Źc l├Ā tß║Łp hß╗Żp nhß╗»ng nguy├¬n tß╗Ł c├│ c├╣ng diß╗ćn t├Łch hß║Īt nh├ón. |
|---|
c. T├¼m hiß╗āu k├Ł hiß╗ću nguy├¬n tß╗Ł
- Sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón nguy├¬n tß╗Ł (c├▓n ─æŲ░ß╗Żc gß╗Źi l├Ā sß╗æ hiß╗ću nguy├¬n tß╗Ł) cß╗¦a mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc v├Ā sß╗æ khß╗æi ─æŲ░ß╗Żc xem l├Ā nhß╗»ng ─æß║Ęc trŲ░ng cŲĪ bß║Żn cß╗¦a nguy├¬n tß╗Ł.
- ─Éß╗ā k├Ł hiß╗ću nguy├¬n tß╗Ł, ngŲ░ß╗Øi ta thŲ░ß╗Øng ghi c├Īc chß╗ē sß╗æ ─æß║Ęc trŲ░ng ß╗¤ b├¬n tr├Īi k├Ł hiß╗ću nguy├¬n tß╗æ vß╗øi sß╗æ khß╗æi A ß╗¤ ph├Ła tr├¬n, sß╗æ hiß╗ću nguy├¬n tß╗Ł Z ß╗¤ ph├Ła dŲ░ß╗øi.
|
K├Ł hiß╗ću nguy├¬n tß╗Ł ─æŲ░ß╗Żc sß╗Ł dß╗źng ─æß╗ā biß╗āu thß╗ŗ nguy├¬n tß╗Ł cß╗¦a mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc. \(_Z^AX\) trong ─æ├│: - A l├Ā sß╗æ khß╗æi - Z l├Ā sß╗æ hiß╗ću nguy├¬n tß╗Ł - X l├Ā k├Ł hiß╗ću nguy├¬n tß╗æ h├│a hß╗Źc |
|---|
1.3. ─Éß╗ōng vß╗ŗ
- T├¼m hiß╗āu kh├Īi niß╗ćm ─æß╗ōng vß╗ŗ
+ C├Īc nguy├¬n tß╗Ł cß╗¦a c├╣ng mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc c├│ thß╗ā c├│ sß╗æ khß╗æi kh├Īc nhau. Sß╗¤ d─® nhŲ░ vß║Ły v├¼ hß║Īt nh├ón cß╗¦a c├Īc nguy├¬n tß╗Ł ─æ├│ c├│ c├╣ng sß╗æ proton, nhŲ░ng c├│ thß╗ā kh├Īc sß╗æ neutron. Nhß╗»ng nguy├¬n tß╗Ł n├Āy ─æŲ░ß╗Żc gß╗Źi l├Ā ─æß╗ōng vß╗ŗ cß╗¦a mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc.
+ Trong tß╗▒ nhi├¬n, hß║¦u hß║┐t c├Īc nguy├¬n tß╗æ ─æŲ░ß╗Żc t├¼m thß║źy dŲ░ß╗øi dß║Īng hß╗Śn hß╗Żp cß╗¦a c├Īc ─æß╗ōng vß╗ŗ. Mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc d├╣ dß║Īng ─æŲĪn chß║źt hay hß╗Żp chß║źt th├¼ tß╗ē lß╗ć giß╗»a c├Īc ─æß╗ōng vß╗ŗ cß╗¦a nguy├¬n tß╗æ n├Āy l├Ā kh├┤ng ─æß╗Ģi. V├Ł dß╗ź, c├Īc quß║Ż chuß╗æi ─æß╗üu chß╗®a nguy├¬n tß╗æ potassium (K) trong th├Ānh phß║¦n dinh dŲ░ß╗Īng cß╗¦a ch├║ng. Ch├║ng c├│ thß╗ā kh├Īc nhau vß╗ü k├Łch thŲ░ß╗øc, h├¼nh d├Īng, m├╣i vß╗ŗ c┼®ng nhŲ░ ─æŲ░ß╗Żc thu hoß║Īch ß╗¤ nhß╗»ng vß╗ŗ tr├Ł ─æß╗ŗa l├Ł kh├Īc nhau nhŲ░ng ─æß╗üu chß╗®a 93,26% sß╗æ nguy├¬n tß╗Ł \(_{19}^{39}K\); 6,73% sß╗æ nguy├¬n tß╗Ł \(_{19}^{41}K\) v├Ā 0,01% sß╗æ nguy├¬n tß╗Ł \(_{19}^{40}K\) trong tß╗Ģng sß╗æ nguy├¬n tß╗Ł potassium c├│ trong ch├║ng.
+ Ngo├Āi nhß╗»ng ─æß╗ōng vß╗ŗ bß╗ün, c├Īc nguy├¬n tß╗æ ho├Ī hß╗Źc c├▓n c├│ mß╗Öt sß╗æ ─æß╗ōng vß╗ŗ kh├┤ng bß╗ün, gß╗Źi l├Ā c├Īc ─æß╗ōng vß╗ŗ ph├│ng xß║Ī, ─æŲ░ß╗Żc sß╗Ł dß╗źng nhiß╗üu trong ─æß╗Øi sß╗æng, y hß╗Źc, nghi├¬n cß╗®u khoa hß╗Źc, ...
| C├Īc ─æß╗ōng vß╗ŗ cß╗¦a mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc l├Ā nhß╗»ng nguy├¬n tß╗Ł c├│ c├╣ng sß╗æ proton (P), c├╣ng sß╗æ hiß╗ću nguy├¬n tß╗Ł (Z), nhŲ░ng kh├Īc nhau vß╗ü sß╗æ neutron (N). Do ─æ├│, sß╗æ khß╗æi (A) cß╗¦a ch├║ng kh├Īc nhau. |
|---|
1.4. Nguy├¬n tß╗Ł khß╗æi v├Ā nguy├¬n tß╗Ł khß╗æi trung b├¼nh
a. T├¼m hiß╗āu nguy├¬n tß╗Ł khß╗æi
- Nguy├¬n tß╗Ł khß╗æi l├Ā khß╗æi lŲ░ß╗Żng tŲ░ŲĪng ─æß╗æi cß╗¦a nguy├¬n tß╗Ł. Khß╗æi lŲ░ß╗Żng cß╗¦a mß╗Öt nguy├¬n tß╗Ł bß║▒ng tß╗Ģng khß╗æi lŲ░ß╗Żng cß╗¦a proton, neutron v├Ā electron trong nguy├¬n tß╗Ł ─æ├│. Proton v├Ā neutron ─æß╗üu c├│ khß╗æi lŲ░ß╗Żng gß║¦n bß║▒ng 1 amu, electron c├│ khß╗æi lŲ░ß╗Żng nhß╗Å hŲĪn rß║źt nhiß╗üu (khoß║Żng 0,00055 amu). Do ─æ├│, c├│ thß╗ā coi nguy├¬n tß╗Ł khß╗æi c├│ gi├Ī trß╗ŗ bß║▒ng sß╗æ khß╗æi.
| Nguy├¬n tß╗Ł khß╗æi cß╗¦a mß╗Öt nguy├¬n tß╗Ł cho biß║┐t khß╗æi lŲ░ß╗Żng cß╗¦a nguy├¬n tß╗Ł ─æ├│ nß║Ęng gß║źp bao nhi├¬u lß║¦n ─æŲĪn vß╗ŗ khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł (1 amu). |
|---|
b. X├Īc ─æß╗ŗnh nguy├¬n tß╗Ł khß╗æi trung b├¼nh
- Mß╗Śi nguy├¬n tß╗æ thŲ░ß╗Øng c├│ nhiß╗üu ─æß╗ōng vß╗ŗ, do ─æ├│ trong thß╗▒c tß║┐, ngŲ░ß╗Øi ta thŲ░ß╗Øng sß╗Ł dß╗źng gi├Ī trß╗ŗ nguy├¬n tß╗Ł khß╗æi trung b├¼nh. Muß╗æn x├Īc ─æß╗ŗnh gi├Ī trß╗ŗ nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a mß╗Öt nguy├¬n tß╗æ, ta cß║¦n phß║Żi biß║┐t ─æŲ░ß╗Żc phß║¦n tr─ām sß╗æ nguy├¬n tß╗Ł c├Īc ─æß╗ōng vß╗ŗ cß╗¦a nguy├¬n tß╗æ ─æ├│ trong tß╗▒ nhi├¬n. NgŲ░ß╗Øi ta thŲ░ß╗Øng sß╗Ł dß╗źng phŲ░ŲĪng ph├Īp phß╗Ģ khß╗æi lŲ░ß╗Żng (Mass Spectrometry-MS) ─æß╗ā x├Īc ─æß╗ŗnh phß║¦n tr─ām sß╗æ nguy├¬n tß╗Ł c├Īc ─æß╗ōng vß╗ŗ trong tß╗▒ nhi├¬n cß╗¦a c├Īc nguy├¬n tß╗æ. ─É├óy c┼®ng l├Ā mß╗Öt phŲ░ŲĪng ph├Īp quan trß╗Źng trong viß╗ćc ph├ón t├Łch th├Ānh phß║¦n v├Ā cß║źu tr├║c c├Īc chß║źt.
- Trong tß╗▒ nhi├¬n, Chlorine c├│ hai ─æß╗ōng vß╗ŗ l├Ā \(_{17}^{35}Cl\) v├Ā \(_{17}^{37}Cl\) c├│ tß╗ē lß╗ć phß║¦n tr─ām sß╗æ nguy├¬n tß╗Ł tŲ░ŲĪng ß╗®ng l├Ā 75,76% v├Ā 24,24%.
- C├Īch x├Īc ─æß╗ŗnh nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a Chlorine: \(\overline {{A_{Cl}}} = \frac{{({A_{35}}_{Cl}.{\% ^{35}}Cl) + ({A_{37Cl}}.{\% ^{37}}Cl)}}{{100}} = \frac{{(35.75,76) + (37x24,24)}}{{100}}\)
|
C├┤ng thß╗®c t├Łnh nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a nguy├¬n tß╗æ X: \(\overline {{{\rm{A}}_{\rm{x}}}} = \frac{{{a_1}.{A_1} + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) \(\overline {{{\rm{A}}_{\rm{x}}}} \) l├Ā nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a X. Ai l├Ā nguy├¬n tß╗Ł khß╗æi ─æß╗ōng vß╗ŗ thß╗® i. ai l├Ā tß╗ē lß╗ć % sß╗æ nguy├¬n tß╗Ł ─æß╗ōng vß╗ŗ thß╗® i. |
|---|
B├Āi tß║Łp minh hß╗Źa
B├Āi 1: Kim cŲ░ŲĪng v├Ā than ch├¼ c├│ vß║╗ ngo├Āi kh├Īc nhau. Tuy nhi├¬n, ch├║ng ─æß╗üu ─æŲ░ß╗Żc tß║Īo th├Ānh tß╗½ c├╣ng mß╗Öt nguy├¬n tß╗æ h├│a hß╗Źc l├Ā nguy├¬n tß╗æ carbon (C). Nguy├¬n tß╗æ ho├Ī hß╗Źc l├Ā g├¼? Mß╗Öt nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ ho├Ī hß╗Źc c├│ nhß╗»ng ─æß║Ęc trŲ░ng cŲĪ bß║Żn n├Āo?
HŲ░ß╗øng dß║½n giß║Żi
- Nguy├¬n tß╗æ h├│a hß╗Źc l├Ā tß║Łp hß╗Żp tß║źt cß║Ż c├Īc nguy├¬n tß╗Ł c├│ c├╣ng ─æiß╗ćn t├Łch hß║Īt nh├ón
- Mß╗Öt nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ h├│a hß╗Źc c├│ nhß╗»ng ─æß║Ęc trŲ░ng: sß╗æ khß╗æi A v├Ā ─æiß╗ćn t├Łch hß║Īt nh├ón
B├Āi 2: Nguy├¬n tß╗Ł sodium c├│ 11 proton. Cho biß║┐t sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón v├Ā sß╗æ electron cß╗¦a nguy├¬n tß╗Ł n├Āy
HŲ░ß╗øng dß║½n giß║Żi
- Nguy├¬n tß╗Ł sodium c├│ 11 proton
ŌåÆ Sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón (Z) = sß╗æ proton = sß╗æ electron = 11
Vß║Ły sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón v├Ā sß╗æ electron cß╗¦a nguy├¬n tß╗Ł sodium ─æß╗üu bß║▒ng 11
Luyß╗ćn tß║Łp B├Āi 3 H├│a 10 CTST
Sau b├Āi hß╗Źc n├Āy, hß╗Źc sinh sß║Į:
- Tr├¼nh b├Āy ─æŲ░ß╗Żc kh├Īi niß╗ćm vß╗ü nguy├¬n tß╗æ ho├Ī hß╗Źc, sß╗æ hiß╗ću nguy├¬n tß╗Ł v├Ā k├Ł hiß╗ću nguy├¬n tß╗Ł.
- Ph├Īt biß╗āu ─æŲ░ß╗Żc kh├Īi niß╗ćm ─æß╗ōng vß╗ŗ, nguy├¬n tß╗Ł khß╗æi.
- T├Łnh ─æŲ░ß╗Żc nguy├¬n tß╗Ł khß╗æi trung b├¼nh (theo amu) dß╗▒a v├Āo khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł v├Ā phß║¦n tr─ām sß╗æ nguy├¬n tß╗Ł cß╗¦a c├Īc ─æß╗ōng vß╗ŗ theo phß╗Ģ khß╗æi lŲ░ß╗Żng ─æŲ░ß╗Żc cung cß║źp.
3.1. Trß║»c nghiß╗ćm B├Āi 3 H├│a 10 CTST
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 3 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. 3717Cl
- B. 3919K
- C. 4019K
- D. 3517Cl
-
- A. N2O.
- B. NO2.
- C. OF2.
- D. CO2.
-
- A. CrCl3.
- B. FeCl3.
- C. AlCl3.
- D. SnCl3.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 3 H├│a 10 CTST
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 3 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Giß║Żi c├óu hß╗Åi 1 trang 20 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 2 trang 20 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 20 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 3 trang 21 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 4 trang 21 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo
Giß║Żi c├óu hß╗Åi 5 trang 22 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 6 trang 22 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 22 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 7 trang 22 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 23 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 8 trang 23 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 9 trang 23 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Vß║Łn dß╗źng trang 24 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 1 trang 25 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 2 trang 25 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3 trang 25 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 4 trang 25 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.1 trang 11 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.2 trang 11 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.3 trang 11 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.4 trang 11 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.5 trang 12 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.6 trang 12 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.7 trang 12 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.8 trang 12 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.9 trang 12 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.10 trang 13 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.11 trang 13 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.12 trang 13 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.13 trang 13 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.14 trang 13 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3.15 trang 13 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Hß╗Åi ─æ├Īp B├Āi 3 H├│a hß╗Źc 10 CTST
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!







