Viß╗ćc hiß╗āu r├Ą vß╗ü c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng tß╗øi tß╗æc ─æß╗Ö phß║Żn ß╗®ng sß║Į gi├║p ├Łch rß║źt nhiß╗üu trong ─æß╗Øi sß╗æng c┼®ng nhŲ░ trong c├Īc ng├Ānh c├┤ng nghiß╗ćp, gi├║p tß║Īo ra th├Ānh phß║®m vß╗øi thß╗Øi gian ngß║»n hŲĪn rß║źt nhiß╗üu. Vß║Ły thß║┐ n├Āo l├Ā tß╗æc ─æß╗Ö phß║Żn ß╗®ng h├│a hß╗Źc? C├│ nhß╗»ng yß║┐u tß╗æ n├Āo ß║Żnh hŲ░ß╗¤ng trß╗▒c tiß║┐p ─æß║┐n tß╗æc ─æß╗Ö n├Āy. C├╣ng t├¼m hiß╗āu th├┤ng qua B├Āi 16: C├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng m├┤n H├│a hß╗Źc 10 chŲ░ŲĪng tr├¼nh SGK Ch├ón trß╗Øi s├Īng tß║Īo ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn b├¬n dŲ░ß╗øi ─æ├óy:
1.1. ß║ónh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö
1.2. ß║ónh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö
1.3. ß║ónh hŲ░ß╗¤ng cß╗¦a ├Īp suß║źt
1.4. ß║ónh hŲ░ß╗¤ng cß╗¦a bß╗ü mß║Ęt tiß║┐p x├║c
1.5. ß║ónh hŲ░ß╗¤ng cß╗¦a chß║źt x├║c t├Īc
1.6. ├Ø ngh─®a thß╗▒c tiß╗ģn cß╗¦a tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong ─æß╗Øi sß╗æng v├Ā sß║Żn xuß║źt
T├│m tß║»t l├Į thuyß║┐t
1.1. ß║ónh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö
* Nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
Th├Ł nghiß╗ćm 1: ß║ónh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
- Ho├Ī chß║źt: dung dß╗ŗch sodium thiosulfate (Na2S2O3) 0,15 M; sulfuric acid (H2SO4) 0,10 M; nŲ░ß╗øc cß║źt.
- Dß╗źng cß╗ź: cß╗æc thuß╗Ę tinh 100 mL (─æŲ░ß╗Żc ─æ├Īnh dß║źu thß║Łp ß╗¤ mß║Ęt ngo├Āi ─æ├Īy cß╗æc), ß╗æng ─æong 50 mL.
- Tiß║┐n h├Ānh:
+ BŲ░ß╗øc 1: Pha lo├Żng dung dß╗ŗch Na2S2O3 0,15 M ─æß╗ā ─æŲ░ß╗Żc c├Īc dung dß╗ŗch c├│ nß╗ōng ─æß╗Ö kh├Īc nhau theo Bß║Żng 16.1.
Bß║Żng 16.1. C├Īch pha lo├Żng dung dß╗ŗch Na2S2O3
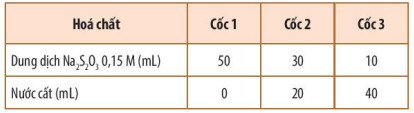
+ BŲ░ß╗øc 2: R├│t ─æß╗ōng thß╗Øi 10 mL dung dß╗ŗch H2SO4 0,1 M v├Āo mß╗Śi cß╗æc v├Ā khuß║źy ─æß╗üu.
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng: Na2S2O3 (aq) + H2SO4 (aq) ŌåÆ Na2SO4 (aq) +S (s) + SO2 (g) + H2O(l)
.jpg)
H├¼nh 16.1. Th├Ł nghiß╗ćm ß║Żnh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
.jpg)
H├¼nh 16.2. H├¼nh minh hoß║Ī chß║źt phß║Żn ß╗®ng c├│ nß╗ōng ─æß╗Ö lß╗øn (a) v├Ā nß╗ōng ─æß╗Ö b├® (b)
- Nß╗ōng ─æß╗Ö cß╗¦a c├Īc chß║źt phß║Żn ß╗®ng t─āng l├Ām t─āng sß╗æ va chß║Īm hiß╗ću quß║Ż n├¬n tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
| Khi t─āng nß╗ōng ─æß╗Ö chß║źt phß║Żn ß╗®ng, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng. |
|---|
1.2. ß║ónh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö
- Nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
V├Ł dß╗ź 1: C├│ 2 cß╗æc thß╗¦y tinh, mß╗Śi cß╗æc ─æß╗▒ng c├╣ng mß╗Öt lŲ░ß╗Żng hß╗Śn hß╗Żp dß╗źng dß╗ŗch oxalic acid (H2C2O4) v├Ā dung dß╗ŗch H2SO4 lo├Żng, tß╗ē lß╗ć 2:1 vß╗ü thß╗ā t├Łch, cß╗æc (1) ─æŲ░ß╗Żc ─æun n├│ng, th├¬m ─æß╗ōng thß╗Øi c├╣ng mß╗Öt lŲ░ß╗Żng dung dß╗ŗch KMnO4 v├Āo mß╗Śi cß╗æc (H├¼nh 16.3a), nhß║Łn thß║źy m├Āu cß╗¦a hß╗Śn hß╗Żp phß║Żn ß╗®ng nhß║Īt dß║¦n theo thß╗Øi gian phß║Żn ß╗®ng (H├¼nh 16.3b).
- PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng: 2KMnO4 (aq) +5H2C2O4 (aq) + 3H2SO4 (aq) ŌåÆMnSO4 (aq) + K2SO4 (aq) +10CO2(g) +8H2O (1)
.jpg)
H├¼nh 16.3. Th├Ł nghiß╗ćm ß║Żnh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
- ß╗× nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng, c├Īc chß║źt phß║Żn ß╗®ng chuyß╗ān ─æß╗Öng vß╗øi tß╗æc ─æß╗Ö nhß╗Å; khi t─āng nhiß╗ćt ─æß╗Ö, c├Īc chß║źt sß║Į chuyß╗ān ─æß╗Öng vß╗øi tß╗æc ─æß╗Ö lß╗øn hŲĪn, dß║½n ─æß║┐n t─āng sß╗æ va chß║Īm hiß╗ću quß║Ż nß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
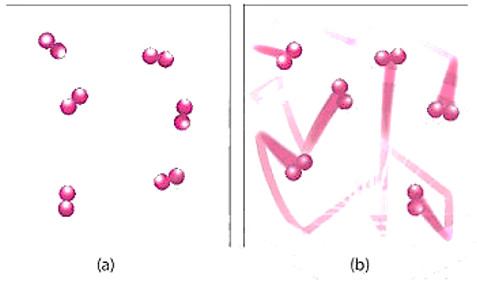
H├¼nh 16.4. H├¼nh minh hoß║Ī chuyß╗ān ─æß╗Öng cß╗¦a chß║źt phß║Żn ß╗®ng khi chŲ░a ─æun n├│ng (a) v├Ā ─æŲ░ß╗Żc ─æun n├│ng (b)
- Kß║┐t quß║Ż tß╗½ c├Īc thß╗▒c nghiß╗ćm cho biß║┐t, khi nhiß╗ćt ─æß╗Ö t─āng l├¬n 10┬░C, tß╗æc ─æß╗Ö cß╗¦a phß║¦n lß╗øn c├Īc phß║Żn ß╗®ng t─āng tß╗½ 2 ─æß║┐n 4 lß║¦n. Sß╗æ lß║¦n t─āng n├Āy ─æŲ░ß╗Żc gß╗Źi l├Ā hß╗ć sß╗æ nhiß╗ćt ─æß╗Ö Van't Hoff (Van-hop), k├Ł hiß╗ću l├Ā \(\gamma \).
- Trong V├Ł dß╗ź 1, nß║┐u nhiß╗ćt ─æß╗Ö ban ─æß║¦u cß╗¦a 2 cß╗æc bß║▒ng nhau, t1 = 20┬░C, nhiß╗ćt ─æß╗Ö cß╗¦a cß╗æc (1) sau khi ─æun n├│ng l├Ā t2= 60┬░C, nhiß╗ćt ─æß╗Ö cß╗æc (2) kh├┤ng thay ─æß╗Ģi v├Ā tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong cß╗æc (1) gß║źp 16 lß║¦n cß╗æc (2). Khi ─æ├│ ta c├│:
\({\gamma ^{\frac{{60 - 20}}{{10}}}} = 16 \to \gamma = 2\)
- Vß║Ły, khi nhiß╗ćt ─æß╗Ö t─āng l├¬n 10┬░C, th├¼ tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng 2 lß║¦n. Gi├Ī trß╗ŗ n├Āy l├Ā hß╗ć sß╗æ nhiß╗ćt ─æß╗Ö Van't Hoff.
|
- Khi t─āng nhiß╗ćt ─æß╗Ö, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng. - Mß╗æi quan hß╗ć giß╗»a nhiß╗ćt ─æß╗Ö v├Ā tß╗æc ─æß╗Ö phß║Żn ß╗®ng ho├Ī hß╗Źc ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng c├┤ng thß╗®c: \(\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = {\gamma ^{\frac{{{t_2} - {t_1}}}{{10}}}}\) Trong ─æ├│: vt1, vt2 l├Ā tß╗æc ─æß╗Ö phß║Żn ß╗®ng ß╗¤ 2 nhiß╗ćt ─æß╗Ö t1 v├Ā t2; \(\gamma \) l├Ā hß╗ć sß╗æ nhiß╗ćt ─æß╗Ö Van't Hoff. Quy tß║»c Vant Hoff chß╗ē gß║¦n ─æ├║ng trong khoß║Żng nhiß╗ćt ─æß╗Ö kh├┤ng cao. |
|---|
1.3. ß║ónh hŲ░ß╗¤ng cß╗¦a ├Īp suß║źt
* Nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a ├Īp suß║źt ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
- Trong phß║Żn ß╗®ng ho├Ī hß╗Źc c├│ sß╗▒ tham gia cß╗¦a chß║źt kh├Ł, ├Īp suß║źt c├│ thß╗ā ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng.
V├Ł dß╗ź 2: Mß╗Öt trong nhß╗»ng nghi├¬n cß╗®u nhß║▒m giß║Żm thiß╗āu ph├Īt thß║Żi kh├Ł CO2 v├Āo kh├Ł quyß╗ān g├óy hiß╗ću ß╗®ng nh├Ā k├Łnh, l├Ā chuyß╗ān CO2 th├Ānh sß║Żn phß║®m c├│ gi├Ī trß╗ŗ nhŲ░ methanol (CH3OH).
Phß║Żn ß╗®ng cß║¦n thß╗▒c hiß╗ćn ß╗¤ ├Īp suß║źt cao, khoß║Żng 58 ŌĆō 103 bar ─æß╗ā t─āng tß╗æc ─æß╗Ö phß║Żn ß╗®ng. PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng:
CO2(g) + 3H2(g) ŌåÆ CH3OH(g) + H2O(g)

H├¼nh 16.5. Minh hoß║Ī khi t─āng ├Īp suß║źt cß╗¦a c├Īc chß║źt kh├Ł tham gia phß║Żn ß╗®ng
- Khi t─āng ├Īp suß║źt th├¼ nß╗ōng ─æß╗Ö chß║źt kh├Ł t─āng, n├¬n tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
| ─Éß╗æi vß╗øi phß║Żn ß╗®ng c├│ chß║źt kh├Ł tham gia, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng khi t─āng ├Īp suß║źt. |
|---|
1.4. ß║ónh hŲ░ß╗¤ng cß╗¦a bß╗ü mß║Ęt tiß║┐p x├║c
a. Nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a bß╗ü mß║Ęt tiß║┐p x├║c ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
Th├Ł nghiß╗ćm 2: ß║ónh hŲ░ß╗¤ng cß╗¦a bß╗ü mß║Ęt tiß║┐p x├║c ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
- Ho├Ī chß║źt: dung dß╗ŗch HCl 1 M, ─æ├Ī v├┤i (CaCO3) dß║Īng khß╗æi v├Ā dß║Īng hß║Īt nhß╗Å.
- Dß╗źng cß╗ź: b├¼nh tam gi├Īc 100 mL, ß╗æng ─æong 50 mL, c├ón.
- Tiß║┐n h├Ānh:
+ BŲ░ß╗øc 1: Cß║¦n khoß║Żng 2 g CaCO3 mß╗Śi loß║Īi, cho v├Āo 2 b├¼nh tam gi├Īc (1), (2).
+ BŲ░ß╗øc 2: ─Éong khoß║Żng 20 ml dung dß╗ŗch HCl, r├│t ─æß╗ōng thß╗Øi v├Āo mß╗Śi b├¼nh tam gi├Īc.
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng:
CaCO3(s) + 2HCl(aq) ŌåÆ CaCl2(aq) + H2O(1) + CO2(g)
H├¼nh 16.6. Minh hoß║Ī th├Ł nghiß╗ćm nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a bß╗ü mß║Ęt tiß║┐p x├║c ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
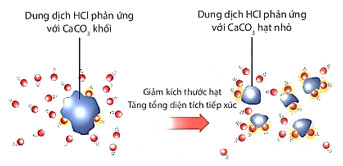
H├¼nh 16.7. Minh hoß║Ī dung dß╗ŗch HCl phß║Żn ß╗®ng vß╗øi CaCO3 c├│ k├Łch thŲ░ß╗øc kh├Īc nhau
| Khi t─āng diß╗ćn t├Łch bß╗ü mß║Ęt tiß║┐p x├║c cß╗¦a chß║źt phß║Żn ß╗®ng, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng. |
|---|
1.5. ß║ónh hŲ░ß╗¤ng cß╗¦a chß║źt x├║c t├Īc
- Vß╗øi mß╗Öt sß╗æ phß║Żn ß╗®ng ho├Ī hß╗Źc, ─æß╗ā t─āng tß╗æc ─æß╗Ö phß║Żn ß╗®ng, ngŲ░ß╗Øi ta sß╗Ł dß╗źng chß║źt x├║c t├Īc, ─æŲ░ß╗Żc ghi tr├¬n m┼®i t├¬n trong phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc.
* Nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a x├║c t├Īc ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
- Th├Ł nghiß╗ćm 3: ß║ónh hŲ░ß╗¤ng cß╗¦a x├║c t├Īc ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
- Ho├Ī chß║źt: dung dß╗ŗch hydrogen peroxide (H2O2) 30%, bß╗Öt MnO2
- Dß╗źng cß╗ź: ß╗æng nghiß╗ćm, t├Ān ─æ├│m ─æß╗Å.
- Tiß║┐n h├Ānh:
+ BŲ░ß╗øc 1: R├│t khoß║Żng 2 mL dung dß╗ŗch H2O2 v├Āo 2 ß╗æng nghiß╗ćm (1), (2).
+ BŲ░ß╗øc 2: Th├¬m mß╗Öt ├Łt bß╗Öt MnO2 v├Āo ß╗æng nghiß╗ćm (2) v├Ā ─æŲ░a nhanh t├Ān ─æ├│m ─æß╗Å v├Āo miß╗ćng 2 ß╗æng nghiß╗ćm (H├¼nh 16.8).
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng:
2H2O2 (aq) ŌåÆ 2H2O (l) + O2 (g)

H├¼nh 16.8. Th├Ł nghiß╗ćm nghi├¬n cß╗®u ß║Żnh hŲ░ß╗¤ng cß╗¦a x├║c t├Īc ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng
| Chß║źt x├║c t├Īc l├Ām t─āng tß╗æc ─æß╗Ö cß╗¦a phß║Żn ß╗®ng ho├Ī hß╗Źc, nhŲ░ng vß║½n ─æŲ░ß╗Żc bß║Żo to├Ān vß╗ü lŲ░ß╗Żng v├Ā chß║źt khi kß║┐t th├║c phß║Żn ß╗®ng. |
|---|
1.6. ├Ø ngh─®a thß╗▒c tiß╗ģn cß╗¦a tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong ─æß╗Øi sß╗æng v├Ā sß║Żn xuß║źt
* T├¼m hiß╗āu c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong ─æß╗Øi sß╗æng v├Ā sß║Żn xuß║źt
- Vß║Łn dß╗źng c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng sß║Į g├│p phß║¦n hiß╗ću quß║Ż v├Āo phß╗źc vß╗ź ─æß╗Øi sß╗æng, sß║Żn xuß║źt, th├║c ─æß║®y qu├Ī tr├¼nh diß╗ģn ra nhanh hŲĪn hoß║Ęc hß║Īn chß║┐ tß╗æc ─æß╗Ö cß╗¦a phß║Żn ß╗®ng, nhß║▒m tß╗æi Ų░u ho├Ī gi├Ī trß╗ŗ kinh tß║┐.

(a) D├╣ng b├¼nh chß╗®a oxygen thay cho d├╣ng kh├┤ng kh├Ł ─æß╗ā ─æß╗æt ch├Īy acetylene, ß╗®ng dß╗źng trong ─æ├©n x├¼ acetylene.

(b) Thß╗▒c phß║®m nß║źu trong nß╗Ģi ├Īp suß║źt sß║Į nhanh ch├Łn hŲĪn so vß╗øi khi nß║źu ß╗¤ ├Īp suß║źt thŲ░ß╗Øng.

(c) Khi ─æß╗æt than trong l├▓, ─æß║Ły nß║»p l├▓ sß║Į giß╗» than ch├Īy ─æŲ░ß╗Żc l├óu hŲĪn

(d) Bß║Żo quß║Żn thß╗®c ─ān trong tß╗¦ lß║Īnh ─æß╗ā thß╗®c ─ān l├óu bß╗ŗ ├┤i thiu
H├¼nh 16.9. ├Ø ngh─®a thß╗▒c tiß╗ģn cß╗¦a tß╗æc ─æß╗Ö phß║Żn ß╗®ng trong ─æß╗Øi sß╗æng v├Ā sß║Żn xuß║źt
| Kiß╗ām so├Īt tß╗æc ─æß╗Ö c├Īc phß║Żn ß╗®ng diß╗ģn ra trong ─æß╗Øi sß╗æng, sß║Żn xuß║źt khi vß║Łn dß╗źng c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng nhŲ░: nß╗ōng ─æß╗Ö, nhiß╗ćt ─æß╗Ö, ├Īp suß║źt, bß╗ü mß║Ęt tiß║┐p x├║c v├Ā chß║źt x├║c t├Īc gi├║p mang lß║Īi c├Īc gi├Ī trß╗ŗ hiß╗ću quß║Ż. |
|---|
B├Āi tß║Łp minh hß╗Źa
B├Āi 1: Thß╗▒c phß║®m bß║Żo quß║Żn trong tß╗¦ lß║Īnh sß║Į giß╗» ─æŲ░ß╗Żc l├óu hŲĪn (a), khi nß║źu mß╗Öt loß║Īi thß╗▒c phß║®m bß║▒ng nß╗ōi ├Īp suß║źt sß║Į nhanh ch├Łn hŲĪn (b), bß╗ćnh nh├ón sß║Į dß╗ģ h├┤ hß║źp hŲĪn khi d├╣ng oxygen tß╗½ b├¼nh chß╗®a kh├Ł oxygen so vß╗øi tß╗½ kh├┤ng kh├Ł(c),ŌĆ”
.jpg)
a) b) c)
Nhß╗»ng yß║┐u tß╗æ n├Āo ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö cß╗¦a c├Īc qu├Ī tr├¼nh biß║┐n ─æß╗Ģi tr├¬n?
HŲ░ß╗øng dß║½n giß║Żi
(a) ß║ónh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö
(b) ß║ónh hŲ░ß╗¤ng cß╗¦a ├Īp suß║źt
(c) ß║ónh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö
B├Āi 2: T├¼m mß╗Öt sß╗æ th├Ł dß╗ź cho mß╗Śi loß║Īi phß║Żn ß╗®ng nhanh v├Ā chß║Łm m├Ā em quan s├Īt ─æŲ░ß╗Żc trong cuß╗Öc sß╗æng v├Ā trong ph├▓ng th├Ł nghiß╗ćm.
HŲ░ß╗øng dß║½n giß║Żi
C├Īc v├Ł dß╗ź vß╗ü loß║Īi phß║Żn ß╗®ng:
ŌĆō Phß║Żn ß╗®ng nhanh: phß║Żn ß╗®ng nß╗Ģ, sß╗▒ ─æß╗æt ch├Īy c├Īc nhi├¬n liß╗ću (than, dß║¦u, kh├Ł ─æß╗æt,ŌĆ”) phß║Żn ß╗®ng giß╗»a hai dung dß╗ŗch AgNO3 v├Ā NaCl,ŌĆ”
ŌĆō Phß║Żn ß╗®ng chß║Łm: sß╗▒ gß╗ē sß║»t, sß╗▒ l├¬n men rŲ░ß╗Żu,ŌĆ”
B├Āi 3: Cho phß║Żn ß╗®ng h├│a hß╗Źc: 2NO(k) + O2(k) ŌåÆ 2NO2(k)
Tß╗æc ─æß╗Ö phß║Żn ß╗®ng h├│a hß╗Źc tr├¬n ─æŲ░ß╗Żc t├Łnh theo c├┤ng thß╗®c y = k [NO]2[O2]. Hß╗Åi ß╗¤ nhiß╗ćt ─æß╗Ö kh├┤ng ─æß╗Ģi, ├Īp suß║źt chung cß╗¦a hß╗ć ─æ├Ż t─āng bao nhi├¬u lß║¦n khi tß╗æc ─æß╗Ö cß╗¦a phß║Żn ß╗®ng t─āng 64 lß║¦n?
HŲ░ß╗øng dß║½n giß║Żi
─Éß║Ęt x l├Ā sß╗æ lß║¦n t─āng cß╗¦a ├Īp suß║źt. Theo b├Āi ra ta c├│ v2/v1 = 64 = x3 ŌåÆ x = 4.
B├Āi 4: H├Ży cho biß║┐t c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng nhŲ░ thß║┐ n├Āo? Giß║Żi th├Łch.
HŲ░ß╗øng dß║½n giß║Żi
C├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng ─æß║┐n tß╗æc ─æß╗Ö phß║Żn ß╗®ng.
a) ß║ónh hŲ░ß╗¤ng cß╗¦a nß╗ōng ─æß╗Ö: Khi t─āng nß╗ōng ─æß╗Ö chß║źt phß║Żn ß╗®ng, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng. Giß║Żi th├Łch: ─Éiß╗üu kiß╗ćn ─æß╗ā c├Īc chß║źt phß║Żn ß╗®ng vß╗øi nhau l├Ā ch├║ng phß║Żi va chß║Īm v├Āo nhau, tß║¦n sß╗æ va chß║Īm c├Āng lß╗øn th├¼ tß╗æc ─æß╗Ö phß║Żn ß╗®ng c├Āng lß╗øn. Khi nß╗ōng ─æß╗Ö c├Īc chß║źt phß║Żn ß╗®ng t─āng, tß║¦n sß╗æ va chß║Īm t─āng n├¬n tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
b) ß║ónh hŲ░ß╗¤ng cß╗¦a ├Īp suß║źt: ─Éß╗æi vß╗øi phß║Żn ß╗®ng c├│ chß║źt kh├Ł, khi t─āng ├Īp suß║źt, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
Giß║Żi th├Łch: Khi ├Īp suß║źt t─āng, nß╗ōng ─æß╗Ö c├Īc chß║źt kh├Ł t─āng tß║¦n sß╗æ va chß║Īm t─āng n├¬n tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
c) ß║ónh hŲ░ß╗¤ng cß╗¦a nhiß╗ćt ─æß╗Ö: Khi t─āng nhiß╗ćt ─æß╗Ö, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
Giß║Żi th├Łch: Khi nhiß╗ćt ─æß╗Ö t─āng dß║¦n ─æß║┐n hai hß╗ć quß║Ż sau:
ŌĆō Tß╗æc ─æß╗Ö chuyß╗ān ─æß╗Öng cß╗¦a c├Īc ph├ón tß╗Ł t─āng, dß║½n ─æß║┐n tß║¦n sß╗æ va chß║Īm giß╗»a c├Īc ph├ón tß╗Ł chß║źt phß║Żn ß╗®ng t─āng.
ŌĆō Tß║¦n sß╗æ va chß║Īm c├│ hiß╗ću quß║Ż giß╗»a c├Īc ph├ón tß╗Ł chß║źt phß║Żn ß╗®ng t─āng nhanh.
d) ├ünh hŲ░ß╗¤ng cß╗¦a diß╗ćn t├Łch bß╗ü mß║Ęt: Khi t─āng diß╗ćn t├Łch bß╗ü mß║Ęt chß║źt phß║Żn ß╗®ng, tß╗æc ─æß╗Ö phß║Żn ß╗®ng t─āng.
Giß║Żi th├Łch: Chß║źt rß║»n vß╗øi k├Łch thŲ░ß╗øc hß║Īt nhß╗Å, c├│ tß╗Ģng diß╗ćn t├Łch bß╗ü mß║Ęt tiß║┐p x├║c vß╗øi chß║źt phß║Żn ß╗®ng lß╗øn hŲĪn so vß╗øi chß║źt rß║»n c├│ k├Łch thŲ░ß╗øc lß╗øn hŲĪn v├Ā c├╣ng khß╗æi lŲ░ß╗Żng, n├¬n tß╗æc ─æß╗Ö phß║Żn ß╗®ng lß╗øn hŲĪn.
e) ß║ónh hŲ░ß╗¤ng cß╗¦a chß║źt x├║c t├Īc: Chß║źt x├║c t├Īc l├Ā chß║źt l├Ām t─āng tß╗æc ─æß╗Ö phß║Żn ß╗®ng, nhŲ░ng c├▓n lß║Īi sau khi phß║Żn ß╗®ng kß║┐t th├║c.
Giß║Żi th├Łch: Chß║źt x├║c t├Īc l├Ām yß║┐u li├¬n kß║┐t giß╗»a c├Īc nguy├¬n tß╗Ł cß╗¦a ph├ón tß╗Ł tham gia phß║Żn ß╗®ng l├Ām biß║┐n ─æß╗Ģi cŲĪ chß║┐ phß║Żn ß╗®ng n├¬n l├Ām t─āng tß╗æc ─æß╗Ö phß║Żn ß╗®ng.
Luyß╗ćn tß║Łp B├Āi 16 H├│a 10 CTST
Sau b├Āi hß╗Źc n├Āy, hß╗Źc sinh sß║Į:
- Thß╗▒c hiß╗ćn ─æŲ░ß╗Żc mß╗Öt sß╗æ th├Ł nghiß╗ćm nghi├¬n cß╗®u c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng tß╗øi tß╗æc ─æß╗Ö phß║Żn ß╗®ng.
- Giß║Żi th├Łch ─æŲ░ß╗Żc c├Īc yß║┐u tß╗æ ß║Żnh hŲ░ß╗¤ng tß╗øi tß╗æc ─æß╗Ö phß║Żn ß╗®ng nhŲ░: nß╗ōng ─æß╗Ö, nhiß╗ćt ─æß╗Ö, ├Īp suß║źt, diß╗ćn t├Łch bß╗ü mß║Ęt, chß║źt x├║c t├Īc.
- N├¬u ─æŲ░ß╗Żc ├Į ngh─®a cß╗¦a hß╗ć sß╗æ nhiß╗ćt ─æß╗Ö Vant Hoff (Y).
- Vß║Łn dß╗źng ─æŲ░ß╗Żc kiß║┐n thß╗®c tß╗æc ─æß╗Ö phß║Żn ß╗®ng ho├Ī hß╗Źc v├Āo viß╗ćc giß║Żi th├Łch mß╗Öt sß╗æ vß║źn ─æß╗ü trong cuß╗Öc sß╗æng v├Ā sß║Żn xuß║źt.
3.1. Trß║»c nghiß╗ćm B├Āi 16 H├│a 10 CTST
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 16 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. T├┤╠üc ─æ├┤╠Ż pha╠ēn Ų░╠üng t─āng l├¬n 256 l├ó╠Ćn khi nhi├¬╠Żt ─æ├┤╠Ż t─āng tŲ░╠Ć 200C l├¬n 500C
- B. T├┤╠üc ─æ├┤╠Ż pha╠ēn Ų░╠üng t─āng l├¬n 243 l├ó╠Ćn khi nhi├¬╠Żt ─æ├┤╠Ż t─āng tŲ░╠Ć 200C l├¬n 500C.
- C. T├┤╠üc ─æ├┤╠Ż pha╠ēn Ų░╠üng t─āng l├¬n 27 l├ó╠Ćn khi nhi├¬╠Żt ─æ├┤╠Ż t─āng tŲ░╠Ć 200C l├¬n 500C.
- D. T├┤╠üc ─æ├┤╠Ż pha╠ēn Ų░╠üng t─āng l├¬n 81 l├ó╠Ćn khi nhi├¬╠Żt ─æ├┤╠Ż t─āng tŲ░╠Ć 200C l├¬n 500C.
-
- A. 60 s
- B. 34,64 s
- C. 20 s
- D. 40 s
-
- A. 40oC
- B. 50oC
- C. 60oC
- D. 70oC
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 16 H├│a 10 CTST
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 16 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Giß║Żi c├óu hß╗Åi 1 trang 98 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 2 trang 99 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 99 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 3 trang 99 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 4 trang 100 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 100 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 5 trang 101 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 101 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 6 trang 101 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 7 trang 101 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 8 trang 102 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 102 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 9 trang 102 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Luyß╗ćn tß║Łp trang 103 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi c├óu hß╗Åi 10 trang 103 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Vß║Łn dß╗źng trang 104 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 1 trang 104 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 2 trang 104 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 3 trang 104 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 4 trang 104 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.1 trang 67 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.2 trang 67 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.3 trang 67 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.4 trang 67 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.5 trang 67 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.6 trang 68 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.7 trang 68 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.8 trang 68 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.9 trang 68 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.10 trang 69 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.11 trang 69 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.12 trang 69 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.13 trang 70 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.14 trang 70 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.15 trang 70 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.16 trang 71 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi b├Āi 16.17 trang 72 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Hß╗Åi ─æ├Īp B├Āi 16 H├│a hß╗Źc 10 CTST
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!







