Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng môn Hóa học 10 chương trình SGK Chân trời sáng tạo được HOC247 biên soạn và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo!
Tóm tắt lý thuyết
1.1. Tốc độ phản ứng
a. Trình bày khái niệm tốc độ phản ứng hoá học
- Khái niệm tốc độ phản ứng hoá học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
- Theo thời gian, nồng độ các chất phản ứng và sản phẩm thay đổi nên tốc độ phản ứng sẽ thay đổi, vì vậy người ta thường tính tốc độ trung bình của phản ứng. Ngoài ra, còn có tốc độ tức thời của phản ứng, là tốc độ phản ứng tại một thời điểm nào đó.
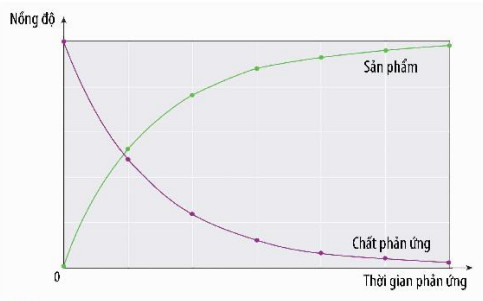
Hình 15.1. Đồ thị biểu diễn sự thay đổi nồng độ chất phản ứng nồng độ của chất phản ứng và (màu tím) và sản phẩm (màu xanh) theo thời gian
b. Tính tốc độ trung bình của phản ứng hoá học
Ví dụ 1: Trong phản ứng hoá học: Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,8 M về còn 0,6 M. Tính tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây.
Hướng dẫn:
Thời gian phản ứng: \(\Delta \)t = 40 (s)
Biến thiên nồng độ dung dịch HCl là \(\Delta \)C = 0,6 – 0,8 = -0,2 (M)
Hệ số cân bằng của HCl trong phương trình hóa học là 2.
|
Tốc độ trung bình của phản ứng trong 40 giây là: \(\overline v = - \frac{1}{2}.\frac{{ - 0,2}}{{40}} = 2,{5.10^{ - 3}}(M/s)\) - Tốc độ phản ứng của phản ứng hoá học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian. Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian) - Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng. - Cho phản ứng tổng quát: aA + bB → bC + dD Biểu thức tốc độ trung bình của phản ứng: \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: \(\overline v \) : tốc độ trung bình của phản ứng \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ \(\Delta t = {t_2} - {t_1}\): biến thiên thời gian C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2 |
|---|
1.2. Biểu thức tốc độ phản ứng
* Tìm hiểu về định luật tác dụng khối lượng
- Các phản ứng diễn ra với tốc độ khác nhau tùy thuộc vào nhiều yếu tố: nồng độ, nhiệt độ, áp suất đối với chất tham gia là chất khí, bề mặt tiếp xúc, chất xúc tác, cường độ ánh sáng, thể của chất, dung môi hoà tan các chất phản ứng, ...
- Năm 1864, hai nhà bác học Guldberg (Gấu-bớc) và Waage (Qua-ge) khi nghiên cứu sự phụ thuộc của tốc độ vào nồng độ đã đưa ra định luật tác dụng khối lượng: Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
Ví dụ 2: Xét phản ứng
2CO(g) + O2(g) → 2CO2(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật là:
\(v = k.C_{CO}^2.{C_{{O_2}}}\)
|
- Phản ứng đơn giản có dạng: aA+ bB →cC + dD - Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hoá học được biểu diễn bằng biểu thức: \(v = k.C_A^a.C_B^b\) - Trong đó, k là hằng số tốc độ phản ứng; CA, CB là nồng độ (M) chất A, B tại thời điểm đang xét. - Khi nồng độ chất phản ứng bằng đơn vị (1 M) thì k = v, vậy k là tốc độ của phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng. - Hằng số k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ. |
|---|
Bài tập minh họa
Bài 1: Trong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm,… nhưng cũng có những phản ứng xảy ra chậm hơn, như quá trình oxi hóa các kim loại sắt, đồng trong khí quyển, sự ăn mòn vỏ tàu biển làm bằng thép,… Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học cần dùng đại lượng nào? Cách tính ra sao?


Đám cháy của lá cây khô Thân tàu biển bị oxi hoá trong điều kiện tự nhiên
Hướng dẫn giải
- Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học, người ta dùng đại lượng: tốc độ phản ứng
- Cách tính: Cho phản ứng tổng quát:
aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
\(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
Trong đó:
\(\mathop v\limits^\_ \): tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2
Bài 2. Tốc độ của phản ứng tăng bao nhiêu lần nếu tăng nhiệt độ từ 200oC đến 240oC, biết rằng khi tăng 10oC thì tốc độ phản ứng tăng 2 lần.
Hướng dẫn giải
Gọi V200 là tốc độ phản ứng ở 200oC
Ta có: V210= 2.V200
V220= 2V210=4V200
V230=2V220=8V200
V240=2V230=16V200
Vậy tốc độ phản ứng tăng lên 16 lần
Bài 3. Cho phản ứng: A+ 2B → C
Nồng độ ban đầu các chất: [A] = 0,3M; [B] = 0,5M. Hằng số tốc độ k = 0,4
a) Tính tốc độ phản ứng lúc ban đầu.
b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/l.
Hướng dẫn giải
a) Tốc độ ban đầu:
Vban đầu = k.[A].[B]2= 0,4.[0,3].[0,5] 2 =0,3 mol/ls
b) Tốc độ tại thời điểm t
Khi nồng độ A giảm 0,1 mol/lít thì B giảm 0,2 mol/l theo phản ứng tỉ lệ 1 : 2
Nồng độ tại thời điểm t:
[A’] = 0,3 – 0,1 =0,2 (mol/l)
[B’]=0,5 -0,2 =0,3 (mol/l)
V= k.[A’].[B’] 2= 0,4.[0,2].[0,3] 2=0,0072 mol/ls
Luyện tập Bài 15 Hóa 10 CTST
Sau bài học này, học sinh sẽ:
- Trình bày được khái niệm tốc độ phản ứng hoá học và cách tính tốc độ trung bình của phản ứng.
- Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ cho phản ứng đơn giản. Nêu được ý nghĩa hằng số tốc độ phản ứng.
3.1. Trắc nghiệm Bài 15 Hóa 10 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Chân trời sáng tạo Bài 15 cực hay có đáp án và lời giải chi tiết.
-
- A. 0,02
- B. 0,098
- C. 0,034
- D. 0,042
-
- A. 0,16 mol/l.phút
- B. 0,016 mol/l.phút
- C. 1,6 mol/l.phút
- D. 0,106 mol/l.phút
-
- A. Toả nhiệt
- B. Thu nhiệt
- C. Không toả hay thu nhiệt
- D. Một phương án khác
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 15 Hóa 10 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 15 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 94 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 2 trang 95 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 3 trang 95 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 95 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 4 trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 5 trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 1 trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 2 trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 3 trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 4 trang 96 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.1 trang 63 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.2 trang 63 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.3 trang 63 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.4 trang 64 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.5 trang 64 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.6 trang 64 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.7 trang 64 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.8 trang 64 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.9 trang 65 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.10 trang 65 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.11 trang 65 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.12 trang 65 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.13 trang 66 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 15.14 trang 66 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hỏi đáp Bài 15 Hóa học 10 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







