HŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo B├Āi 15 B├Āi 15: PhŲ░ŲĪng tr├¼nh tß╗æc ─æß╗Ö phß║Żn ß╗®ng v├Ā hß║▒ng sß╗æ tß╗æc ─æß╗Ö phß║Żn ß╗®ng m├┤n H├│a hß╗Źc lß╗øp 10 CTST gi├║p c├Īc em hß╗Źc sinh nß║»m vß╗»ng phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp v├Ā ├┤n luyß╗ćn tß╗æt kiß║┐n thß╗®c.
-
Giß║Żi c├óu hß╗Åi 1 trang 94 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Quan s├Īt h├¼nh trong phß║¦n Khß╗¤i ─æß╗Öng, nhß║Łn x├®t vß╗ü mß╗®c ─æß╗Ö nhanh hay chß║Łm cß╗¦a phß║Żn ß╗®ng h├│a hß╗Źc xß║Ży ra trong ─æ├Īm ch├Īy l├Ī c├óy kh├┤ v├Ā th├ón t├Āu biß╗ān bß╗ŗ oxi h├│a trong ─æiß╗üu kiß╗ćn tß╗▒ nhi├¬n

-
Giß║Żi c├óu hß╗Åi 2 trang 95 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Trong tß╗▒ nhi├¬n v├Ā cuß╗Öc sß╗æng, ß╗¤ c├╣ng ─æiß╗üu kiß╗ćn, nhiß╗üu chß║źt kh├Īc nhau sß║Į biß║┐n ─æß╗Ģi h├│a hß╗Źc nhanh, chß║Łm kh├Īc nhau; vß╗øi c├╣ng mß╗Öt chß║źt, trong ─æiß╗üu kiß╗ćn kh├Īc nhau c┼®ng biß║┐n ─æß╗Ģi h├│a hß╗Źc nhanh, chß║Łm kh├Īc nhau. T├¼m c├Īc v├Ł dß╗ź minh hß╗Źa cho 2 nhß║Łn ─æß╗ŗnh tr├¬n
-
Giß║Żi c├óu hß╗Åi 3 trang 95 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Quan s├Īt H├¼nh 15.1, cho biß║┐t nß╗ōng ─æß╗Ö cß╗¦a chß║źt phß║Żn ß╗®ng v├Ā sß║Żn phß║®m thay ─æß╗Ģi nhŲ░ thß║┐ n├Āo theo thß╗Øi gian
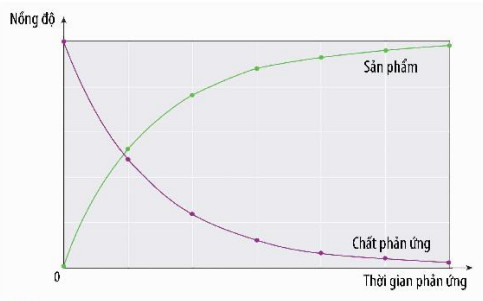
H├¼nh 15.1. ─Éß╗ō thß╗ŗ biß╗āu diß╗ģn sß╗▒ thay ─æß╗Ģi nß╗ōng ─æß╗Ö chß║źt phß║Żn ß╗®ng nß╗ōng ─æß╗Ö cß╗¦a chß║źt phß║Żn ß╗®ng v├Ā (m├Āu t├Łm) v├Ā sß║Żn phß║®m (m├Āu xanh) theo thß╗Øi gian
-
Luyß╗ćn tß║Łp trang 95 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
X├®t phß║Żn ß╗®ng ph├ón hß╗¦y N2O5 ß╗¤ 45oC
N2O5(g) ŌåÆ N2O4(g) + ┬Į O2(g)
Sau 184 gi├óy ─æß║¦u ti├¬n, nß╗ōng ─æß╗Ö cß╗¦a N2O4 l├Ā 0,25M. T├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng theo N2O4 trong khoß║Żng thß╗Øi gian tr├¬n
-
Giß║Żi c├óu hß╗Åi 4 trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Theo ─æß╗ŗnh luß║Łt t├Īc dß╗źng khß╗æi lŲ░ß╗Żng, tß╗æc ─æß╗Ö phß║Żn ß╗®ng thay ─æß╗Ģi nhŲ░ thß║┐ n├Āo khi t─āng hoß║Ęc giß║Żm nß╗ōng ─æß╗Ö chß║źt phß║Żn ß╗®ng.
-
Giß║Żi c├óu hß╗Åi 5 trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Trong tß╗▒ nhi├¬n v├Ā cuß╗Öc sß╗æng, c├│ nhiß╗üu phß║Żn ß╗®ng h├│a hß╗Źc xß║Ży ra vß╗øi tß╗æc ─æß╗Ö kh├Īc nhau phß╗ź thuß╗Öc v├Āo nß╗ōng ─æß╗Ö chß║źt phß║Żn ß╗®ng, t├¼m c├Īc v├Ł dß╗ź minh hß╗Źa
-
Luyß╗ćn tß║Łp trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho phß║Żn ß╗®ng ─æŲĪn giß║Żn sau:
H2(g) + Cl2(g) ŌåÆ 2HCl(g)
a) Viß║┐t biß╗āu thß╗®c tß╗æc ─æß╗Ö tß╗®c thß╗Øi cß╗¦a phß║Żn ß╗®ng tr├¬n
b) Tß╗æc ─æß╗Ö phß║Żn ß╗®ng thay ─æß╗Ģi thß║┐ n├Āo khi nß╗ōng ─æß╗Ö H2 giß║Żm 2 lß║¦n v├Ā giß╗» nguy├¬n nß╗ōng ─æß╗Ö Cl2?
-
Vß║Łn dß╗źng trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
DŲ░ß╗øi ─æ├óy l├Ā mß╗Öt sß╗æ hiß╗ćn tŲ░ß╗Żng xß║Ży ra trong ─æß╗Øi sß╗æng, h├Ży sß║»p xß║┐p theo thß╗® tß╗▒ tß╗æc ─æß╗Ö giß║Żm dß║¦n:
NŲ░ß╗øng b├Īnh m├¼ (1)
─Éß╗æt gas khi nß║źu ─ān (2)
L├¬n men sß╗»a tß║Īo ra sß╗»a chua (3)
Tß║źm t├┤n thiß║┐c bß╗ŗ gß╗ē s├®t (4)
-
Giß║Żi b├Āi 1 trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho phß║Żn ß╗®ng ─æŲĪn giß║Żn xß║Ży ra trong b├¼nh k├Łn: 2NO(g) + O2(g) ŌåÆ 2NO2(g)
a) Viß║┐t biß╗āu thß╗®c tß╗æc ─æß╗Ö tß╗®c thß╗Øi cß╗¦a phß║Żn ß╗®ng
b) ß╗× nhiß╗ćt ─æß╗Ö kh├┤ng ─æß╗Ģi, tß╗æc ─æß╗Ö phß║Żn ß╗®ng thay ─æß╗Ģi thß║┐ n├Āo khi
- nß╗ōng ─æß╗Ö O2 t─āng 3 lß║¦n, nß╗ōng ─æß╗Ö NO kh├┤ng ─æß╗Ģi?
- nß╗ōng ─æß╗Ö NO t─āng 3 lß║¦n, nß╗ōng ─æß╗Ö O2 kh├┤ng ─æß╗Ģi?
- nß╗ōng ─æß╗Ö NO v├Ā O2 ─æß╗üu t─āng 3 lß║¦n?
-
Giß║Żi b├Āi 2 trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Giß║Żi th├Łch tß║Īi sao tß╗æc ─æß╗Ö ti├¬u hao cß╗¦a NO (M/s) v├Ā tß╗æc ─æß╗Ö tß║Īo th├Ānh cß╗¦a N2 (M/s) kh├┤ng giß╗æng nhau trong phß║Żn ß╗®ng:
2CO(g) + 2NO(g) ŌåÆ 2CO2(g) + N2(g)
-
Giß║Żi b├Āi 3 trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho phß║Żn ß╗®ng:
2N2O5(g) ŌåÆ 4NO2(g) + O2(g)
Sau thß╗Øi gian tß╗½ gi├óy 61 ─æß║┐n gi├óy 120, nß╗ōng ─æß╗Ö NO2 t─āng tß╗½ 0,30M l├¬n 0,40M. T├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng
-
Giß║Żi b├Āi 4 trang 96 SGK H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Dß╗» liß╗ću th├Ł nghiß╗ćm cß╗¦a phß║Żn ß╗®ng: SO2Cl2(g) ŌåÆ SO2(g) + Cl2(g) ─æŲ░ß╗Żc tr├¼nh b├Āy ß╗¤ bß║Żng sau:
.jpg)
a) T├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng theo SO2Cl2 trong thß╗Øi gian 100 ph├║t.
b) Sau 100 ph├║t, nß╗ōng ─æß╗Ö cß╗¦a SO2Cl2 c├▓n lß║Īi l├Ā bao nhi├¬u
c) Sau 200 ph├║t, nß╗ōng ─æß╗Ö cß╗¦a SO2 v├Ā Cl2 thu ─æŲ░ß╗Żc l├Ā bao nhi├¬u?
-
Giß║Żi b├Āi 15.1 trang 63 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc:
2KMnO4(aq) + 10FeSO4(aq) + 8H2SO4(aq)
-> 5Fe2(SO4)3(aq) + K2SO4(aq) + 2MnSO4(aq) + 8H2O(l)
Vß╗øi c├╣ng mß╗Öt lŲ░ß╗Żng c├Īc chß║źt tham gia phß║Żn ß╗®ng, chß║źt phß║Żn ß╗®ng hß║┐t nhanh nhß║źt l├Ā:
A. KMnO4.
B. FeSO4.
C. H2SO4.
D. Cß║Ż 3 chß║źt hß║┐t c├╣ng l├║c.
-
Giß║Żi b├Āi 15.2 trang 63 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
─Éß╗æi vß╗øi phß║Żn ß╗®ng: A + 3B ŌåÆ 2C, ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. Tß╗æc ─æß╗Ö ti├¬u hao chß║źt B bß║▒ng 3/2 tß╗æc ─æß╗Ö tß║Īo th├Ānh chß║źt C.
B. Tß╗æc ─æß╗Ö ti├¬u hao chß║źt B bß║▒ng 2/3 tß╗æc ─æß╗Ö tß║Īo th├Ānh chß║źt C.
C. Tß╗æc ─æß╗Ö ti├¬u hao chß║źt B bß║▒ng 3 tß╗æc ─æß╗Ö tß║Īo th├Ānh chß║źt C.
D. Tß╗æc ─æß╗Ö ti├¬u hao chß║źt B bß║▒ng 1/3 tß╗æc ─æß╗Ö tß║Īo th├Ānh chß║źt C.
-
Giß║Żi b├Āi 15.3 trang 63 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
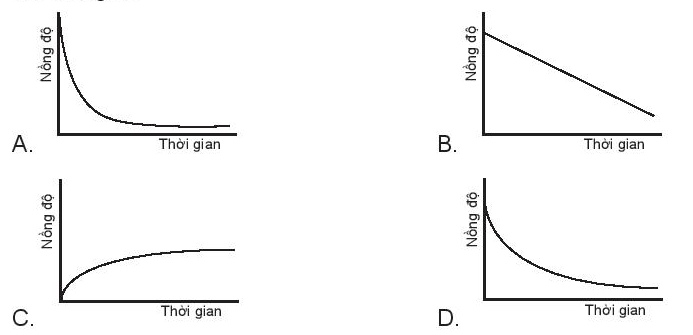
Biß╗āu ─æß╗ō n├Āo sau ─æ├óy kh├┤ng biß╗āu diß╗ģn sß╗▒ phß╗ź thuß╗Öc nß╗ōng ─æß╗Ö chß║źt tham gia vß╗øi thß╗Øi gian
-
Giß║Żi b├Āi 15.4 trang 64 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
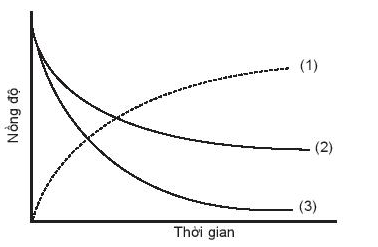
─Éß╗ō thß╗ŗ biß╗āu diß╗ģn ─æŲ░ß╗Øng cong ─æß╗Öng hß╗Źc cß╗¦a phß║Żn ß╗®ng giß╗»a oxygen v├Ā hydrogen tß║Īo th├Ānh nŲ░ß╗øc, O2(g) + 2H2(g) ŌåÆ 2H2O(g). ─ÉŲ░ß╗Øng cong n├Āo cß╗¦a hydrogen?
A. ─ÉŲ░ß╗Øng cong sß╗æ (1).
B. ─ÉŲ░ß╗Øng cong sß╗æ (2).
C. ─ÉŲ░ß╗Øng cong sß╗æ (3).
D. ─ÉŲ░ß╗Øng cong sß╗æ (2) hoß║Ęc (3) ─æß╗üu ─æ├║ng.
-
Giß║Żi b├Āi 15.5 trang 64 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
PhŲ░ŲĪng tr├¼nh tß╗Ģng hß╗Żp ammonia (NH3), N2(g) + 3H2(g) ŌåÆ 2NH3(g). Nß║┐u tß╗æc ─æß╗Ö tß║Īo th├Ānh NH3 l├Ā 0,345 M/s th├¼ tß╗æc ─æß╗Ö cß╗¦a chß║źt phß║Żn ß╗®ng H2 l├Ā
A. 0,345 M/s.
B. 0,690 M/s.
C. 0,173 M/s.
D. 0,518 M/s.
-
Giß║Żi b├Āi 15.6 trang 64 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
PhŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng: CHCl3(g) + Cl2(g) ŌåÆ CCl4(g) + HCl(g). Khi nß╗ōng ─æß╗Ö cß╗¦a CHCl3 giß║Żm 4 lß║¦n, nß╗ōng ─æß╗Ö Cl2 giß╗» nguy├¬n th├¼ tß╗æc ─æß╗Ö phß║Żn ß╗®ng sß║Į
A. t─āng gß║źp ─æ├┤i
B. giß║Żm mß╗Öt nß╗Ła.
C. t─āng 4 lß║¦n.
D. giß║Żm 4 lß║¦n.
-
Giß║Żi b├Āi 15.7 trang 64 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng:
CO(g) + H2O(g) ŌåÆ CO2(g) + H2(g)
Viß║┐t biß╗āu thß╗®c tß╗æc ─æß╗Ö cß╗¦a phß║Żn ß╗®ng tr├¬n. Khi nß╗ōng ─æß╗Ö CO t─āng 2 lß║¦n, lŲ░ß╗Żng hŲĪi nŲ░ß╗øc kh├┤ng thay ─æß╗Ģi, tß╗æc ─æß╗Ö phß║Żn ß╗®ng thay ─æß╗Ģi nhŲ░ thß║┐ n├Āo?
-
Giß║Żi b├Āi 15.8 trang 64 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Tß╗½ dß╗» kiß╗ćn trong V├Ł dß╗ź 1 (SGK trang 95), t├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng theo gi├Ī trß╗ŗ nß╗ōng ─æß╗Ö cß╗¦a MgCl2 trong 40 gi├óy (bß╗Å qua sß╗▒ thay ─æß╗Ģi kh├┤ng ─æ├Īng kß╗ā vß╗ü thß╗ā t├Łch dung dß╗ŗch sau phß║Żn ß╗®ng). So s├Īnh gi├Ī trß╗ŗ tß╗æc ─æß╗Ö phß║Żn ß╗®ng t├Łnh theo HCl vß╗øi t├Łnh theo MgCl2.
-
Giß║Żi b├Āi 15.9 trang 65 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Mß╗Öt sß╗æ phß║Żn ß╗®ng diß╗ģn ra vß╗øi sß╗æ mol chß║źt phß║Żn ß╗®ng cß╗ź thß╗ā theo thß╗Øi gian ─æŲ░ß╗Żc thß╗ā hiß╗ćn trong bß║Żng dŲ░ß╗øi ─æ├óy.
Phß║Żn ß╗®ng
LŲ░ß╗Żng chß║źt phß║Żn ß╗®ng (mol)
Thß╗Øi gian (s)
Tß╗æc ─æß╗Ö phß║Żn ß╗®ng (mol/s)
1
2
30
?
2
5
120
?
3
1
90
?
4
3,2
90
?
5
5,9
30
?
a) T├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a mß╗Śi phß║Żn ß╗®ng
b) Phß║Żn ß╗®ng n├Āo diß╗ģn ra vß╗øi tß╗æc ─æß╗Ö nhanh nhß║źt? Phß║Żn ß╗®ng n├Āo diß╗ģn ra vß╗øi tß╗æc ─æß╗Ö chß║Łm nhß║źt?
-
Giß║Żi b├Āi 15.10 trang 65 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Hai phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra vß╗øi c├╣ng mß╗Öt lŲ░ß╗Żng Cl2 nhŲ░ sau:
Mg(s) + Cl2(g) ŌåÆ MgCl2(s) (1)
2Na(s) + Cl2(g) ŌåÆ 2NaCl(s) (2)
Sau 1 ph├║t, khß╗æi lŲ░ß╗Żng MgCl2 ─æŲ░ß╗Żc tß║Īo ra 2 gam.
a) T├Łnh tß╗æc ─æß╗Ö trung b├¼nh (mol/s) cß╗¦a phß║Żn ß╗®ng (1).
b) Nß║┐u tß╗æc ─æß╗Ö trung b├¼nh xß║Ży ra trong phß║Żn ß╗®ng (2) tŲ░ŲĪng ─æŲ░ŲĪng (1), th├¼ khß╗æi lŲ░ß╗Żng sß║Żn phß║®m NaCl thu ─æŲ░ß╗Żc l├Ā bao nhi├¬u?
-
Giß║Żi b├Āi 15.11 trang 65 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho phß║Żn ß╗®ng tert-butyl chloride (tertŌĆōC4H9Cl) vß╗øi nŲ░ß╗øc:
C4H9Cl(l) + H2O(l) ŌåÆ C4H9OH(aq) + HCl(aq)
T├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng theo tertŌĆōbutyl chloride, vß╗øi nß╗ōng ─æß╗Ö ban ─æß║¦u l├Ā 0,22 M, sau 4s, nß╗ōng ─æß╗Ö c├▓n lß║Īi 0,10 M.
-
Giß║Żi b├Āi 15.12 trang 65 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
X├®t phß║Żn ß╗®ng ho├Ī hß╗Źc ─æŲĪn giß║Żn giß╗»a hai chß║źt A v├Ā B theo phŲ░ŲĪng tr├¼nh: A + B ŌåÆ C. Tß╗½ th├┤ng tin ─æ├Ż cho, ho├Ān th├Ānh bß║Żng dŲ░ß╗øi ─æ├óy:
Thß╗▒c nghiß╗ćm
Nß╗ōng ─æß╗Ö chß║źt A
(M)
Nß╗ōng ─æß╗Ö chß║źt B
(M)
Tß╗æc ─æß╗Ö phß║Żn ß╗®ng
(M/s)
1
0,20
0,050
0,24
2
?
0,030
0,20
3
0,40
?
0,80
-
Giß║Żi b├Āi 15.13 trang 66 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
X├®t phß║Żn ß╗®ng ph├ón huß╗Ę kh├Ł N2O5 xß║Ży ra nhŲ░ sau:
2N2O5(g) ŌåÆ 4NO2(g) + O2(g)
a) Viß║┐t biß╗āu thß╗®c t├Łnh tß╗æc ─æß╗Ö phß║Żn ß╗®ng theo sß╗▒ biß║┐n thi├¬n nß╗ōng ─æß╗Ö cß╗¦a chß║źt tham gia v├Ā sß║Żn phß║®m theo thß╗Øi gian.
b) Sau khoß║Żng thß╗Øi gian t (s), tß╗æc ─æß╗Ö tß║Īo th├Ānh O2 l├Ā 9,0 ├Ś 10-6 (M/s), t├Łnh tß╗æc ─æß╗Ö cß╗¦a c├Īc chß║źt c├▓n lß║Īi trong phß║Żn ß╗®ng.
-
Giß║Żi b├Āi 15.14 trang 66 SBT H├│a hß╗Źc 10 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Sulfuric acid (H2SO4) l├Ā ho├Ī chß║źt quan trß╗Źng trong c├┤ng nghiß╗ćp, ß╗®ng dß╗źng trong sß║Żn xuß║źt ph├ón b├│n, lß╗Źc dß║¦u, xß╗Ł l├Ł nŲ░ß╗øc thß║Żi,... Mß╗Öt giai ─æoß║Īn ─æß╗ā sß║Żn xuß║źt H2SO4 l├Ā phß║Żn ß╗®ng 2SO2(g) + O2(g) ŌåÆ 2SO3(g), kß║┐t quß║Ż thß╗▒c nghiß╗ćm cß╗¦a phß║Żn ß╗®ng cho gi├Ī trß╗ŗ theo bß║Żng:
Thß╗Øi gian (s)
SO2 (M)
O2 (M)
SO3 (M)
300
0,0270
0,0500
0,0072
720
0,0194
0,0462
0,0148
T├Łnh tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng trong khoß║Żng thß╗Øi gian tr├¬n






