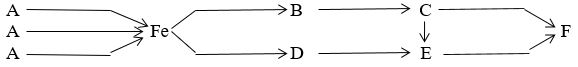Nhằm cung cấp cho các em học sinh có thêm nhiều tài liệu hữu ích để ôn luyện kiến thức thật tốt, HOC247 xin giới thiệu Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Nguyễn Khuyến có đáp án. Tài liệu được tổng hợp với các câu hỏi hay và khó, mời các em cùng tham khảo nội dung chi tiết bên dưới đây.
TRƯỜNG THCS NGUYỄN KHUYẾN
ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC 9
THỜI GIAN: 150 PHÚT
Câu 1: Viết phương trình hóa học biểu diễn sơ đồ chuyển hóa sau:
Biết rằng A + HCl → B + D +H2O
Câu 2:
- Có các lọ đựng riêng rẽ các dung dịch không dán nhãn : NaCl, NaOH, H2SO4 , HCl, Ba(OH)2, MgSO4. Không dùng thêm thuốc thử khác, hãy trình bày cách phân biệt và viết phương trình hóa học minh họa.
- Có hỗn hợp A gồm: MgO, Al2O3 , SiO2 .Làm thế nào để thu được từng chất trong A?
- Nêu hiện tượng và viết phương trình các phản ứng xảy ra khi cho:
- Đinh sắt vào dung dịch CuSO4
- Dây Cu vào dung dịch AgNO3
- Sục khí clo vào ống nghiệm đựng H2O, sau đó nhúng đũa thủy tinh vào ống nghiệm rồi chấm vào quỳ tím.
Câu 3: Hai thanh kim loại giống nhau (đều cùng nguyên tố R hóa trị II) và có cùng khối lượng. Cho thanh thứ nhất vào dung dịch Cu(NO3)2 và thanh thứ hai vào dung dịch Pb(NO3)2 . Sau một thời gian khi số mol hai muối bằng nhau, lấy hai thanh kim loại ra khỏi dung dịch thấy khối lượng thanh thứ nhất giảm 0,2%, còn khối lượng thanh thứ hai tăng 28,4%. Xác dịnh R.
Câu 4: Cho 31,6 gam hỗn hợp B dang bột Mg và Fe tác dụng với 250ml dung dịch CuCl2. Khuấy đều hỗn hợp, lọc, rữa kết tủa, được dung dịch B1 và 3,84 gam chất rắn B2 ( có hai kim loại). Thêm vào B1 một lượng dư dung dịch NaOH loãng rồi lọc, rửa kết tủa mới được tạo thành. Nung kết tủa đó trong không khí ở nhiệt độ cao, được 1,4 gam chất rắn B3 gồm 2 oxit kim loại. Tất cả các phản ứng đều xảy ra hoàn toàn.
- Viết các Phương trình phản ứng hóa học xảy ra.
- Tính thành phần tram theo khối lượng của mỗi kim loại trong B và tính nồng độ mol của dung dịch CuCl2.
Câu 5:
- Dẫn hỗn hợp X gồm metan, etilen, axetilen qua bình chứa:
- Dung dịch brom dư
- Dung dịch axit clohidric dư
- Hãy viết các phương trình hóa học xảy ra.
- Đốt cháy hoàn toàn 0,1 mol một hiđrocacbon A cần dung 0,6 mol khí oxi và sinh ra 0,4 mol khí cacbonđioxit.
- Tìm công thức phân tử hiđrocacbon A.
- Hãy viết 2 công thức cấu tạo khác nhau của hiđrocacbon A.
ĐÁP ÁN
|
Câu hỏi |
Đáp án |
Điểm |
|
Câu 1
|
Fe3O4 + 2C → 3Fe + CO2 Fe3O4 + 4H2 → 3Fe + 4H2O Fe3O4 + 4CO → 3Fe + 4CO2 Fe + 2HCl → FeCl2 + O2 FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl 4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O 2Fe + 3Cl2 → 2FeCl3 FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl 2Fe(OH)3 → Fe2O3 + 3H2O 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 |
(2,5 điểm) 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ |
|
Câu 2 |
1. Bước 1 : Lấy mẫu thử các chất ở từng lọ vào các ống nghiệm và đánh số thứ tự tương ứng với các lọ. Bước 2 : Nhận biết các cặp chất : Ba(OH)2 và MgSO4, H2SO4 và NaOH, là NaCl và HCl Lần lượt cho các dung dịch vào với nhau và thấy : - 2 dung dịch có 2 lần tạo kết tủa, đó là Ba(OH)2 và MgSO4, do có các p.ư : Ba(OH)2 + H2SO4 → BaSO4 + 2H2O (1) Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2 (2) 2NaOH + MgSO4 → Na2SO4 + Mg(OH)2 (3) - 2 dung dịch có 1 lần tạo kết tủa, đó là H2SO4 và NaOH, do có phản ứng (1) và(3). - 2 dung dịch không tạo kết tủa, đó là NaCl và HCl Bước 3 : Nhận biết HCl, NaOH, H2SO4, NaCl : Lấy 2 dung dịch không tạo kết tủa ở trên lần lượt cho vào kết tủa của 2 dung dịch có 1 lần tạo kết tủa. Trường hợp dung dịch cho vào làm tan một kết tủa thì dung dịch cho vào là HCl, dung dịch có 1 lần tạo kết tủa là NaOH , vì : Mg(OH)2 + 2HCl → MgCl2 + 2H2O (4) Dung dịch có 1 lần tạo kết tủa còn lại là H2SO4 (ở đây kết tủa không tan). Dung dịch cho vào không làm tan kết tủa nào là dung dịch NaCl. Bước 4 : Nhận biết Ba(OH)2, MgSO4 : Lấy dung dịch NaOH vừa nhận được ở trên cho vào 2 dung dịch có 2 lần tạo kết tủa. Dung dịch nào không tạo kết tủa với NaOH là dung dịch Ba(OH)2. Dung dịch nào tạo kết tủa với NaOH là dung dịch MgSO4 (có phản ứng theo |
(3 điểm)
Nhận biết đúng mỗi chất được 0,5 điểm
|
|
|
2. Cho hỗn hợp MgO, Al2O3 và SiO qua dung dịch HCl: MgO, Al2O3 tan hết,tạo dung dịch A, lọc lấy chất rắn không tan là SiO2. MgO + 2HCl → MgCl2 + H2O Al2O3 + 6HCl → 2AlCl3 + 3H2O Cho dung dịch A tác dụng với NaOH dư thu được kết tủa B và dung dịch C MgCl2 + 2 NaOH → Mg(OH)2 + 2 NaCl AlCl3 + 3NaOH → Al(OH)3 + 3NaCl Al(OH)3 + NaOH → NaAlO2 + 2H2O Lọc lấy B nung đến khối lượng không đổi thu được MgO Mg(OH)2 → MgO + H2O Sục CO2 vào dung dịch C, lọc lấy kết tủa Al(OH)3 NaOHdư + CO2 → NaHCO3 NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3 Nung kết tủa đến khối lượng không đổi thu được Al2O3 2Al(OH)3 → Al2O3 + 3H2O |
2,5 đ
0,75
0,75
0,25
0,5
0,25 |
|
|
3. Cho đinh sắt vào dung dịch CuSO4: Đinh sắt tan dần có lớp đồng màu đỏ bám ngoài thanh sắt và màu xanh của dung dịch bị nhạt dần. Phản ứng: Fe + CuSO4 → FeSO4 + Cu Cho dây đồng vào dung dịch AgNO3 : Dây đồng tan dần, có lớp bạc màu trắng bám vào dây đồng và dung dịch từ không màu chuyển sang màu xanh. Phản ứng: Cu + AgNO3 → Cu(NO3)2 + 2Ag Khi dẫn khí Clo vào nước thì có phản ứng: Cl2 + H2O → HCl + HClO Khi nhúng đũa thủy tinh vào ống nghiệm rồi chấm vào giấy quì tím thì quì tím hóa đỏ rồi mất màu.
|
2 điểm 0,5
0,5
0,5
0,5 |
|
Câu 3 |
Hóa trị của kim loại R bằng hóa trị Cu, Pb trong muối Nitrat → chúng phản ứng với số mol bằng nhau. Theo đề bài : MR > MCu và MPb > MR Nếu coi khối lượng ban đầu của thanh kim loại là a gam Sau phản ứng: khối lượng thanh kim loại giảm 0,002 a Khối lượng thanh kim loại tăng 0,284 a R + Cu(NO3)2 → R(NO3)2 + Cu x x x Khối lượng thanh kim loại giảm: x.R - 64x = 0,002 a <=> x ( R - 64) = 0,002 a (1) R + Pb(NO3)2 → R(NO3)2 + Pb x x x Khối lượng thanh kim loại tang lên : 207 x - x.R = 0,284 a <=> x (207 - R) = 0,284 a (2) Từ (1) và (2) ta được:
=> R= 65 (vậy thanh kim loại là Zn) |
2,5 điểm 0,25 0,25 0,25 0,25 0,25
0,25 0,25
0,25
0,25 0,25 |
|
Câu 4 |
Gọi x, y là số mol của Mg và Fe trong B; số mol Fe ban đầu : a (mol) Mg + CuCl2 → MgCl2 + Cu x x x x (mol) Fe + CuCl2 → FeCl2 + Cu a a a a (mol) Dung dịch B1 : MgCl2 và FeCl2 Chất rắn B2 : Cu và Fe dư
MgCl2 + 2NaOH → Mg(OH)2 + NaCl x x FeCl2 + 2NaOH → Fe(OH)2 + NaCl a a
x x 2Fe(OH)2 + 1/2O2 → Fe2O3 + 2H2O a 0,5 a Theo đề bài ta có hệ phương trình : 24x + 56y = 3,16 (1) 64(x + a) + 56(y- a)= 3,84 (2) 40x + 160 . 0,5a = 1,4 (3) Giải hệ (1), (2) và (3), ta được x= 0,015; y=0,05; a= 0,01 Vậy : %m Mg = (24. 0,015).100 : 3,16 = 11,39% % mFe = 88,61% → nCuCl2 = x + a = 0,01 + 0,01 = 0,025( mol) Vậy CM( CuCl2) = 0,025: 0,25 = 0,1 M |
(4,5 điểm) 0,25 0,25
0,25
0,25 0,25 0,25 0,25
0,25
0,25
0,25
0,75
0,75 0,25 0,25 0,25 0,25 |
---Để xem đầy đủ nội dung và đáp án của đề thi các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Nguyễn Khuyến có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT huyện Bù Gia Mập có đáp án
- Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT Bù Đăng có đáp án
Chúc các em học tốt!