Để giúp các em học sinh có thêm tài liệu học tập, rèn luyện kĩ năng làm đề, kết hợp củng cố kiến thức chuẩn bị bước vào kì thi HK2 lớp 10 sắp tới. HOC247 xin giới thiệu Đề thi HK2 môn Hoá 10 KNTT năm 2022 - 2023 trường THPT Bùi Thị Xuân có đáp án. Mời các em cùng quý thầy cô tham khảo đề thi dưới đây. Chúc các em có kết quả học tập thật tốt!
|
TRƯỜNG THPT BÙI THỊ XUÂN |
ĐỀ THI HỌC KÌ 2 NĂM HỌC: 2022-2023 MÔN: HÓA HỌC 10 - KNTT Thời gian làm bài: 60 phút ( không kể thời gian phát đề ) |
PHẦN I: TRẮC NGHIỆM (7 ĐIỂM)
Câu 1. Số oxi hoá của Fe trong hợp chất Fe2O3 là
A. +2.
B. +3.
C. -2.
D. -3.
Câu 2. Hợp chất trong đó nitrogen có số oxi hoá -3 là
A. N2O.
B. KNO3.
C. N2O3.
D. NH4Cl.
Câu 3. Quá trình Ostwald dùng để sản xuất nitric acid từ ammonia được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình, ammonia bị oxi hoá bởi oxygen ở nhiệt độ cao khi có chất xúc tác:
4NH3 + 5O2 \(\xrightarrow{{{t}^{o}}}\) 4NO + 6H2O
Chất bị oxi hoá trong quá trình trên là
A. NH3.
B. O2.
C. NO.
D. H2O.
Câu 4. Trong phản ứng oxi hoá – khử, chất khử là chất
A. nhận electron.
B. nhường proton.
C. nhường electron.
D. nhận neutron.
Câu 5. Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Phản ứng đốt cháy than trong không khí.
B. Phản ứng tạo gỉ sắt.
C. Phản ứng oxi hóa glucose trong cơ thể.
D. Phản ứng trong lò nung clinker xi măng.
Câu 6. Phản ứng đốt cháy hoàn toàn 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng toả ra là 393,5 kJ. Nhiệt tạo thành chuẩn của CO2(g) là
A. + 393,5 kJ/ mol.
B. –393,5 kJ/ mol.
C. +196,75 kJ/ mol.
D. –196,75 kJ/ mol.
Câu 7. Enthalpy tạo thành chuẩn của một đơn chất bền là
A. biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
C. bằng 0.
D. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Câu 8. Cho phương trình nhiệt hóa học của phản ứng:
N2(g)+O2(g) \(\xrightarrow{{{t}^{o}}}\) 2NO(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = +179,20kJ
Nhận xét nào sau đây là đúng?
A. Phản ứng tỏa nhiệt mạnh.
B. Phản ứng xảy ra thuận lợi ở điều kiện thường.
C. Phản ứng xảy ra dưới điều kiện nhiệt độ thấp.
D. Phản ứng thu nhiệt.
Câu 9. Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g)
Biến thiên enthalpy chuẩn của phản ứng được tính theo công thức là
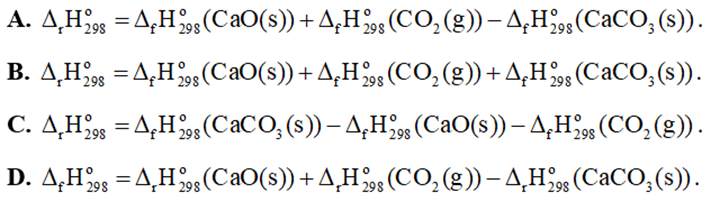
Câu 10. Cho phản ứng tạo thành propene từ propyne:
CH3−C≡CH(g) + H2(g) \(\xrightarrow{{{t}^{0}},Pd/PbC{{O}_{3}}}\) CH3−CH=CH2(g)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
C ≡ C |
H - H |
|
Eb (kJ/mol) |
413 |
347 |
614 |
839 |
432 |
Biến thiên enthalpy chuẩn của phản ứng là
A. -169 kJ.
B. +169 kJ.
C. -196 kJ.
D. +196 kJ.
Câu 11. Sự thay đổi lượng chất trong khoảng thời gian vô cùng ngắn được gọi là
A. tốc độ phản ứng hoá học.
B. tốc độ trung bình của phản ứng.
C. tốc độ tức thời của phản ứng.
D. vận tốc trung bình của phản ứng.
Câu 12. Cho phương trình phản ứng tổng quát sau: 2A + B → C.
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:\({\rm{v}} = {\rm{k}}C_{\rm{A}}^2{{\rm{C}}_{\rm{B}}}\) .
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ của chất.
B. Nồng độ của chất B.
C. Nhiệt độ của phản ứng
D. Thời gian xảy ra phản ứng.
Câu 13. Cho bột Fe vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng?
A. Khí H2 thoát ra nhanh hơn.
B. Bột Fe tan nhanh hơn.
C. Lượng muối thu được nhiều hơn.
D. Nồng độ HCl giảm nhanh hơn.
Câu 14. Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 15. Hydrogen peroxide phân hủy theo phản ứng sau: 2H2O2 → 2H2O + O2.
Tại thời điểm ban đầu, thể tích khí oxygen là 0 cm3, sau thời gian 15 phút thể tích khí oxygen là 16 cm3. Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
A. 1,067 M/ s.
B. 1,067 M/ phút.
C. 1,067 cm3/ s.
D. 1,067 cm3/ phút.
Câu 16. Ở 35oC, phản ứng có tốc độ là 0,036 mol/ (L.h); ở 45oC, phản ứng có tốc độ là 0,09 mol/ (L.h). Hệ số nhiệt độ γ của phản ứng là
A. 1,5.
B. 2.
C. 2,5.
D. 3.
Câu 17. Cho phản ứng đơn giản sau (xảy ra trong bình kín):
2NO(g) + O2(g) → 2NO2(g)
Ở nhiệt độ không đổi, nồng độ NO tăng hai lần, nồng độ O2 không đổi thì
A. tốc độ phản ứng không thay đổi.
B. tốc độ phản ứng tăng 2 lần.
C. tốc độ phản ứng tăng 4 lần.
D. tốc độ phản ứng giảm 2 lần.
Câu 18. Nhận xét nào sau đây là sai?
A. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
B. Với mọi phản ứng, khi tăng áp suất, tốc độ phản ứng tăng.
C. Chất xúc tác làm tăng tốc độ phản ứng.
D. Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
Câu 19. Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố halogen thuộc nhóm
A. IA.
B. IIA.
C. VIIA.
D. VIIIA.
Câu 20. Halogen nào được dùng trong sản xuất nhựa Teflon?
A. Chlorine.
B. Iodine.
C. Fluorine.
D. Bromine.
Câu 21. Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Bromine đóng vai trò
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa, không là chất khử.
Câu 22. Cho các phản ứng hóa học sau, phản ứng nào chứng minh Cl2 có tính oxi hoá mạnh hơn Br2?
A. Br2 + 2NaCl → 2NaBr + Cl2.
B. Cl2 + 2NaOH → NaCl + NaClO + H2O.
C. Br2 + 2NaOH → NaBr + NaBrO + H2O.
D. Cl2 + 2NaBr → 2NaCl + Br2.
Câu 23. Phương trình hóa học nào sau đây viết sai?
A. Br2 + Cu → CuBr2.
B. 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
C. NaBr + AgNO3 → AgBr + NaNO3.
D. Cl2 + Fe → FeCl2.
Câu 24. Nguyên nhân dẫn tới nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến iodine là do từ fluorine đến iodine,
A. khối lượng phân tử và tương tác van der Waals đều tăng.
B. tính phi kim giảm và tương tác van der Waals tăng.
C. khối lượng phân tử tăng và tương tác van der Waals giảm.
D. độ âm điện và tương tác van der Waals tăng giảm.
Câu 25. Phát biểu nào sau đây không đúng?
A. Trong các hợp chất, ngoài số oxi hoá –1, fluorine còn có các số oxi hoá +1, +3, +5, +7.
B. Muối AgI không tan trong nước, muối AgF tan trong nước.
C. Fluorine có tính oxi hóa mạnh hơn chlorine.
D. Dung dịch HF hòa tan được SiO2.
Câu 26. Cho lượng dư dung dịch AgNO3 tác dụng với 100 ml dung dịch hỗn hợp NaF 0,05M và NaCl 0,1M. Khối lượng kết tủa thu được là
A. 1,345 gam.
B. 3,345 gam.
C. 2,875 gam.
D. 1,435 gam.
Câu 27. Cho 10 gam CaCO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2 (đkc). Giá trị của V là
A. 2,24 L.
B. 2,479 L.
C. 3,36 L.
D. 3,719 L.
Câu 28. Nhỏ vài giọt dung dịch nào sau đây vào dung dịch AgNO3 thu được kết tủa màu vàng nhạt.
A. HCl.
B. NaBr.
C. NaCl.
D. HF.
PHẦN II: TỰ LUẬN
Câu 1 (1 điểm): Hãy viết phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine.
Câu 2 (1 điểm): Cho sodium iodide (NaI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4) thu được 3,02 gam manganese(II) sulfate (MnSO4), I2; K2SO4 và Na2SO4.
a) Viết phương trình hoá học xảy ra, chỉ rõ chất khử, chất oxi hoá, quá trình khử, quá trình oxi hoá.
b) Tính khối lượng I2 tạo thành.
Câu 3 (1 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau chứa trong các lọ riêng biệt mất nhãn: HCl, NaCl, NaI.
-----HẾT-----
HƯỚNG DẪN GIẢI
PHẦN I: TRẮC NGHIỆM
|
1 - B |
2 - D |
3 - A |
4 - C |
5 - D |
6 - B |
7 - C |
8 - D |
9 - A |
10 - A |
|
11 - C |
12 - C |
13 - C |
14 - B |
15 - D |
16 - C |
17 - C |
18 - B |
19 - C |
20 - C |
|
21 - C |
22 - D |
23 - D |
24 - A |
25 - A |
26 - D |
27 - B |
28 - B |
Câu 10:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = {{\rm{E}}_{{\rm{b}}\left( {{\rm{C}} \equiv {\rm{C}}} \right)}} + {{\rm{E}}_{{\rm{b}}\left( {{\rm{C}} - {\rm{C}}} \right)}} + 4.{{\rm{E}}_{{\rm{b}}\left( {{\rm{C}} - {\rm{H}}} \right)}} + {{\rm{E}}_{{\rm{b}}\left( {{\rm{H}} - {\rm{H}}} \right)}} - {{\rm{E}}_{{\rm{b}}\left( {{\rm{C}} = {\rm{C}}} \right)}} - 6.{{\rm{E}}_{\left( {{\rm{C}} - {\rm{H}}} \right)}}\)
= Eb (C≡C) – Eb(C=C) + Eb(H-H) – 2Eb(C-H)
= 839 – 614 + 432 – 2.413 = -169 kJ.
Câu 15:
Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
\({V_{tb}} = \frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = \frac{{\left( {16 - 0} \right)}}{{\left( {15 - 0} \right)}} \approx 1,067\,c{m^3}/phut\)
Câu 16:
Hệ số nhiệt độ
\(\gamma \; = \frac{{0,09}}{{0,036}} = 2,5\)
...
PHẦN II: TỰ LUẬN
Câu 1:
Các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Cl2 + 2NaBr → 2NaCl + Br2
⇒ Cl2 có tính oxi hóa mạnh hơn sẽ phản ứng với NaBr tạo thành halogen có tính oxi hóa yếu hơn là Br2.
⇒ Chlorine có tính oxi hóa mạnh hơn bromine.
...
---(Để xem đầy đủ nội dung đề thi trắc nghiệm và đáp án chi tiết, các em vui lòng xem online hoặc đăng nhập để tải về máy)---
Trên đây là một phần trích đoạn nội dung Đề thi HK2 môn Hoá 10 KNTT năm 2022 - 2023 trường THPT Bùi Thị Xuân có đáp án. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng đề thi này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong kì thi sắp tới.













