Nhằm cung cấp cho các em học sinh nhiều tài liệu tham khảo hữu ích để ôn luyện thật tốt cho kì thi sắp tới, HOC247 xin giới thiệu Đề cương ôn tập giữa HK2 môn Hóa học 10 năm 2021-2022. Hi vọng tài liệu này sẽ giúp các em học sinh đạt kết quả cao. Mời các em cùng tham khảo.
1. NỘI DUNG TRỌNG TÂM
1.1. Khái quát nhóm halogen
- Cấu hình electron, số electron lớp ngoài cùng.
- Tính chất hóa học cơ bản của các halogen.
- Các số oxi hóa phổ biến.
- So sánh độ mạnh của các halogen.
1.2. Clo
- Tính chất vật lý; điều chế trong phòng thí nghiệm, sản xuất trong công nghiệp; ứng dụng.
- Tính chất hóa học: phản ứng với nước, kim loại, H2, dung dịch kiềm (nhiệt độ thường, đun nóng).
- Bài toán cơ bản: kim loại + Cl2, H2 + Cl2.
1.3. Nước Gia-ven, clorua vôi
- Thành phần hóa học.
- Tính chất hóa học cơ bản là tính oxi hóa.
- Ứng dụng; PTHH điều chế.
1.4. HCl
- Điều chế trong phòng thí nghiệm, trong công nghiệp.
- Tính chất hóa học cơ bản: tính axit, tính khử.
- Bài toán cơ bản: kim loại/bazơ/muối + dung dịch HCl.
1.5. Các halogen khác: F2, Br2, I2
- Tính chất vật lý.
- Phương pháp, nguồn điều chế.
- Ứng dụng quan trọng.
- Phản ứng khắc chữ lên thủy tinh.
2. BÀI TẬP TỰ LUYỆN
Câu 1: Đặc điểm chung của các nguyên tố nhóm halogen là
A. ở điều kiện thường là chất khí.
B. phản ứng dễ dàng với H2O.
C. có tính oxi hoá mạnh.
D. vừa có tính oxi hoá vừa có tính khử.
Câu 2: Phát biểu nào sau đây là không đúng?
A. Ở điều kiện thường, iot là chất rắn, dạng tinh thể màu đen tím.
B. Ở điều kiện thường, brom là chất khí màu đỏ nâu, dễ bay hơi, hơi brom độc.
C. Ở điều kiện thường, flo là chất khí màu lục nhạt, rất độc.
D. Ở điều kiện thường, clo là chất khí màu vàng lục, mùi xốc, rất độc.
Câu 3: Nguyên tố không thuộc nhóm halogen là
A. oxi.
B. clo.
C. brom.
D. iot.
Câu 4: Các số oxi hóa phổ biến của halogen (trừ flo) trong hợp chất là
A. -1, 0, +7.
B. -1, +1, +3, +5, +7.
C. 0, +1, +3, +5, +7.
D. -2, +2, +4, +6.
Câu 5: Tính chất hóa học chung của các nguyên tố nhóm halogen là
A. có tính khử mạnh.
B. phản ứng dễ dàng với H2O.
C. có tính oxi hóa mạnh.
D. vừa có tính oxi hoá vừa có tính khử.
Câu 6: Halogen chỉ có tính oxi hóa trong tất cả các phản ứng là
A. F2. B. Cl2. C. Br2. D. I2.
Câu 7: Các nguyên tố nhóm halogen có cấu hình electron lớp ngoài cùng ở trạng thái cơ bản là
A. ns2. B. ns2np3. C. ns2np4. D. ns2np5.
Câu 8: Cho 1,15 gam Na tác dụng vừa đủ với halogen X2 thu được 5,15 gam muối NaX. Vậy X là
A. Flo. B. Clo. C. Brom. D. Iot.
Câu 9: Dẫn Cl2 dư vào 200 gam dung dịch KBr. Sau khi phản ứng hoàn toàn, khối lượng muối tạo thành giảm so với khối lượng muối ban đầu là 4,45 gam. Tính nồng độ phần trăm của dung dịch KBr ban đầu.
Câu 10: Quặng xinvinit có công thức hóa học là
A. Na3AlF6.
B. NaCl.KCl.
C. CaF2.
D. KCl.MgCl2.6H2O.
Câu 11: Chất nào sau đây có màu vàng lục?
A. Khí flo.
B. Tinh thể iot.
C. Khí clo.
D. Hơi Brom.
Câu 12: Trong phòng thí nghiệm người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. điện phân dung dịch NaCl có màng ngăn.
C. phân huỷ khí HCl.
D. cho HCl đặc tác dụng với MnO2, KMnO4, …
Câu 13: Trong PTN, Cl2 thường được điều chế theo phản ứng sau:
HCl đặc + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Hệ số cân bằng (số nguyên, tối giản) của HCl là
A. 4.
B. 8.
C. 10.
D. 16.
Câu 14: Khí clo được điều chế từ KMnO4 và HCl đặc thường lẫn hiđro clorua và hơi nước. Để thu được khí clo khô, người ta lắp thiết bị như hình vẽ dưới đây:
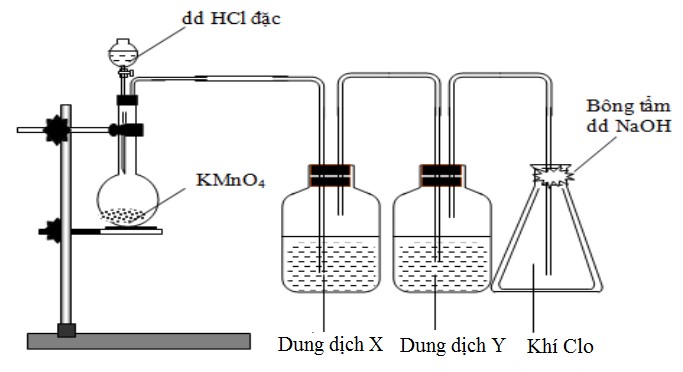
Dung dịch X và Y lần lượt là:
A. NaCl và HCl.
B. HCl và H2SO4 đặc.
C. H2SO4 đặc và NaCl.
D. NaCl và H2SO4 đặc.
Câu 15: Phản ứng nào sau đây dùng điều chế khí Clo trong công nghiệp?
A. 2NaCl + 2H2O → 2NaOH + H2 + Cl2.
B. MnO2 + 4HCl → MnCl2 + Cl2 + H2O.
C. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
D. KClO3 + 6HCl → KCl + 3Cl2 + 3H2O.
Câu 16: Điện phân dung dịch NaCl có màng ngăn, thu được sản phẩm là
A. dung dịch NaOH và nước Gia-ven.
B. dung dịch NaOH, H2, Cl2.
C. dung dịch NaOH, khí HCl.
D. nước Gia-ven, khí H2.
Câu 17: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là
A. Cl2, H2O.
B. HCl, HClO.
C. HCl, HClO, H2O.
D. Cl2, HCl, HClO, H2O.
Câu 18: Khi cho khí clo vào dung dịch KOH đặc, lấy dư và đun nóng, dung dịch thu được có chứa:
A. KCl, KOH dư.
B. KCl, KOH dư, KClO.
C. KCl, KOH dư, KClO3.
D. KCl, KOH dư, KClO3, KClO.
Câu 19: Cho sơ đồ chuyển hóa sau: Cl2 → X → nước Gia-ven. Chất X là
A. NaCl.
B. HCl.
C. HClO.
D. NaClO3.
Câu 20: Chất nào sau đây tác dụng được với clo (điều kiện phản ứng đầy đủ)?
A. F2.
B. Fe.
C. O2.
D. N2.
Câu 21: Trong các kim loại sau đây, kim loại nào khi tác dụng được với clo và axit clohidric cho cùng một loại muối?
A. Zn.
B. Fe.
C. Cu.
D. Ag.
Câu 22: Đun nóng 4,8 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư, sau khi các phản ứng xảy ra hoàn toàn thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít.
B. 6,72 lít.
C. 17,92 lít.
D. 11,2 lít.
Câu 23: Khi cho m gam kim loại canxi tác dụng hoàn toàn với 17,92 lít khí X2 (đktc) thì thu được 88,8 gam muối halogenua.
a. Viết PTPƯ dạng tổng quát.
b. Xác định công thức chất khí X2 đã dùng.
c. Tính giá trị m.
Câu 24*: Cho 3,87 gam hỗn hợp X gồm muối natri của hai hologen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63 gam kết tủa. Xác định 2 halogen và tính phần trăm khối lượng mỗi muối trong hỗn hợp X.
Câu 25*: Cho dung dịch chứa 10 gam hỗn hợp gồm hai muối KX và KY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 14,35 gam kết tủa. Tính phần trăm khối lượng của KX trong hỗn hợp ban đầu.
Câu 26: Clorua vôi là muối của kim loại canxi với hai loại gốc axit là clorua Cl- và hipoclorit ClO-. Vậy, clorua vôi là muối
A. trung hòa.
B. kép.
C. axit.
D. hỗn tạp.
Câu 27: Cho sơ đồ sau: (X) → (Y) → nước Gia-ven. Các chất X, Y lần lượt có thể là:
A. HF, F2.
B. Cl2, HCl.
C. NaCl, Cl2.
D. KI, I2.
Câu 28: Phản ứng nào sau đây dùng để điều chế clorua vôi?
A. Cho khí clo tác dụng với vôi tôi hoặc sữa vôi ở 30°C.
B. Dẫn khí clo qua dung dịch natri hiđroxit lấy dư.
C. Điện phân dung dịch NaCl có màng ngăn.
D. Dẫn khí clo qua nước Gia-ven.
Câu 29: Nước Gia-ven và clorua vôi có tính tẩy màu giấy, vải, sát trùng, tẩy uế vì
A. có chứa gốc ClO– có tính oxi hóa mạnh.
B. ion Cl+ có tính oxi hóa mạnh.
C. có chứa gốc Cl– có tính oxi hóa mạnh.
D. các gốc muối tự phân hủy ở điều kiện thường.
Câu 30: Hoàn thành các phương trình hóa học theo sơ đồ sau, ghi rõ điều kiện phản ứng(nếu có):
a. MnO2 Cl2 HCl NaCl Cl2 NaClO.
b. Fe FeCl2 Fe(OH)2 FeCl2 FeCl3 Fe(NO3)3.
---(Nội dung đầy đủ, chi tiết từ câu 31 đến câu 50 của Đề cương các em vui lòng xem Online hoặc Đăng nhập vào trang Hoc247.net để tải về máy)---
ĐÁP ÁN PHẦN LUYỆN TẬP
|
1C |
2B |
3A |
4B |
5C |
6A |
7D |
8C |
TL |
10B |
|
11C |
12D |
13D |
14D |
15A |
16B |
17D |
18C |
19A |
20B |
|
21A |
22D |
TL |
TL |
TL |
26D |
27C |
28A |
29A |
TL |
|
31A |
32C |
33B |
34C |
35D |
36A |
37C |
38C |
39A |
40D |
|
41C |
42D |
43C |
44B |
45B |
46D |
47D |
48C |
49C |
50D |
Trên đây là một phần trích dẫn nội dung Đề cương ôn tập giữa HK2 môn Hóa học 10 năm 2021-2022. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.







