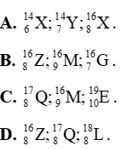HỌC247 xin giới thiệu đến các em học sinh Đề cương ôn tập giữa HK1 môn Hóa học 10 Cánh Diều năm 2022-2023 bao gồm các kiến thức trọng tâm và câu hỏi ôn tập có đáp án hướng dẫn chi tiết sẽ giúp các em rèn luyện và chuẩn bị cho kỳ thi giữa học kì 1 sắp tới. Ngoài ra các em có thể tham khảo trọn Bộ đề cương ôn tập giữa HK1 năm 2022-2023 tất cả các môn học. Chúc các em đạt được kết quả học tập tốt!
ĐỀ CƯƠNG ÔN TẬP GIỮA HỌC KÌ I
MÔN HÓA HỌC 10 CD
NĂM HỌC 2022-2023
1. TÓM TẮT LÝ THUYẾT
1.1. Thành phần của nguyên tử
Cấu trúc của nguyên tử
Nguyên tử bao gồm:
- Lớp vỏ: được tạo nên bởi các hạt electron, kí hiệu là e
- Hạt nhân: được tạo nên bởi các hạt proton và hạt neutron
+ Hạt proton, kí hiệu là p
+ Hạt neutron, kí hiệu là n
Khối lượng và điện tích các hạt cơ bản
|
Loại hạt |
Electron |
Proton |
Neutron |
|
Khối lượng (amu) |
0,00055 |
1 |
1 |
|
Điện tích (e0) |
-1 |
+1 |
0 |
Lưu ý:
- Trong một nguyên tử: số proton = số electron
- Trong tất cả các nguyên tố, chỉ có duy nhất một loại nguyên tử của hydrogen (H) được tạo nên bởi proton và electron (không có neutron).
Khối lượng và kích thước của nguyên tử
- Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử.
- Kích thước của nguyên tử là vô cùng nhỏ
- Hạt nhân nguyên tử có kích thước rất nhỏ so với nguyên tử (phần không gian rỗng chiếm chủ yếu trong nguyên tử).
1.2. Nguyên tố hóa học
Nguyên tố hóa học
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Số hiệu nguyên tử, số khối
Số hiệu nguyên tử: Z.
Số khối (A) = số proton (P) + số neutron (N)
Kí hiệu nguyên tử
\(_Z^AX\)
Kí hiệu nguyên tử \(_Z^AX\) cho biết kí hiệu hoá học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).
Đồng vị
Các đồng vị của một nguyên tố hoá học là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhau về số neutron (N).
Nguyên tử khối và nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
\(\overline {{{\rm{A}}_{\rm{x}}}} = \frac{{{a_1}.{A_1} + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\)
\(\overline {{{\rm{A}}_{\rm{x}}}} \): là nguyên tử khối trung bình của X.
Ai là nguyên tử khối đồng vị thứ i.
ai là tỉ lệ % số nguyên tử đồng vị thứ i.
1.3. Mô hình nguyên tử và orbital nguyên tử
Mô hình nguyên tử
- Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của mỗi lớp như sau:
+ Lớp thứ nhất gọi là lớp K.
+ Lớp thứ hai gọi là lớp L.
+ Lớp thứ ba gọi là lớp M.
+ Lớp thứ tư gọi là lớp N.
Lưu ý:
- Các electron được phân bố lần lượt vào lớp gần hạt nhân trước.
- Số electron tối đa trong mỗi lớp là 2n2 (n là số thứ tự lớp electron).
Orbital nguyên tử
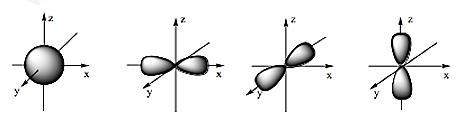
- Orbital nguyên tử (AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
- Orbial nguyên tử có một số hình dạng khác nhau.
+ AO hình cầu, còn gọi là AO s;
+ AO hình số tám nổi, còn gọi là AO p (tùy theo vị trí của AO p trên hệ trục tọa độ Đề - các, sẽ gọi là AO px, py và pz).
Hình dạng của AO s(a) và AO p (b, c, d)
- Một AO chỉ chứa tối đa 2 electron
Lưu ý:
- Các AO p trong cùng một lớp electron có hình dạng và kích thước tương tự nhau nhưng khác nhau về định hướng trong không gian.
- Ngoài các AO hay gặp là s và p, còn có các AO khác như d, f có hình dạng phức tạp hơn.
1.4. Lớp, phân lớp và cấu hình electron
Lớp và phân lớp electron
Lớp
- Trong nguyên tử, các electron được sắp xếp thành từng lớp (kí hiệu K, L, M, N, O, P,Q) từ gần đến xa hạt nhân, theo thứ tự từ lớp n = 1 đến n = 7
- Các electron trên cùng một lớp có năng lượng gần bằng nhau.
Số lượng AO và số electron tối đa trong mỗi lớp
|
Lớp |
K (n = 1) |
L (n = 2) |
M (n = 3) |
N (n = 4) |
|
Số lượng AO |
1 |
4 |
9 |
16 |
|
Số electron tối đa |
2 |
8 |
18 |
32 |
Lớp thứ n có n2 AO.
Lớp thứ n có tối đa 2n2 electron.
Phân lớp electron
- Mỗi lớp electron (trừ lớp thứ nhất) lại được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
- Số lượng và kí hiệu các phân lớp trong một lớp: Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf, ...
+ Lớp K (n =1): có 1 phân lớp, được kí hiệu là 1s.
+ Lớp L (n =2): có 2 phân lớp, được kí hiệu là 2s và 2p.
+ Lớp M (n =3): có 3 phân lớp, được kí hiệu là 3s, 3p và 3d.
- Số lượng AO trong mỗi phân lớp
+ Phân lớp ns chỉ có 1 AO.
+ Phân lớp np có 3 AO.
+ Phân lớp nd có 5 AO.
+ Phân lớp nf có 7 AO.
- Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên phải kí hiệu phân lớp. Phân lớp nào đã có tối đa electron được gọi là phân lớp bão hòa.
Lưu ý: Số lượng electron tối đa trong mỗi phân lớp
- Phân lớp ns chứa tối đa 2 electron.
- Phân lớp np chứa tối đa 6 electron.
- Phân lớp nd chứa tối đa 10 electron.
- Phân lớp nf chứa tối đa 14 electron.
Cấu hình electron nguyên tử
Cách viết cấu hình electron nguyên tử
- Cấu hình electron biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp.
- Các bước viết cấu hình electron nguyên tử theo những nguyên tắc sau:
+ Quy tắc 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s...
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
- Quy tắc 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
- Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của electron trong mỗi phân lớp tăng theo chiều từ trái qua phải.
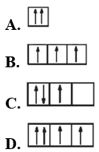
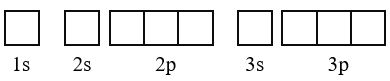
Biểu diễn cấu hình electron theo ô orbital
- Quy tắc 1: Viết cấu hình electron của nguyên tử
- Quy tắc 2: Biểu diễn mỗi AO bằng một ô vuông (orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
- Quy tắc 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên.
Lưu ý:
- Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các orbital theo thứ tự từ trái sang phải.
- Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
|
Đặc điểm của lớp electron ngoài cùng |
||||
|
Số electron |
1, 2, 3 |
4 |
5, 6, 7 |
8 |
|
Loại nguyên tố |
Kim loại |
Kim loại hoặc phi kim |
Phi kim |
Khí hiếm (trừ He) |
1.5. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì.
- Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp cùng một nhóm, trừ nhóm VIIIB.
Lưu ý: Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (thường là những electron ở lớp ngoài cùng).
Cấu tạo của bảng tuần hoàn
- Ô nguyên tố: Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hoá học trong ô đó.
- Chu kì là tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
- Nhóm là tập hợp các nguyên tố hóa học mà nguyên tử có cấu hình electron tương tự nhau
Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
Phân loại nguyên tố dựa theo cấu hình electron và tính chất hoá học
- Dựa vào cấu hình electron: nguyên tố s, nguyên tố p, nguyên tố d và nguyên tố f.
- Dựa vào tính chất hoá học: nguyên tố kim loại, nguyên tố phi kim và nguyên tố khí hiếm.
1.6. Xu hướng biến đổi trong bảng tuần hoàn
Bán kính nguyên tử
- Bán kính nguyên tử của các nguyên tố nhóm A có xu huong biên đối tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, từ trái sang phải, bán kính nguyên tử của các nguyên tố có xu hướng giảm dần
+ Trong một nhóm, theo chiều từ trên xuống dưới bán kính nguyên tử có xu hướng tăng.
Độ âm điện
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hoá học.
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đối tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, độ âm diện của nguyên từ các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
Tính kim loại, tính phi kim
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron.
- Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
Lưu ý: Tính kim loại và tính phi kim luôn biến đổi ngược chiều nhau. Độ âm điện và tính phi kim của các nguyên tử của nguyên tố hóa học biến đổi cùng chiều trong một chu kì và trong một nhóm.
Tính acid - base của oxide và hydroxide
Xu hướng biến đổi tính acid, tính base của oxide và hydroxide trong một chu kì: tính acid có xu hướng tăng dần, tính base có xu hướng giảm dần theo chiều tăng điện tích hạt nhân.
1.7. Định luật tuần hoàn
Định luật tuần hoàn
Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể đưa ra dự đoán về tính chất của đơn chất cũng như hợp chất của nó.
2. BÀI TẬP
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự vận chuyển của máu trong hệ tuần hoàn.
B. Sự quang hợp của cây xanh.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Sự truyền âm trong chân không.
Câu 2: Trong các hiện tượng sau đây hiện tượng nào là hiện tượng vật lí?
A. Lưu huỳnh (sulfur) cháy trong không khí, tạo ra chất khí mùi hắc.
B. Đốt cháy khí methane, thu được khí carbon dioxide và hơi nước.
C. Hòa tan đường vào nước, thu được dung dịch nước đường.
D. Nung đá vôi, thu được vôi sống và khí carbon dioxide.
Câu 3: Khi nghiên cứu thành phần hóa học và bước đầu ứng dụng tinh dầu tràm trà trong sản xuất nước súc miệng, các nhà nghiên cứu đã đặt ra giả thuyết: “Tinh dầu tràm trà có khả năng kháng khuẩn”. Bước đặt giả thuyết này ứng với bước nào trong phương pháp nghiên cứu hóa học?
A. Xác định vấn đề nghiên cứu.
B. Nêu giả thuyết khoa học.
C. Thực hiện nghiên cứu (lí thuyết, thực nghiệm, ứng dụng).
D. Viết báo cáo: thảo luận kết quả và kết luận vấn đề.
Câu 4: Phương pháp nghiên cứu vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng … được gọi là
A. phương pháp nghiên cứu lí thuyết.
B. phương pháp nghiên cứu thực nghiệm.
C. phương pháp nghiên cứu ứng dụng.
D. phương pháp nghiên cứu lí luận.
Câu 5: Hạt mang điện trong hạt nhân nguyên tử là
A. electron và proton.
B. neutron.
C. proton.
D. proton và neutron.
Câu 6: Nhận định nào sau đây không đúng?
A. Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện.
B.Lớp vỏ nguyên tử chứa electron mang điện tích âm.
C. Khối lượng nguyên tử hầu hết tập trung ở hạt nhân.
D. Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
Câu 7: Hạt nhân của nguyên tử X có điện tích là +30,438.10-19 coulomb. Vậy nguyên tử X là
A. Ar (Z = 18).
B. K (Z = 19).
C. Ca (Z = 20).
D. Cl (Z = 17).
Câu 8: Nguyên tử alminium (kí hiệu: Al) có số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong Al là
A. 27.
B. 26.
C. 13.
D. 14.
Câu 9: Nếu hạt nhân nguyên tử có Z hạt proton thì
A. Số đơn vị điện tích hạt nhân là Z+.
B. Điện tích hạt nhân là Z.
C. Số hạt neutron là Z.
D. Tổng số hạt mang điện trong nguyên tử là 2Z.
Câu 10: Nguyên tử trung hòa về điện vì
A. có tổng số hạt proton bằng tổng số hạt electron.
B. có tổng số hạt electron bằng tổng số hạt neutron.
C. tổng số hạt neutron bằng tổng số hạt proton.
D. được tạo nên bởi các hạt không mang điện.
Câu 11: Đặc điểm của hạt electron là
A. mang điện tích dương và có khối lượng.
B. mang điện tích âm và có khối lượng.
C. không mang điện và có khối lượng.
D. mang điện tích âm và không có khối lượng.
Câu 12: Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. điện tích hạt nhân.
B. số khối.
C. số electron.
D. neutron.
Câu 13: Nguyên tử có
A. 13 proton, 13 electron, 14 neutron.
B. 13 proton, 14 electron, 14 neutron.
C. 13 proton, 14 electron, 13 neutron.
D. 14 proton, 14 electron, 13 neutron.
Câu 14: Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hoá học?
Câu 15: Nhận định nào không đúng? Hai nguyên tử \({}_{{\rm{29}}}^{{\rm{63}}}{\rm{Cu}}\) và \({}_{{\rm{29}}}^{{\rm{65}}}{\rm{Cu}}\)
A. là đồng vị của nhau.
B. có cùng số electron.
C. có cùng số neutron.
D. có cùng số hiệu nguyên tử.
Câu 16: Trong tự nhiên, bromine có hai đồng vị bền là \({}_{{\rm{35}}}^{{\rm{79}}}{\rm{Br}}\) chiếm 50,69% số nguyên tử và \({}_{{\rm{35}}}^{{\rm{81}}}{\rm{Br}}\)chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của bromine là
A. 80,00.
B. 80,112.
C. 80,986.
D. 79,986.
Câu 17: Hình ảnh dưới đây là hình dạng của những loại orbital nguyên tử nào?
A. s, d.
B. d, f.
C. s, p.
D. p, f.
Câu 18: Số electron tối đa ở lớp thứ n (n ≤ 4) là
A. n.
B. 2n.
C. 2n2.
D. n2.
Câu 19: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
Câu 20: Nguyên tử nào sau đây có 3 electron ở lớp ngoài cùng?
A. N (Z = 7).
B. Na (Z = 11).
C. Al (Z = 13).
D. C (Z = 6).
Câu 21: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 22: Trong bảng tuần hoàn hiện nay, các nguyên tố được sắp xếp không theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một cột.
D. Theo chiều tăng khối lượng nguyên tử.
Câu 23: Một nguyên tố hóa học X ở chu kì 3, nhóm IVA. Cấu hình electron của nguyên tử X là
A.1s22s22p63s23p2.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p5.
Câu 24: Hầu hết các chu kì trong bảng tuần hoàn các nguyên tố hóa học đều bắt đầu bằng
A. kim loại kiềm thổ.
B. kim loại kiềm.
C. halogen.
D. khí hiếm.
Câu 25: Bảng tuần hoàn hiện nay có số cột là
A. 8.
B. 16.
C. 9.
D. 18.
Câu 26: Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng
A. số electron hóa trị.
B. số hiệu nguyên tử.
C. số lớp electron.
D. số khối.
Câu 27: Cho biết cấu hình electron nguyên tử của các nguyên tố X: 1s22s22p63s2; Y: 1s22s22p63s23p64s1; Z: 1s22s22p63s23p5. Nguyên tố nào là kim loại?
A. X.
B. Z.
C. X và Y.
D. Y.
Câu 28: Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 9. Vậy X thuộc loại nguyên tố nào sau đây?
A. s.
B. d.
C. f.
D. p.
Câu 29: Chu kì 3 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 8 nguyên tố.
C. 10 nguyên tố.
D. 18 nguyên tố.
Câu 30: Nguyên tố X có cấu hình electron 1s22s22p63s23p64s1 thuộc
A. ô 19, chu kì 4, nhóm IA.
B. ô 19, chu kì 4, nhóm IB.
C. ô 19, chu kì 3, nhóm IVA.
D. ô 19, chu kì 3, nhóm IA.
ĐÁP ÁN
|
1-C |
2-C |
3-B |
4-B |
5-C |
6-D |
7-B |
8-C |
9-D |
10-A |
|
11-B |
12-A |
13-A |
14-D |
15-C |
16-D |
17-C |
18-C |
19-D |
20-C |
|
21-B |
22-D |
23-A |
24-B |
25-D |
26-A |
27-C |
28-D |
29-B |
30-A |
Trên đây là toàn bộ nội dung tài liệu Đề cương ôn tập giữa HK1 môn Hóa học 10 Cánh Diều năm 2022-2023. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Đề cương ôn tập giữa HK1 môn Lịch sử 10 CD năm học 2022-2023
- Đề cương ôn tập giữa HK1 môn Tin học 10 Cánh diều năm 2022-2023
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.





.JPG)
.JPG)