Nhằm hỗ trợ các em học sinh ôn tập thật tốt trong kì thi sắp tới HỌC247 xin giới thiệu đến các em Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Tây Sơn. Hy vọng đây sẽ là tài liệu bổ trợ kiến thức đắc lực cho các em. Mời các em cùng tham khảo!
|
TRƯỜNG THPT TÂY SƠN |
ĐỀ THI TUYỂN SINH VÀO LỚP 10 NĂM 2021 MÔN HÓA HỌC THỜI GIAN 90 PHÚT |
ĐỀ SỐ 1
Câu I: (3,0 điểm)
1. Cho lần lượt từng chất: Fe, BaO, Al2O3 và KOH vào lần lượt các dung dịch: NaHSO4, CuSO4. Hãy viết các phương trình phản ứng xảy ra.
2. Một hỗn hợp gồm Al, Fe, Cu và Ag. Bằng phương pháp hoá học hãy tách rời hoàn toàn các kim loại ra khỏi hỗn hợp trên.
3. Có 5 lọ mất nhãn đựng 5 dung dịch: NaOH, KCl, MgCl2, CuCl2, AlCl3. Hãy nhận biết từng dung dịch trên mà không dùng thêm hoá chất khác. Viết các phương trình phản ứng xảy ra.
Câu II: (2,0 điểm)
1. Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm C và H2, trong đó thể tích khí H2 thu được gấp đôi thể tích khí X (đo ở cùng điều kiện). Xác định các công thức phân tử thỏa mãn X.
2. Ba chất hữu cơ mạch hở A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2. Chúng có những tính chất sau:
- Chỉ A và B tác dụng với Na giải phóng khí H2.
- Chỉ B và C tác dụng được với dung dịch NaOH.
- A tác dụng với B (trong điều kiện xúc tác, nhiệt độ thích hợp) thu được sản phẩm là chất C.
Hãy cho biết công thức cấu tạo của A, B, C. Viết các phương trình phản ứng xảy ra.
3. Metan bị lẫn một ít tạp chất là CO2, C2H4, C2H2. Trình bày phương pháp hoá học để loại hết tạp chất khỏi metan.
Câu III: (3,0 điểm)
1. Hòa tan hoàn toàn 0,297 gam hỗn hợp Natri và một kim loại thuộc nhóm IIA trong bảng tuần hoàn các nguyên tố hóa học vào nước. Ta được dung dịch X và 56 ml khí Y (đktc). Xác định kim loại thuộc nhóm IIA và khối lượng của mỗi kim loại trong hỗn hợp.
2. Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500 ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.
a. Viết các phương trình phản ứng xảy ra và tìm giá trị của a.
b. Cho từ từ dung dịch NaOH 2M vào dung dịch Y và khuấy đều đến khi thấy bắt đầu xuất hiện kết tủa thì dùng hết V1 lít dung dịch NaOH 2M, tiếp tục cho tiếp dung dịch NaOH vào đến khi lượng kết tủa không có sự thay đổi nữa thì lượng dung dịch NaOH 2M đã dùng hết 600 ml. Tìm các giá trị m và V1.
Câu IV: (2,0 điểm)
1. Từ tinh bột, các hóa chất vô cơ và điều kiện cần thiết khác có đủ. Viết phương trình hóa học điều chế Etyl axetat ( ghi rõ điều kiện nếu có).
2. Có a gam hỗn hợp X gồm một axit no đơn chức A và một este B. B tạo ra bởi một axit no đơn chức A1 và một rượu no đơn chức C (A1 là đồng đẳng kế tiếp của A). Cho a gam hỗn hợp X tác dụng với lượng vừa đủ NaHCO3, thu được 1,92 gam muối. Nếu cho a gam hỗn hợp X tác dụng với một lượng vừa đủ NaOH đun nóng thu được 4,38 gam hỗn hợp hai muối của 2 axit A, A1 và 1,38 gam rượu C, tỷ khối hơi của C so với hiđro là 23. Đốt cháy hoàn toàn 4,38 gam hỗn hợp hai muối của A, A1 bằng một lượng oxi dư thì thu được Na2CO3, hơi nước và 2,128 lit CO2 (đktc). Giả thiết phản ứng xảy ra hoàn toàn.
a. Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B.
b. Tính a.
ĐÁP ÁN ĐỀ SỐ 1
Câu 1:
* Với NaHSO4 :
Fe + 2NaHSO4 → FeSO4 + Na2SO4 + H2
BaO + 2NaHSO4 → BaSO4 + Na2SO4 + H2O
Al2O3 + 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 3H2O
2KOH + 2NaHSO4 → K2SO4 + Na2SO4 + 2H2O
* Với CuSO4 :
Fe + CuSO4→ FeSO4 + Cu
BaO + CuSO4 + H2O → BaSO4↓ + Cu(OH)2↓
Al2O3 + CuSO4 → không phản ứng
2KOH + CuSO4 → K2SO4 + Cu(OH)2↓
Cho hỗn hợp tan trong NaOH dư, Fe , Cu và Ag không tan:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Thổi CO2 vào dung dịch nước lọc:
NaAlO2 + CO2 + 4H2O → NaHCO3 + Al(OH)3↓
Lọc tách kết tủa rồi nung ở nhiệt độ cao:
2Al(OH)3 → Al2O3 + 3H2O
Điện phân Al2O3 nóng chảy: 2Al2O3 4Al + 3O2↑
Cho hỗn hợp Fe , Cu và Ag không tan ở trên vào dung dịch HCl dư. Cu và Ag không tan.
Fe + 2HCl → FeCl2 + H2
Lấy dung dịch thu được cho tác dụng với NaOH dư, lọc kết tủa nung đến khối lượng không đổi, dẫn luồng khí CO dư đi qua
HCl + NaOH → NaCl + H2O
FeCl2 + 2NaOH → 2NaCl + Fe(OH)2↓
2Fe(OH)2 + 1/2O2 → Fe2O3 + 2H2O
Fe2O3 + 3CO → 2Fe + 3CO2
Hỗn hợp Cu, Ag nung trong oxi đến phản ứng hoàn toàn thu được hỗn hợp rắn CuO và Ag. Hòa tan trong dung dịch HCl dư, lọc lấy Ag không tan, dung dịch thu đem điện phân lấy Cu, hoặc cho tác dụng với NaOH dư, lọc kết tủa nung đến khối lượng không đổi, dẫn luồng khí CO dư đi qua
HCl + NaOH → NaCl + H2O
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
Cu(OH)2 → CuO + H2O
CuO + CO → Cu + CO2
- Dung dịch có màu xanh lam là CuCl2.
- Lấy dung dịch CuCl2 cho tác dụng với 4 dung dịch còn lại, dung dịch nào tạo kết tủa xanh lam là NaOH:
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓.
- Lấy dung dịch NaOH, cho tác dụng với 3 dung dịch còn lại:
+ dung dịch nào không có kết tủa là KCl
+ dung dịch nào có kết tủa trắng là MgCl2
MgCl2 + 2NaOH → 2NaCl + Mg(OH)2↓.
+ dung dịch nào có kết tủa trắng, kết tủa tan trong kiềm dư là AlCl3
AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓.
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Câu 2: Gọi công thức phân tử của X : CxHy ( x ≤ 4)
CxHy → xC + y/2 H2
Theo bài ra ta có y/2 = 2 Þ y= 4.
Vậy X có dạng CxH4. Þ các công thức phân tử thỏa mãn điều kiện X là:
CH4, C2H4, C3H4, C4H4.
A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2.
- A tác dụng với Na giải phóng khí H2. Vậy A là rượu, Công thức cấu tạo của A là: CH2=CH-CH2-OH.
- B tác dụng với Na giải phóng khí H2, B tác dụng được với dung dịch NaOH. Vậy B là axit có công thức cấu tạo là: : CH2=CH-COOH
- C tác dụng được với dung dịch NaOH, không tác dụng với Na và là sản phẩm phản ứng giữa A và B. Vậy C là este có công thức cấu tạo là:
CH2=CH-COOCH2-CH=CH2
Các phương trình phản ứng xảy ra là:
CH2=CH-CH2-OH + Na → CH2=CH-CH2-ONa + 1/2H2
CH2=CH-COOH + Na → CH2=CH-COONa + 1/2H2
CH2=CH-COOH + NaOH → CH2=CH-COONa + H2O
CH2=CH-COOCH2-CH=CH2 + NaOH→CH2=CH-COONa + CH2=CH-CH2-OH
CH2=CH-COOH + CH2=CH-CH2-OH → CH2=CH-COOCH2-CH=CH2+ H2O
Cho hỗn hợp khí lần lượt đi qua bình nước Brôm dư, lúc đó loại hết C2H4, C2H2 nhờ phản ứng:
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
Sau đó cho khí còn lại qua bình đựng dung dịch kiềm dư (NaOH, Ca(OH)2,…v.v), lúc đó CO2 bị hấp thụ hết do phản ứng:
2NaOH + CO2 → Na2CO3 + H2O
Khí còn lại là CH4 nguyên chất.
Câu 3: Đặt ký hiệu và nguyên tử khối kim loại nhóm IIA chưa biết là M và a, b lần lượt là số mol Na và M trong hỗn hợp.
Các phương trình phản ứng:
\(Na+{{H}_{2}}O\to NaOH+\frac{1}{2}{{H}_{2}}\uparrow \) (1)
\(a(mol)\) → \(0,5a(mol)\)
\(M+2{{H}_{2}}O=M{{(OH)}_{2}}+{{H}_{2}}\uparrow \) (2)
\(b(mol)\) → \(b(mol)\)
Theo bài cho ta có hệ phương trình toán học:
\(\left\{ _{{{n}_{{{H}_{2}}}}=0,5a+b=\frac{56}{22400}=0,0025mol\left( II \right)}^{{{m}_{hh}}={{m}_{Na}}+{{m}_{_{M}}}=23a+Mb=0,297\left( I \right)} \right.\)
Từ (II) \(\underset{{}}{\overset{{}}{\mathop {}}}\,\]\[a=0,005-2b\) thế vào (I) rồi rút gọn ta được:
\(b(M-46)=0,182\) hay \(({R}'+67)y=4,38\to ({R}'+67)y=2,46\) (III)
Điều kiện: \(0
|
M |
87,6 137 |
|
b |
0,0044 0,002 Sai (Ba) |
Vậy M là bari (Ba).
Vì \(b=0,002\Rightarrow {{m}_{Ba}}=0,002.137=0,274gam\)
Và m Na = 0,297 – 0,274 = 0,023 gam
2 a. Đặt x, y là số mol Al và Fe trong hỗn hợp X:
PTHH : 2Al + 3 CuSO4 → Al2(SO4)3 + 3 Cu (1)
x 3x/2 (mol)
Fe + CuSO4 → FeSO4 + Cu (2)
y y (mol)
Al + 3HCl → AlCl3 + 3/2H2 (3)
x 3x x 3x/2 (mol)
Fe + 2HCl → FeCl2 + H2 (4)
y 2y y y (mol)
Biện luận : Ta nhận thấy số mol của HCl ban đầu là 1mol, lượng khí H2 thu được là 0,4 mol. Vậy HCl dư, Al, Fe hòa tan hết trong dung dịch HCl.
Từ (3) và (4) ta có : 3x/2 + y = n\(_{{{H}_{2}}}\) = 0,4 mol (*)
Từ (1) và (2) ta có : 3x/2 + y = n\(_{Cu}\)= 0,4 mol suy ra khối lượng của Cu trong hỗn hợp X ban đầu : a = 35,2 – 64. 0,4 = 9,6 gam
b. Từ kết quả câu a. Trong dung dịch Y chứa 0,2 mol HCl dư, x mol AlCl3, y mol FeCl2.
Khi cho từ từ dung dịch NaOH vào dung dịch Y. Ban đầu xảy ra phản ứng trung hòa
HCl + NaOH → NaCl + H2O (5)
0,2mol 0,2mol
Khi phản ứng (5) kết thúc, kết tủa bắt đầu xuất hiện. Lượng NaOH đã dùng trong phản ứng (5) là: 0,2 mol. Suy ra V1 = $\frac{0,2}{2}$= 0,1 lít.
AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓ (6)
x 3x x mol
FeCl2 + 2NaOH → 2NaCl + Fe(OH)2↓ (7)
y 2y y mol
Al(OH)3 + NaOH → NaAlO2 + 2H2O (8)
x x mol
Sau khi kết thúc các phản ứng (6), (7), (8) lượng kết tủa không có sự thay đổi nữa.
Số mol NaOH đã thực hiện ở các phản ứng (5), (6), (7), (8) là:
0,2 + 3x + 2y + x = 1,2 mol → 4x + 2y = 1 mol → 2x + y = 0,5 (**)
Từ (*), (**) ta có: x = 0,2 mol, y = 0,1 mol.
Khối lượng của hỗn hợp X ban đầu là: m = 0,2. 27 + 0,1. 56 + 9,6 = 20,6 gam.
Câu 4:
Phương trình phản ứng xảy ra là:
(C6H10O5)n + nH2O → nC6H12O6
C6H12O6 → 2C2H5OH + 2CO2
C2H5OH + 1/2O2 → CH3COOH
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
2. Đặt A là RCOOH (x mol), A1 : \({R}'COOH\), C : R1OH
Este B : \({R}'COO{{R}_{1}}\) (y mol)
\(X+NaHC{{O}_{3}}:\)
* \(RCOOH+NaHC{{O}_{3}}\to RCOONa+C{{O}_{2}}\uparrow +{{H}_{2}}O\)
x x
→ (R+67)x = 1,92 (1)
* \(X+NaOH:\)
\(RCOOH+NaOH\to RCOONa+{{H}_{2}}O\)
x x
\({R}'COO{{R}_{1}}+NaOH\to {R}'COONa+{{R}_{1}}OH\)
y y y
*Ta có:
\(\underbrace{(R+67)x}_{1,92}\] +\[({R}'+67)y=4,38\to ({R}'+67)y=2,46\) (2)
* \({{M}_{{{R}_{1}}OH}}=23.2=46({{C}_{2}}{{H}_{5}}OH)\to y=0,03\)
Từ (2) ta được: \(({R}'+67)0,03=2,46\to {R}'=15(C{{H}_{3}}-)\)
* Khi nung hỗn hợp 2 muối:
\(2{{C}_{n}}{{H}_{m}}COONa+(\frac{4n+m+1}{2}){{O}_{2}}\xrightarrow{{{t}^{0}}}N{{a}_{2}}C{{O}_{3}}+(2n+1)C{{O}_{2}}+m{{H}_{2}}O\)
\(x(mol)\) \(\frac{(2n+1)x}{2}mol\)
\(\text{2C}{{\text{H}}_{3}}\text{COONa}+4{{O}_{2}}\xrightarrow{{{t}^{0}}}N{{a}_{2}}C{{O}_{3}}+3C{{O}_{2}}\uparrow +3{{H}_{2}}O\)
\(0,03mol\) \(0,015mol\)
Ta có:
\(\frac{(2n+1)x}{2}+0,045=\frac{2,128}{22,4}\)
Hay:
\((2n+1)x=0,1\to x=\frac{0,1}{2n+1}\) (3)
Từ (1) và (3):
\(\frac{(R+67)0,1}{2n+1}=1,92\to R=38,4n-47,8\) (4)
Từ (4): n = 0 (HCOOH) → R<0 (loại)
n = 2 → R = 29 \(({{C}_{2}}{{H}_{5}}-)\)
x = 0,02
Vậy:
a. X gồm: A: C2H5COOH, A1: CH3COOH, C: C2H5OH,
B: \(C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}\)
b. a = (74 . 0,02) + (88 . 0,03) = 4,12 (gam)
ĐỀ SỐ 2
Câu I: Nung nóng hỗn hợp A gồm KMnO4 và KClO3 đến khối lượng không đổi5 thu được hỗn hợp chất rắn B. Cho B vào cốc chứa lượng dưưaxit H2SO4, đun nóng nhẹ tới khi các phản ứng xảy ra hoàn toàn, thu được 336 ml khí (đktc). Viết các phương trình phản ứng xảy ra. Tính số gam hỗn hợp A đã dùng biết KClO3 chiếm 72,65% khối lượng của A.
Câu II: Đốt cháy hoàn toàn m gam hỗn hợp C gồm FeS2 và Cu2S thu được khí SO2 và hỗn hợp rắn D gồm Fe2O3, CuO. Chuyển toàn bộ SO2 thành SO3 rồi hâp0s thụ hết vào nước thu được dung dịch E. Cho toàn bộ D vào cốc chứa dung dịch E, sau đó phải thêm tiếp 375 ml dung dịch HCl 2M vào cốc thì D mới vừa đủ tan hết tạo ra dung dịch F. Cho dung dịch F tác dụng với lượng dư dung dịch BaCDl2 thu được 116,5 gam kết tủa. Viết các phương tri8nhf phản ứng xảy ra. Tính m.
Câu III: Có một hỗn hợp A1 gồm Mg, Al,Zn, Fe, Cu, trong đó số mol Cu gấp đôi số mol Fe. Lấy 5,896 gam hỗn hợp A1 cho tác dụng với axit HCl dư, thu được 4,2336 lit khí H2 (đktc). Mặt khác, lấy 17,688 gam hỗn hợp A1 cho tác dụng với khí clo dư, thu được 62,7375 gam hỗn hợp chất rắn. Viết các phương trình phản ứng. Tính thành phần % khối lượng cuae Fe và của Cu trong hỗn hợp A1. Giả thiết hiệu suất các phản ứng là 100%.
Câu VI: Viết công thức phân tử, công thức cấu tạo các hợp chất hữu cơ mạch hở (chứa cacbon, hiđro, oxi) có tỉ khối hơi so với hiđro bằng 30. Trong số các chất đó, những chất nào tác dụng được với Na, với NaHCO3, với NaOH. Viết các phương trình phản ứng minh họa.
Câu V: Có hai hợp chất hữu cơ X và Y, trong đó khối lượng mol của X nhỏ hơn của Y. Mỗi chất chỉ chứa một loại nhóm chức phản ứng được với Na tạo ra H2. Khi đốt cháy hoàn toàn mỗi chất đều chỉ tạo ra CO2 và H2O, trong đó số mol H2O nhiều hơn số mol CO2. Đốt cháy hoàn toàn một hỗn hợp Z gồm những lượng bằng nhau về số mol của X và Y thu được số mol H2O gấp 1,5 lần số mol CO2. Viết công thức cấu tạo có thể có của X và của Y tương ứng.
Câu VI: Hợp chất hữu cơ X1 có công thức phân tử trùng với công thức đơn giản nhất. Trong đó thành phần % theo khối lượng của cacbon và hiđro là 45,45% và 6,06% còn lại là oxi. Khi cho X1 tác dụng với NaOH tạo ra ba sản phẩm hữu cơ. Mặt khác, khi cho 9,9 gam X1 tác dụng với H2O có H2SO4 làm xúc tác, thu được ba sản phẩm hữu cơ, trong đó hai sản phẩm cùng loại nhóm chức có tổng khối lượng bằng 5,406 gam và đạt hiệu suất 68%. Xác định công thức phân tử và viết công thức cấu tạo của X1.
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 3
Câu I: (3,0 điểm)
1. Cho lần lượt từng chất: Fe, BaO, Al2O3 và KOH vào lần lượt các dung dịch: NaHSO4, CuSO4. Hãy viết các phương trình phản ứng xảy ra.
2. Một hỗn hợp gồm Al, Fe, Cu và Ag. Bằng phương pháp hoá học hãy tách rời hoàn toàn các kim loại ra khỏi hỗn hợp trên.
3. Có 5 lọ mất nhãn đựng 5 dung dịch: NaOH, KCl, MgCl2, CuCl2, AlCl3. Hãy nhận biết từng dung dịch trên mà không dùng thêm hoá chất khác. Viết các phương trình phản ứng xảy ra.
Câu II: (2,0 điểm)
1. Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm C và H2, trong đó thể tích khí H2 thu được gấp đôi thể tích khí X (đo ở cùng điều kiện). Xác định các công thức phân tử thỏa mãn X.
2. Ba chất hữu cơ mạch hở A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2. Chúng có những tính chất sau:
- Chỉ A và B tác dụng với Na giải phóng khí H2.
- Chỉ B và C tác dụng được với dung dịch NaOH.
- A tác dụng với B (trong điều kiện xúc tác, nhiệt độ thích hợp) thu được sản phẩm là chất C.
Hãy cho biết công thức cấu tạo của A, B, C. Viết các phương trình phản ứng xảy ra.
3. Metan bị lẫn một ít tạp chất là CO2, C2H4, C2H2. Trình bày phương pháp hoá học để loại hết tạp chất khỏi metan.
Câu III: (3,0 điểm)
1. Hòa tan hoàn toàn 0,297 gam hỗn hợp Natri và một kim loại thuộc nhóm IIA trong bảng tuần hoàn các nguyên tố hóa học vào nước. Ta được dung dịch X và 56 ml khí Y (đktc). Xác định kim loại thuộc nhóm IIA và khối lượng của mỗi kim loại trong hỗn hợp.
2. Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500 ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.
a. Viết các phương trình phản ứng xảy ra và tìm giá trị của a.
b. Cho từ từ dung dịch NaOH 2M vào dung dịch Y và khuấy đều đến khi thấy bắt đầu xuất hiện kết tủa thì dùng hết V1 lít dung dịch NaOH 2M, tiếp tục cho tiếp dung dịch NaOH vào đến khi lượng kết tủa không có sự thay đổi nữa thì lượng dung dịch NaOH 2M đã dùng hết 600 ml. Tìm các giá trị m và V1.
Câu IV: (2,0 điểm)
1. Từ tinh bột, các hóa chất vô cơ và điều kiện cần thiết khác có đủ. Viết phương trình hóa học điều chế Etyl axetat ( ghi rõ điều kiện nếu có).
2. Có a gam hỗn hợp X gồm một axit no đơn chức A và một este B. B tạo ra bởi một axit no đơn chức A1 và một rượu no đơn chức C (A1 là đồng đẳng kế tiếp của A). Cho a gam hỗn hợp X tác dụng với lượng vừa đủ NaHCO3, thu được 1,92 gam muối. Nếu cho a gam hỗn hợp X tác dụng với một lượng vừa đủ NaOH đun nóng thu được 4,38 gam hỗn hợp hai muối của 2 axit A, A1 và 1,38 gam rượu C, tỷ khối hơi của C so với hiđro là 23. Đốt cháy hoàn toàn 4,38 gam hỗn hợp hai muối của A, A1 bằng một lượng oxi dư thì thu được Na2CO3, hơi nước và 2,128 lit CO2 (đktc). Giả thiết phản ứng xảy ra hoàn toàn.
a. Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B.
b. Tính a.
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 4
Câu I: (3,0 điểm)
1. Cho lần lượt từng chất: Fe, BaO, Al2O3 và KOH vào lần lượt các dung dịch: NaHSO4, CuSO4. Hãy viết các phương trình phản ứng xảy ra.
2. Một hỗn hợp gồm Al, Fe, Cu và Ag. Bằng phương pháp hoá học hãy tách rời hoàn toàn các kim loại ra khỏi hỗn hợp trên.
3. Có 5 lọ mất nhãn đựng 5 dung dịch: NaOH, KCl, MgCl2, CuCl2, AlCl3. Hãy nhận biết từng dung dịch trên mà không dùng thêm hoá chất khác. Viết các phương trình phản ứng xảy ra.
Câu II: (2,0 điểm)
1. Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm C và H2, trong đó thể tích khí H2 thu được gấp đôi thể tích khí X (đo ở cùng điều kiện). Xác định các công thức phân tử thỏa mãn X.
2. Ba chất hữu cơ mạch hở A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2. Chúng có những tính chất sau:
- Chỉ A và B tác dụng với Na giải phóng khí H2.
- Chỉ B và C tác dụng được với dung dịch NaOH.
- A tác dụng với B (trong điều kiện xúc tác, nhiệt độ thích hợp) thu được sản phẩm là chất C.
Hãy cho biết công thức cấu tạo của A, B, C. Viết các phương trình phản ứng xảy ra.
3. Metan bị lẫn một ít tạp chất là CO2, C2H4, C2H2. Trình bày phương pháp hoá học để loại hết tạp chất khỏi metan.
Câu III: (3,0 điểm)
1. Hòa tan hoàn toàn 0,297 gam hỗn hợp Natri và một kim loại thuộc nhóm IIA trong bảng tuần hoàn các nguyên tố hóa học vào nước. Ta được dung dịch X và 56 ml khí Y (đktc). Xác định kim loại thuộc nhóm IIA và khối lượng của mỗi kim loại trong hỗn hợp.
2. Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500 ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.
a. Viết các phương trình phản ứng xảy ra và tìm giá trị của a.
b. Cho từ từ dung dịch NaOH 2M vào dung dịch Y và khuấy đều đến khi thấy bắt đầu xuất hiện kết tủa thì dùng hết V1 lít dung dịch NaOH 2M, tiếp tục cho tiếp dung dịch NaOH vào đến khi lượng kết tủa không có sự thay đổi nữa thì lượng dung dịch NaOH 2M đã dùng hết 600 ml. Tìm các giá trị m và V1.
Câu IV: (2,0 điểm)
1. Từ tinh bột, các hóa chất vô cơ và điều kiện cần thiết khác có đủ. Viết phương trình hóa học điều chế Etyl axetat ( ghi rõ điều kiện nếu có).
2. Có a gam hỗn hợp X gồm một axit no đơn chức A và một este B. B tạo ra bởi một axit no đơn chức A1 và một rượu no đơn chức C (A1 là đồng đẳng kế tiếp của A). Cho a gam hỗn hợp X tác dụng với lượng vừa đủ NaHCO3, thu được 1,92 gam muối. Nếu cho a gam hỗn hợp X tác dụng với một lượng vừa đủ NaOH đun nóng thu được 4,38 gam hỗn hợp hai muối của 2 axit A, A1 và 1,38 gam rượu C, tỷ khối hơi của C so với hiđro là 23. Đốt cháy hoàn toàn 4,38 gam hỗn hợp hai muối của A, A1 bằng một lượng oxi dư thì thu được Na2CO3, hơi nước và 2,128 lit CO2 (đktc). Giả thiết phản ứng xảy ra hoàn toàn.
a. Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B.
b. Tính a.
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 5
Câu I: (2,5 điểm)
1/ Cho các dung dịch muối A, B, C, D chứa các gốc axit khác nhau.Các muối B, C đốt trên ngọn lửa vô sắc phát ra ánh sáng màu vàng.
- A tác dụng với B thu được dung dịch muối tan, kết tủa trắng E không tan trong nước và axit mạnh, giải phóng khí F không màu, không mùi, nặng hơn không khí. Tỉ khối hơi của F so với H2 bằng 22.
- C tác dụng với B cho dung dịch muối tan không màu và khí G không màu, mùi hắc, gây ngạt, nặng hơn không khí, làm nhạt màu dung dịch nước Brôm.
- D tác dụng với B thu được kết tủa trắng E. Mặt khác D tác dụng với dung dịch AgNO3 tạo kết tủa trắng.
Hãy tìm A, B, C, D, E, F, G và viết các phương trình phản ứng xảy ra.
2/ Viết các phương trình phản ứng xảy ra khi dùng nước vôi để loại bỏ mỗi khí độc sau đây ra khỏi không khí bị ô nhiễm : Cl2 , SO2 , H2S , NO2 .
3/ Hỗn hợp X gồm 4 chất khí sau : CO2, SO3, SO2 và H2. Trình bày phương pháp hoá học nhận ra sự có mặt của các khí trong hỗn hợp X. Viết các phương trình phản ứng xảy ra.
Câu II: ( 2,5 điểm)
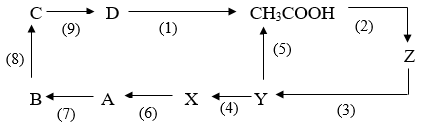
1/ Cho A, B, C, D, X, Y, Z đều là các hợp chất hữu cơ; A, B, C là những hiđrocacbon, C là chất khí có khả năng kích thích quả mau chín và phân tử chứa một liên kết kém bền; X,Y,Z là những muối của axit hữu cơ. Hãy xác định công thức cấu tạo thích hợp của A,B,C,D, X,Y,Z và viết phương trình hóa học theo sơ đồ sau ( ghi rõ điều kiện nếu có):
2/ Hợp chất hữu cơ A có công thức cấu tạo thu gọn: CH2 = CH - CH2 - OH. Hỏi A có thể có những tính chất hóa học nào? Hãy viết phương trình phản ứng minh họa cho những tính chất đó.
3/ Từ đá vôi, than đá, các chất vô cơ và các điều kiện cần thiết viết các phương trình hoá học (ghi rõ điều kiện) điều chế Benzen, Caosubuna.
Câu III: ( 3,0 điểm)
1/ A là hỗn hợp gồm M2CO3, MHCO3, MCl (M là kim loại hóa trị I trong hợp chất). Cho 43,71 gam hỗn hợp A tác dụng hết với V ml dung dịch HCl 10,52% (D = 1,05 g/ml) lấy dư thu được dung dịch B và 17,6 gam khí C. Chia dung dịch B thành 2 phần bằng nhau:
- Phần 1: Phản ứng vừa đủ với 125 ml dung dịch KOH 0,8M. Cô cạn dung dịch thu được m gam muối khan.
- Phần 2: Tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 68,88 gam kết tủa trắng.
a/ Xác định tên kim loại M và phần trăm khối lượng mỗi chất trong A.
b/ Tìm m và V.
2/ Hoà tan 16,8 (gam) một kim loại M vào dung dịch HCl dư thu được 6,72 lit khí H2 (đktc).
a. Tìm kim loại M.
b. Hoà tan 25,2 (gam) kim loại M vào dung dịch H2SO4 10% ( loãng), vừa đủ. Sau khi kết thúc phản ứng thu được dung dịch A. Làm lạnh dung dịch A thu được 55,6 (gam) muối sunfat kết tinh ngậm nước của kim loại M tách ra và còn lại dung dịch muối sunfat bão hoà có nồng độ 9,275%.
Tìm công thức của muối sunfat ngậm nước của kim loại M.
Câu IV: ( 2 điểm)
1/ Hỗn hợp khí X gồm C2H6 , C3H6 , C4H6. Tỉ khối hơi của X so với H2 bằng 21.Đốt cháy hoàn toàn 2,24 lít hỗn hợp X (ở đktc) rồi dẫn toàn bộ sản phẩm thu được lần lượt qua bình 1 đựng H2SO4đặc và bình 2 đựng dung dịch KOH dư thì khối lượng tăng lên ở bình 1 và bình 2 là m1(gam), m2(gam).Tính các giá trị m1, m2
2/ Este E tạo bởi một axit X đơn chức, mạch hở, không no (chứa 1 liên kết đôi C=C ) và một ancol Y no, ba chức, mạch hở. Trong phân tử của E nguyên tố Cacbon chiếm 56,69% khối lượng.
Tìm công thức phân tử và viết công thức cấu tạo của E. (Biết E chỉ chứa một loại nhóm chức duy nhất).
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
Trên đây là phần trích dẫn nội dung Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Tây Sơn, để xem nội dung đềy đủ, chi tiết vuii lòng truy cập vào hệ thống hoc247.net!
Ngoài ra các em học sinh có thể tham khảo thêm một số tài liệu cùng chuyên mục khác tại đây:
- Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Tiểu La
- Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Lý Thường Kiệt
- Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Phan Đình Phùng
Chúc các em học tập tốt!











