Nhằm hỗ trợ các em học sinh ôn tập thật tốt trong kì thi sắp tới HỌC247 xin giới thiệu đến các em Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Chuyên Bắc Ninh. Hy vọng đây sẽ là tài liệu bổ trợ kiến thức đắc lực cho các em. Mời các em cùng tham khảo!
|
TRƯỜNG THPT CHUYÊN BẮC NINH |
ĐỀ THI THỬ TUYỂN SINH VÀO LỚP 10 MÔN HÓA HỌC THỜI GIAN 90 PHÚT |
ĐỀ SỐ 1
Câu I (2,0 điểm)
1/ Cho các sơ đồ phản ứng:
Oxit (X1) + dung dịch axit (X2) → (X3) + …
Oxit (Y1) + dung dịch bazơ (Y2) → (Y3) + …
Muối (Z1) → (X1) + (Z2) + …
Muối (Z1) + dung dịch axit (X2) → (X3) + …
Biết khí X3 có màu vàng lục, muối Z1 màu tím, phân tử khối của các chất thoả mãn điều kiện: MY1 + MZ1 = 300; MY2 – MX2 = 37,5. Xác định các chất X1, X2, X3, Y1, Y2. Y3, Z1, Z2. Viết các phương trình hoá học minh hoạ.
2/ Có 3 mẫu phân bón hoá học ở thể rắn đựng trong các lọ riêng biệt không ghi nhãn là NH4NO3, NH4Cl và (NH4)2SO4. Hãy phân biệt các mẫu phân bón trên bằng phương pháp hoá học, viết phương trình hoá học minh hoạ.
Câu II:
1/ Đốt cháy hoàn toàn 15,68 gam kim loại M trong bình đựng khí clo dư thu được 45,5 gam muối clorua.
a) Xác định tên kim loại M.
b) Để hoà tan hoàn toàn 9,2 gam hỗn hợp X gồm kim loại M và một oxit của kim loại M cần dùng vừa hết 160ml dung dịch HCl 2M, còn nếu dẫn luồng H2 dư đi qua 9,2 gam hỗn hợp X nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được 7,28 gam chất rắn. Tìm công thức của oxit kim loại trong hỗn hợp X.
2/ Hoà tan hết 11,1 gam hỗn hợp A gồm Al và Fe trong 200 gam dung dịch H2SO4 19,6% (loãng) thu được dung dịch B và 6,72 lít H2(đktc). Thêm từ từ 420 ml dung dịch Ba(OH)2 1M vào dung dịch B, sau phản ứng lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn khan.
a) Viết các phương trình hoá học xảy ra.
b) Tính thành phần phần trăm theo khối lượng các chất trong hỗn hợp A và tính giá trị của m.
Câu III:
1/ Trong một bình kín dung tích không đổi chứa hỗn hợp X gồm 0,07 mol CHºCH; 0,05 mol CHºC–CH=CH2; 0,1 mol H2 và một ít bột Ni. Nung nóng bình để thực hiện phản ứng thu được hỗn hợp Y gồm 7 hiđrocacbon có tỉ khối hơi đối với H2 là 19,25. Bằng phương pháp thích hợp tách lượng hỗn hợp Y thu được m gam hỗn hợp Y1 (gồm CHºCH và CHºC–CH=CH2) và 1,568 lít hỗn hợp khí Y2 (đktc) gồm 5 hiđrocacbon. Biết toàn bộ lượng hỗn hợp Y2 tách được có khả năng phản ứng với tối đa 600 ml dung dịch Br2 0,1M. Tìm giá trị của m.
2/ Hỗn hợp M gồm hai chất hữu cơ A và B (phân tử A có nhiều hơn phân tử B một nguyên tử cacbon). Tỉ khối của M với H2 là 13,5. Đốt cháy hoàn toàn 12,96 gam hỗn hợp M bằng lượng khí oxi dư thu được sản phẩm cháy gồm H2O và 36,96 gam CO2.
a) Tìm công thức phân tử và tính thành phần phần trăm theo khối lượng mỗi chất có trong hỗn hợp M/
b) Khi dẫn toàn bộ sản phẩm cháy vào 552,9 gam dung dịch Ba(OH)2 20,72% thu được m gam chất kết tủa và dung dịch Z. Tìm giá trị của m và tính nồng độ C% của chất tan có trong dung dịch Z.
Câu IV:
1/ Hoà tan hoàn toàn 8,56 gam một muối clorua vào nước thu được 200 ml dung dịch Y. Lấy 25 ml dung dịch Y đem tác dụng với dung dịch AgNO3 dư thu được 2,87 gam muối kết tủa trắng.
a) Tìm công thức hoá học của muối clorua đã dùng (muối X).
b) Từ muối X, viết các phương trình hoá học thực hiện sơ đồ:
.png?enablejsapi=1)
2/ Cho m gam hỗn hợp A gồm Fe và Mg tác dụng với dung dịch HCl dư thu được 3,808 lít H2 (đktc). Mặt khác nếu cho m gam hỗn hợp A vào 200 ml dung dịch chứa AgNO3 0,5M và Cu(NO3)2 0,8M, phản ứng xong, lọc bỏ phần chất rắn thu được dung dịch B chứa ba muối. Khi thêm dung dịch NaOH dư vào dung dịch B rồi lọc bỏ kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được 10,4 gam chất rắn. Tìm giá trị của m và tính khối lượng mỗi muối trong dung dịch B.
ĐÁP ÁN ĐỀ SỐ 1
Câu I.
1/ Muối Z1 có màu tím nên chọn là KMnO4; khí X3 màu vàng lục nên chọn là Cl2.
MY1 = 300 – 158 = 142 nên chọn Y1 là P2O5
X2, Y2 chọn là HCl và Ca(OH)2 vì MCa(OH)2 – MHCl = 74 – 36,5 = 37,5 (TM)
X1 là MnO2, Y3: Ca3(PO4)2, Z2: O2
PT: MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O
P2O5 + Ca(OH)2 → Ca3(PO4)2 + H2O
2KMnO4 → MnO2 + O2 + K2MnO4
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
2/ Hoà mẫu thử các phân bón vào nước được các dung dịch NH4NO3, NH4Cl và (NH4)2SO4.
Cho mẫu các dung dịch trên tác dụng với dung dịch BaCl2, mẫu nào tạo kết tủa trắng với BaCl2 là (NH4)2SO4, 2 mẫu còn lại không có hiện tượng gì là NH4Cl, NH4NO3.
PT: (NH4)2SO4 + BaCl2 → BaSO4 + H2O
Cho mẫu thử 2 dd còn lại tác dụng với dung dịch AgNO3, mẫu nào tạo kết tủa trắng với AgNO3 là NH4Cl, mẫu còn lại không có hiện tượng gì là NH4NO3
PT: NH4Cl + AgNO3 → AgCl + H2O
Câu II.
1/ a) Đặt hoá trị của M là n.
PT: 2M + nCl2 (t°) → 2MCln
Theo PT: M (g) – – – – – – → M + 35,5n (g)
Theo đề bài: 15,68(g) – – – – – → 45,5 (g)
→ 15,68 (M + 35,5n) = 45,5M → M = \(\frac{{{\text{56}}}}{{\text{3}}}\)n
Thử chọn ta được n = 3 → M = 56 (Fe)
b) Gọi CT của oxit là FexOy Þ Hỗn hợp X gồm Fe và FexOy.
Dẫn H2 qua X có p/ứ: FexOy + yH2 (t°) → xFe + yH2O (1)
Ta thấy mch/r giảm = moxi trong oxit p/ứ = 9,2 – 7,28 = 1,92 gam Þ nO = 0,12 mol
\(\sum {{{\text{n}}_{{\text{Fe}}}}} = \frac{{{\text{7,28}}}}{{{\text{56}}}} = 0,13\) mol
Hoà tan X bằng dung dịch HCl:
FexOy + 2yHCl → xFeCl2y/x + yH2 (hoặc: FexOy + 2yHCl → FexCl2y + yH2) (2)
Fe + 2HCl → FeCl2 + H2 (3)
Theo PT (2): nHCl(2) = 2nO = 2.0,12 = 0,24 mol
Mà \(\sum {{{\text{n}}_{{\text{HCl}}}}} \) = 0,16.2 = 0,32 mol Þ nHCl(3) = 0,32 – 0,24 = 0,08 mol
→ nFe(3) = 0,04 mol → nFe trong oxit = 0,13 – 0,04 = 0,09 mol
x : y = nFe : nO = 0,09 : 0,12 = 3 : 4 → x = 3; y = 4. CT oxit là Fe3O4
2/ nH2 = 0,3 mol; nH2SO4 = 0,4 mol; nBa(OH)2 = 0,42 mol
PT: Fe + H2SO4 → FeSO4 + H2 (1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2)
Theo các PT (1)(2) ta có: \({{\text{n}}_{{{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}}}\) p/ứ = nH2 = 0,3 mol < 0,4 mol → nH2SO4 dư = 0,1 mol
Đặt nAl = x; nFe = y
Ta có các phương trình đại số: \(\left\{ \begin{gathered}
\frac{3}{2}x + y = 0,3 \hfill \\
27x + 56y = 11,1 \hfill \\
\end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered}
x = 0,1 \hfill \\
y = 0,15 \hfill \\
\end{gathered} \right.\)
Từ đó tính được %mAl = 24,32%; %mFe =75,68%
nAl2(SO4)3 = 0,05 mol; n FeSO4 = 0,15 mol
Cho Ba(OH)2 vào dung dịch sau phản ứng:
Đầu tiên H2SO4 + Ba(OH)2 → BaSO4 + 3H2O (3)
0,1 – – – → 0,1
Sau đó: Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3 (4)
0,05 – – – → 0,15 → 0,1
FeSO4 + Ba(OH)2 → BaSO4 + Fe(OH)2 (5)
0,15 – – –→ 0,15 → 0,15
Nếu các phản ứng (3)(4)(5) xảy ra hoàn toàn thì
\(\sum {{{\text{n}}_{{\text{Ba(OH}}{{\text{)}}_{\text{2}}}}}} \) cần = 0,1 + 0,15 + 0,15 = 0,4 mol < ban đầu → dư = 0,02 mol
Có tiếp phản ứng: Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Theo PT: 1 : 2
Theo đb: 0,02 : 0,1
→ Ba(OH)2 hết, Al(OH)3 dư. dư = 0,1 – 0,02 x 2 = 0,06 mol
Chất rắn sau phản ứng gồm:
2Al(OH)3 (t°) → Al2O3 + 3H2O
0,06 – – – – – → 0,03
4Fe(OH)2 + O2 (t°) → 2Fe2O3 + 4H2O
0,15– – – – – – – – – → 0,075
BaSO4 ––––––––––– BaSO4
\({{\text{n}}_{{\text{BaS}}{{\text{O}}_{\text{4}}}}}\) = \({{\text{n}}_{{\text{Ba(OH}}{{\text{)}}_{\text{2}}}}}\) (3)(4)(5) = 0,4 mol → m = 108,26 gam
Câu III.
1/ Sơ đồ: \(\left\{ \begin{gathered}
{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{2}}}(0,07{\text{mol}}) \hfill \\
{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{4}}}{\text{(0,05mol)}} \hfill \\
{{\text{H}}_{\text{2}}}{\text{(0,1 mol)}} \hfill \\
\end{gathered} \right.\xrightarrow{{{\text{Ni,}}{{\text{t}}^{\text{o}}}}}\left\{ \begin{gathered}
{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{2}}};{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{4}}}{\text{(hh }}{{\text{Y}}_{\text{1}}}) \hfill \\
{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}{\text{;}}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{6}}}{\text{;}}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{6}}};{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{8}}}{{\text{C}}_{\text{4}}}{{\text{H}}_{{\text{10}}}}({\text{hh }}{{\text{Y}}_{\text{2}}})\xrightarrow{{{\text{B}}{{\text{r}}_{\text{2}}}}} \hfill \\
\end{gathered} \right.\) → tối đa 0,6mol Br2
Theo ĐLBTKL: mY = mX = 0,07.26 + 0,05.52 + 0,1.2 = 4,62gam
\({\overline {\text{M}} _{\text{Y}}} = 19,25.{{\text{M}}_{{{\text{H}}_{\text{2}}}}} = 38,5({\text{g)}}\) → nY = 0,12 mol
Mà \({{\text{n}}_{{{\text{Y}}_{\text{2}}}}} = 0,07 \to {{\text{n}}_{{{\text{Y}}_{\text{1}}}}} = 0,12 - 0,07 = 0,05\)
\({{\text{n}}_{{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{2}}},{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{4}}}}}\) p/ứ = 0,07 + 0,05 – 0,05 = 0,07 mol
(số mol bđầu) (nY2)
Đặt nC2H2 p/ứ = x mol; nC4H4 p/ứ = y mol. Ta có PT: x + y = 0,07 (*)
Ta thấy cứ 1 mol Br2 phản ứng cũng tương đương với 1 mol H2 phản ứng. Do đó lượng H2 cần để phản ứng hết với lượng C2H2 và C4H4 ở trên để tạo ra hiđrocacbon no là 0,1 + 0,06 = 0,16 mol.
PT: C2H2 + 2H2 → C2H6 ; C4H4 + 3H2 → C4H10
x → 2x y → 3y
Ta có PT: 2x + 3y = 0,16 (**)
Giải hệ (*)(**) ta được x = 0,05; y = 0,02
→ m = (0,07 – 0,05).26 + (0,05 – 0,02).52 = 2,08 gam
2/ a) Ta có: \({\overline {\text{M}} _{\text{M}}} = 13,5.{{\text{M}}_{{{\text{H}}_{\text{2}}}}} = 27({\text{g)}}\) → nM = 0,48 mol; nCO2 = 0,84 mol.
Vì đốt cháy hỗn hợp M chỉ thu được CO2 và H2O nên các chất trong M chỉ gồm các ng.tố C, H, O.
Nếu gọi CT chung của các chất trong M là \({{\text{C}}_{\overline {\text{x}} }}{{\text{H}}_{\overline {\text{y}} }}{{\text{O}}_{\overline {\text{z}} }}\) thì ta có sơ đồ:
\({{\text{C}}_{\overline {\text{x}} }}{{\text{H}}_{\overline {\text{y}} }}{{\text{O}}_{\overline {\text{z}} }} \to {\text{ }}\overline {\text{x}} {\text{C}}{{\text{O}}_{\text{2}}}\)
0,48 → 0,84 → x = 1,75.
Do 1 phân tử A hơn 1 phân tử B 1 nguyên tử C nên số C của A, B lần lượt là 2 và 1.
→ CTTQ của A, B có dạng: C2HaOb và CHmOn (a, m là số tự nhiên chẵn; b, n ÎN)
Đặt nA = c mol; nB = d mol, ta có hệ PT: \(\left\{ \begin{gathered}
c + d = 0,48 \hfill \\
2c + d = 0,84 \hfill \\
\end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered}
c = 0,36 \hfill \\
d = 0,12 \hfill \\
\end{gathered} \right.\)
*Nếu MA < 27 thì: 2.12 + a + 16b < 27 Þ a + 16b < 3 Þ a = 2; b = 0
CT của A là C2H2. Ta có mM = 12,96 gam = 0,36.26 + 0,12. MB
→ MB = 30 → 12 + m + 16n = 30 → m + 16n = 18 → \(\left\{ \begin{gathered}
m = 2 \hfill \\
n = 1 \hfill \\
\end{gathered} \right.\)
CT của B là CH2O.
Từ đó tính ra: %mA =72,22%; %mB = 27,78%.
*Nếu MB < 27 thì: 12 + m + 16n < 27 → m + 16n < 15 → m = 4; n = 0.
CT của B là CH4. Ta có mM = 12,96gam = 0,36.MA + 0,12.16 → MA = 30,67 (loại)
b) Khi đốt cháy thì 1 mol C2H2 và hay CH2O đều cho 1 mol H2O Þ nH2O = nhhM = 0,48 mol.
nBa(OH)2 = 0,67 mol. Ta có: \(0,5 < \frac{{{{\text{n}}_{{\text{Ba(OH}}{{\text{)}}_{\text{2}}}}}}}{{{{\text{n}}_{{\text{C}}{{\text{O}}_{\text{2}}}}}}} = \frac{{0,67}}{{0,84}} < 1\) CO2 phản ứng với Ba(OH)2 tạo 2 muối.
CO2 + Ba(OH)2 → BaCO3 + H2O
Đặt: z mol – → z – – – → z
2CO2 + Ba(OH)2 → Ba(HCO3)2
Đặt 2t mol – – → t – – – – → t
Ta có hệ PT: \(\left\{ \begin{gathered}
z + t = 0,67 \hfill \\
z + 2t = 0,84 \hfill \\
\end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered}
z = 0,5 \hfill \\
t = 0,17 \hfill \\
\end{gathered} \right.\)
Ta có m = 98,5 gam
Dung dịch sau phản ứng là dung dịch Ba(HCO3)2.
\({{\text{m}}_{{\text{Ba(HC}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{2}}}}}\) = 0,17.259 = 44,03 g
\({{\text{m}}_{{\text{dd Ba(HC}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{2}}}}} = {{\text{m}}_{{\text{dd Ba(OH}}{{\text{)}}_{\text{2}}}}}\) + mCO2 + mH2O – mBaCO3 = 552,9 + 36,96 + 0,48.18 – 98,5 = 500 gam.
C% dd Z = \(\frac{{44,03}}{{500}}.100\% = 8,806\% \)
Câu IV:
1/ a) Đặt CT của muối Clorua là RCln. Trong 25ml dung dịch Y có chứa: mRCln= (g)
PT: RCln + nAgNO3 → R(NO3)n + nAgCl
Ở đây chỉ có kết tủa là AgCl vì tất cả các muối Nitrat đều tan Þ nAgCl = 0,02 mol.
Theo PT ta có: \({n_{RCln}} = \frac{{\text{1}}}{{\text{n}}}{n_{AgCl}} = \;\frac{{0,02}}{{\text{n}}} \to 1,07{\text{ }} = \frac{{0,02}}{{\text{n}}}\left( {R + 35,5n} \right) \to R{\text{ }} = {\text{ }}18n.\)
Thử chọn thấy có n = 1 → R= 18 (NH4).
→ CT muối X là NH4Cl.
b)
PT khó: H2Ohơi + Cnóng đỏ → CO + H2
2/ PT…
Nhìn chung qua quá trình phản ứng thì 3 muối còn lại sẽ là: Cu(NO3)2dư, Fe(NO3)2; Mg(NO3)2 và các kim loại Mg, Fe đều phản ứng hết.
Sơ đồ phản ứng tiếp theo:
\(\begin{gathered}
\left\{ \begin{gathered}
{\text{Mg(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{2}}} \hfill \\
{\text{ x}} \hfill \\
{\text{Fe(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{2}}} \hfill \\
{\text{ y}} \hfill \\
{\text{Cu(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{2}}} \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{\text{Mg(OH}}{{\text{)}}_{\text{2}}} \hfill \\
\hfill \\
{\text{Fe(OH}}{{\text{)}}_{\text{2}}} \hfill \\
\hfill \\
{\text{Cu(OH}}{{\text{)}}_{\text{2}}} \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{\text{MgO}} \hfill \\
{\text{ x}} \hfill \\
{\text{1/2F}}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}} \hfill \\
{\text{ y/2}} \hfill \\
{\text{CuO}} \hfill \\
\end{gathered} \right. \hfill \\
{\text{ z z}} \hfill \\
\end{gathered} \)
Ta có các PT: nH2 = x + y = 0,17
mch/r = 40x + 80y + 80z = 10,4 g
Bảo toàn số mol nguyên tử N trong các muối:
nN-AgNO3 + nN-Cu(NO3)2 = nN-Fe(NO3)2 + nN-Mg(MO3)2 Þ 0,1.1 + (0,16 – z).2 = 2x + 2y
Từ đó giải ra x = 0,16; y = 0,01; z = 0,04
→ m = 0,16.24 + 0,01.56 = 4,4 gam.
Khối lượng các muối là: 23,68g; 1,8g; 7,52 g
ĐỀ SỐ 2
Câu 1: Cho sơ đồ biến hoá :
.png)
Tìm công thức các chất A1, A2, A3, B1, B2, B3, X, Y, Z, T . Viết các phương trình phản ứng .
Câu 2: Có 5 dung dịch: HCl ; NaOH; Na2CO3; BaCl2; NaCl. Cho phép dùng quỳ tím hãy trình bày cách nhận biết các dung dịch trên, biết rằng dung dịch Na2CO3 cũng làm quỳ tím hoá xanh.
Câu 3: Viết phương trình phản ứng xảy ra (nếu có) khi cho các chất Al, Fe3O4, Al2O3 lần lượt tác dụng với các dung dịch H2SO4 loãng, dung dịch KOH .
Câu 4: Đốt cháy hoàn toàn V (lít) mê tan (đktc). Cho tất cả sản phẩm cháy hấp thụ vào bình đựng 500ml dung dịch Ba(OH)2 0,2 M thấy tạo thành 15,76 gam kết tủa .
a. Tính thể tích V.
b. Khối lượng dung dịch trong bình tăng hay giảm bao nhiêu gam?
Câu 5: Hoà tan hết 4 gam một kim loại M vào 96,2 gam nước thu được dung dịch bazơ có nồng độ 7,4% và V lít khí (đktc).Xác định kim loại M.
Câu 6: Cho 23,8 gam hỗn hợp X (Cu, Fe, Al) tác dụng vừa đủ 14,56 lít khí Cl2 ( đktc). Mặt khác cứ 0,25 Mol hỗn hợp tác dụng với dung dịch HCl dư thu được 0,2 Mol khí ( đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X.
Câu 7: Chia 39,6 gam hỗn hợp rượu etylic và rượu A có công thức CnH2n(OH)2 thành hai phần bằng nhau. Lấy phần thứ nhất tác dụng hết với Na thu được 5,6 lít H2 (đktc). Đốt cháy hết hoàn toàn phần thứ hai thu được 17,92 lít CO2 ( đktc). Tìm công thức phân tử rượu A.
Câu 8: Hoà tan 4 gam hỗn hợp Fe và một kim loại hoá trị 2 vào dung dịch HCl dư thu được 2,24 lít khí H2 (đktc). Nếu chỉ dùng 2,4 gam kim loại hoá trị 2 cho vào dung dịch HCl thì dùng không hết 500ml dung dịch HCl 1M. Tìm kim loại hoá trị 2 .
Câu 9: Đốt cháy hoàn toàn 0,324 gam hợp chất hữu cơ X (C, H, O )sản phẩm cháy dẫn qua bình chứa 380 ml dung dịch Ba (OH)2 0,05 M ta thấy kết tủa bị tan một phần đồng thời khối lượng bình tăng 1,14 gam. Còn nếu sản phẩm cháy dẫn qua 220 ml dung dịch Ba(OH)2 0,1M thì thu kết tủa cực đại.
Tìm công thức phân tử của X, biết MX = 108 .
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 3
Câu 1.
1. Một hỗn hợp X gồm các chất: K2O, KHCO3, NH4Cl, BaCl2 có số mol mỗi chất bằng nhau. Hoà tan hỗn hợp X vào nước, rồi đun nhẹ thu được khí Y, dung dịch Z và kết tủa M. Xác định các chất trong Y, Z, M và viết phương trình phản ứng minh họa.
2. Cho sơ đồ biến hóa :
.png)
Biết rằng A + HCl D + G + H2O . Tìm các chất ứng với các chữ cái A, B…và viết các phương trình hóa học.
Câu 2.
1. Hòa tan 3,38 gam oleum X vào lượng nước dư ta được dung dịch A. Để trung hòa 1/20 lượng dung dịch A cần dùng 40 ml dung dịch NaOH 0,1 M . Tìm công thức của oleum.
2. Chỉ được dùng thêm 1 thuốc thử và các ống nghiệm, hãy trình bày phương pháp hóa học nhận ra các dung dịch bị mất nhãn NaHSO4, Na2CO3, NaCl, BaCl2, Na2S.
Câu 3.
1. Polime X chứa 38,4% cacbon; 56,8% clo và còn lại là hydro về khối lượng. Xác định công thức phân tử, viết công thức cấu tạo của X và gọi tên, cho biết trong thực tế X dùng để làm gì?
2. Từ metan và các chất vô cơ cần thiết khác. Hãy viết các phương trình phản ứng hoá học (ghi rõ điều kiện) để điều chế X nói trên.
Câu 4. Cho 6,72 lít hỗn hợp khí gồm một ankan và một olefin đi qua dung dịch Brom thấy khối lượng bình Brom tăng 4,2 gam và thoát ra 4,48 lít khí. Đốt cháy khí thoát ra thu được 8,96 lít khí CO2. Xác định công thức phân tử của các hiđrocacbon, biết thể tích các khí đo ở đktc.
Câu 5. Hòa tan hoàn toàn 9,18 gam Al nguyên chất cần V lít dung dịch axit HNO3, nồng độ 0,25M, thu được một khí X và một dung dịch muối Y. Biết trong X số nguyên tử của nguyên tố có sự thay đổi số oxihóa là 0,3612.1023 (số Avogadro là 6,02.1023). Để phản ứng hoàn toàn với dung dịch Y tạo ra một dung dịch trong suốt cần 290 gam dung dịch NaOH 20%.
1. Xác định khí X và viết các phương trình phản ứng xảy ra?
2. Tính V?
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 4
Câu 1: Polime X chứa 38,4% cacbon; 56,8% clo và còn lại là hydro về khối lượng. Xác định công thức phân tử, viết công thức cấu tạo của X và gọi tên, cho biết trong thực tế X dùng để làm gì?
Câu 2: Thổi dòng khí CO đi qua ống sứ chứa 6,1 gam hỗn hợp A gồm CuO, Al2O3 và một oxit của kim loại R đốt nóng, tới khi phản ứng hoàn toàn thì chất rắn còn lại trong ống có khối lượng 4,82 gam. Toàn bộ lượng chất rắn này phản ứng vừa đủ với 150 ml dung dịch HCl 1M. Sau phản ứng thấy thoát ra 1,008 lít khí H2 (ở đktc) và còn lại 1,28 gam chất rắn không tan.
1. Viết các phương trình phản ứng xảy ra.
2. Xác định kim loại R và công thức oxit của R trong hỗn hợp A.
Câu 3: Chất hữu cơ E được tạo bởi ba loại nguyên tố và chỉ chứa một loại nhóm chức, trong đó hydro chiếm 6,85%; oxi chiếm 43,84% khối lượng của E. Khối lượng mol của E nhỏ hơn 250 gam. Lấy 4,38 gam E cho tác dụng với dung dịch NaOH vừa đủ, sản phẩm gồm ancol và 4,92 gam muối.
Tìm công thức phân tử và viết công thức cấu tạo của E.
Câu 4: Đốt cháy hoàn toàn 12 gam muối sunfua của kim loại R hóa trị 2 thu được chất rắn A và khí B. Hòa tan hết A bằng một lượng vừa đủ dung dịch H2SO4 24,5% thu được dung dịch muối có nồng độ 33,33%. Khi làm lạnh dung dịch muối xuống nhiệt độ thấp hơn thì có một lượng tinh thể muối ngậm nước tách ra có khối lượng 15,625 gam. Dung dịch bão hòa còn lại tại nhiệt độ đó có nồng độ 22,54%.
Xác định R và công thức muối tinh thể ngậm nước.
Câu 5: Độ tan của MgSO4 ở 200C là 35,5; ở 500C là 50,4. Có 400 gam dung dịch MgSO4 bão hoà ở 200C, nếu đun nóng dung dịch này đến 500C thì khối lượng muối MgSO4 cần hoà tan thêm để tạo dung dịch muối bão hoà ở 500C là bao nhiêu gam ?
Câu 6: Hoà tan hoàn toàn 30 gam hỗn hợp X gồm Mg, Al, Zn trong dung dịch HNO3, thu được dung dịch Y và 4,48 lít hỗn hợp khí Z ở đktc gồm N2O và NO có tỉ khối so với hydro là 18,5. Cô cạn dung dịch Y thu được 127 gam hỗn hợp muối khan.
1. Viết các phương trình phản ứng xảy ra.
2. Tính số mol HNO3 bị khử trong các phản ứng trên?
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 5
Câu 1. (2,0 điểm)
1. Hãy chọn 1 đơn chất, 1 oxit, 1 hidroxit và 2 muối khác loại nhau đều tác dụng được với cả dung dịch HCl và dung dịch NaOH. Viết các phương trình phản ứng.
2. Hãy nêu phương pháp loại bỏ khí có lẫn trong khí khác và viết các phương trình hóa học
a). CO2 có lẫn trong CO.
b). SO2 có lẫn trong C2H4.
c). SO3 có lẫn trong SO2.
d). SO2 có lẫn trong CO2.
3. Có 5 ống nghiệm đựng 5 chất bột riêng biệt gồm: Mg(OH)2, Al(OH)3, BaCl2, Na2CO3, NaOH. Chỉ được dùng thêm H2O và CO2 hãy trình bày cách nhận biết các chất đó.
Câu 2.
1. Cho sơ đồ:
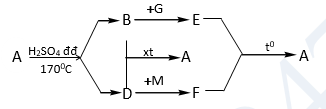
Xác định A, B, D, E, F, G, M (là ký hiệu các chất hữu cơ, vô cơ khác nhau), viết các phương trình phản ứng. Biết: A có thể điều chế từ tinh bột và được dùng để pha chế xăng sinh học E5.
2. Tìm các chất vô cơ thích hợp, hoàn thành các phương trình phản ứng sau:
a). (A) + (B) (C) rắn, đen
b). (C) + HCl → (D) + (E)
c). (A) + HCl → (D) + (F)
d). (F) + (B) → (E)
e). (G) + (E) → (I) + H2O
f). (I) + FeSO4 → (C) + (J)
3. Có các chất lỏng A, B, D, E, F không theo thứ tự gồm: Benzen, ancol etylic, axit axetic, dung dịch glucozơ, nước. Biết kết quả của những thí nghiệm như sau:
- Cho tác dụng với Na thì E không phản ứng.
- Cho tác dụng với CaCO3 thì chỉ có D phản ứng, có khí thoát ra.
- Cho tác dụng với dung dịch AgNO3/NH3 (hay Ag2O/ NH3) thì B phản ứng tạo ra bạc.
- Khi đốt trong không khí thì A không cháy.
Xác định A, B, D, E, F (không cần viết các phương trình phản ứng).
Câu 3.
1. Có hỗn hợp Na, Ba, Fe, Cu. Bằng phương pháp hóa học hãy tách riêng mỗi kim loại ra khỏi hỗn hợp (khối lượng mỗi kim loại không thay đổi).
2. A, B, D là các nguyên tố rất phổ biến trong tự nhiên. Hợp chất tạo bởi A và D khi hoà tan trong nước cho một dung dịch có tính kiềm. Hợp chất của A và B khi hoà tan vào nước có khí thoát ra. Hợp chất của B và D khi hoà tan trong nước cho dung dịch E có tính axit rất yếu. Hợp chất của A, B, D không tan trong nước nhưng tan trong dung dịch E. Xác định hợp chất tạo bởi A với D; A với B, B với D và A, B, D. Viết phương trình phản ứng.
3. Cho các chất Al2O3, Al(NO3)3, NaAlO2, Al2(SO4)3, Al(OH)3, AlCl3, Al. Hãy lựa chọn và sắp xếp các chất trên thành một dãy chuyển hoá (theo sơ đồ thẳng X → Y → Z → ….T). Viết phương trình phản ứng minh họa (ghi rõ điều kiện nếu có).
Câu 4.
1. Hỗn hợp X gồm M và R2O, trong đó M là kim loại thuộc nhóm IIA và R là kim loại kiềm. Cho m gam hỗn hợp X tan hết vào 400 ml dung dịch HCl 2M (dư), thu được dung dịch Y chứa 38 gam các chất tan có cùng nồng độ mol.
a. Viết các phương trình phản ứng.
b. Xác định kim loại M và R.
2. Cho m gam Al2O3 tác dụng với dung dịch HCl dư thu được dung dịch X chứa 2 chất tan có cùng nồng độ mol. Rót từ từ dung dịch NaOH vào dung dịch X, đồ thị biến thiên số mol kết tủa theo số mol NaOH như sau:
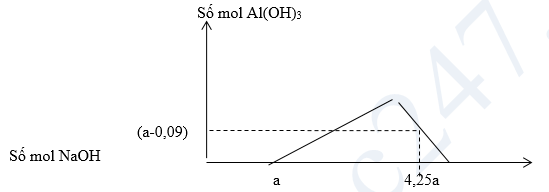
Viết các phương trình phản ứng, tính giá trị của m.
Câu 5.
1. Hỗn hợp A gồm ankin X, anken Y và hidrocacbon Z, đốt cháy hoàn toàn m gam A thu được 20,16 lít CO2 (đktc) và 16,2 gam H2O. Dẫn m gam A đi qua bình đựng dung dịch brom dư thấy có 0,4 mol Br2 phản ứng. Khí thoát ra khỏi bình brom đem đốt cháy hoàn toàn thu được 13,2 gam CO2 và 7,2 gam H2O. Xác định công thức phân tử của X, Y, Z, tính % thể tích của mỗi chất trong A.
2. Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 2 mol axit phản ứng, còn lại 0,264a gam chất rắn không tan. Mặt khác khử hoàn toàn a gam hỗn hợp A bằng H2 dư nung nóng, thu được 84 gam chất rắn.
a. Viết các phương trình phản ứng.
b. Tính % khối lượng Cu trong hỗn hợp A.
Trên đây là phần trích dẫn nội dung Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Chuyên Bắc Ninh, để xem nội dung đềy đủ, chi tiết vuii lòng truy cập vào hệ thống hoc247.net!
Ngoài ra các em học sinh có thể tham khảo thêm một số tài liệu cùng chuyên mục khác tại đây:
- Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Tiểu La
- Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Lý Thường Kiệt
- Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Phan Đình Phùng
Chúc các em học tập tốt!
Tài liệu liên quan
Tư liệu nổi bật tuần
- Xem thêm











