Bảng tuần hoàn có nguyên tắc sắp xếp và cấu tạo như thế nào ? Để biết chi tiết, HOC247 xin chia sẻ với các bạn Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học môn Khoa học tự nhiên 7 SGK Kết nối tri thức. Với kiến thức trọng tâm và các bài tập có lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Tóm tắt lý thuyết
1.1. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
- Năm 1869, Men-đê-lê-ép (D. I. Mendeleev) (1834 - 1907), nhà bác học người Nga đã xây dựng bảng tuần hoàn các nguyên tố hoá học theo chiều tăng dần khối lượng nguyên tử. Sau đó, các nhà khoa học đã chứng minh rằng điện tích hạt nhân nguyên tử mới là cơ sở để xây dựng bảng tuần hoàn các nguyên tố hoá học.
- Ngày nay, bảng tuần hoàn các nguyên tố hoá học (gọi tắt là bảng tuần hoàn) gồm 118 nguyên tố hoá học, được xây dựng theo nguyên tắc sau:
+ Các nguyên tố hoá học được xếp theo chiều tăng dần của điện tích hạt nhân.
+ Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng cột có tính chất gần giống nhau.
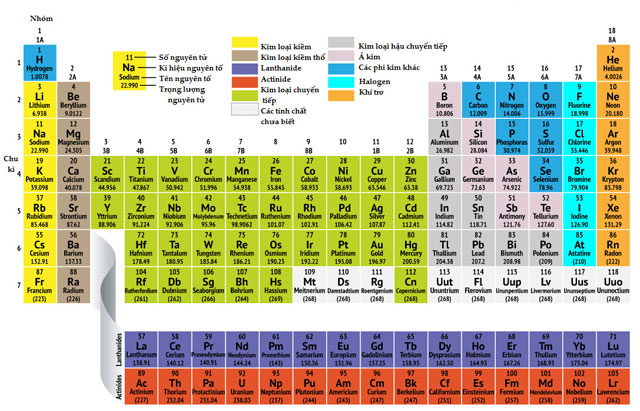
Bảng tuần hoàn các nguyên tố hóa học
|
- Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. - Các nguyên tố cùng chu kì có cùng số lớp electron, các nguyên tố cùng nhóm có tính chất gần giống nhau. |
|---|
1.2. Cấu tạo bảng tuần hoàn các nguyên tố hoá học
a. Ô nguyên tố
- Mỗi nguyên tố hoá học được xếp vào một ô của bảng tuần hoàn, gọi là ô nguyên tố.
- Ô nguyên tố cho biết: kí hiệu hoá học, tên nguyên tố, số hiệu nguyên tử và khối lượng nguyên tử của nguyên tố đó.
- Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số electron trong nguyên tử.
- Số hiệu nguyên tử chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Các thông tin về nguyên tố ở ô số 8 trong bảng tuần hoàn được chỉ ra trong Hình 4.2.
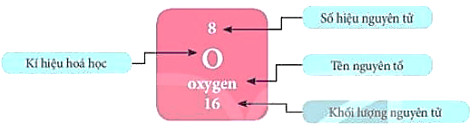
Hình 4.2. Ô nguyên tố oxygen
b. Chu ki
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần khi đi từ trái qua phải.
- Bảng tuần hoàn hiện nay gồm 7 chu kì được đánh số từ 1 đến 7, mỗi chu kì là 1 hàng ngang (riêng chu kì 6 và chu kì 7, mỗi chu kì có thêm 1 hàng xếp tách riêng cuối bảng).
- Chu kì 1, 2, 3 được gọi là các chu kì nhỏ, chu kì 4, 5, 6, 7 được gọi là các chu kì lớn. Ví dụ: Chu kì 1 gồm 2 nguyên tố là H và He, chu kì 2 gồm 8 nguyên tố từ Li đến Ne và chu kì 3 gồm 8 nguyên tố từ Na đến Ar (xem Hình 4.3).
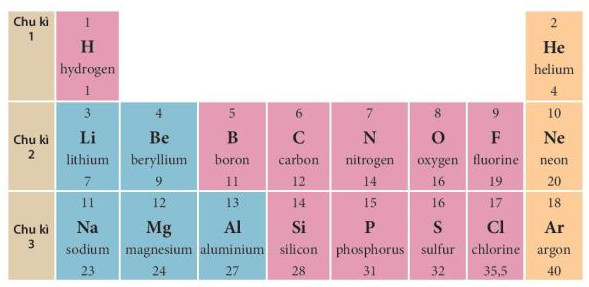
Hình 4.3. Các nguyên tố thuộc ba chu kì đầu tiên của bảng tuần hoàn
- Trong bảng tuần hoàn, số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
c. Nhóm
- Bảng tuần hoàn gồm 8 nhóm A được đánh số từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
- Các nguyên tố trong cùng một nhóm A có số electron ở lớp ngoài cùng bằng nhau (trừ trường hợp nguyên tố He), do vậy chúng có tính chất gần giống nhau.
- Trong cùng một nhóm, khi đi từ trên xuống dưới, điện tích hạt nhân của nguyên tử các nguyên tố tăng dần.
Ví dụ:
- Nhóm IA gồm 7 nguyên tố từ H đến Fr (xem Hình 4.5a). Các nguyên tố trong nhóm IA là các kim loại điển hình (trừ H).
- Nhóm VIIA gồm 6 nguyên tố từ 1 đến Ts (xem Hình 4.5b). Các nguyên tố trong nhóm VIIA là các phi kim điển hình (trừ Ts).

a) b)
Hình 4.5. Các nguyên tố thuộc nhóm IA và nhóm VIIA của bảng tuần hoàn
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm đó.
| Cấu trúc bảng tuần hoàn gồm các ô nguyên tố, chu kì và nhóm. |
|---|
1.3. Vị trí các nhóm nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
a. Các nguyên tố kim loại
- Trong số 118 nguyên tố hoá học đã biết có hơn 90 nguyên tố là kim loại. Trong bảng tuần hoàn, các nguyên tố kim loại ở góc dưới bên trái của bảng và được thể hiện bằng màu xanh (xem Bảng tuần hoàn trang 25). Chúng gồm:
+ Hầu hết các nguyên tố thuộc nhóm IA, nhóm IIA, nhóm IIIA và một số nguyên tố các nhóm IVA, VA, VIA.
+ Các nguyên tố thuộc nhóm IB đến VIIIB, các nguyên tố lanthanide và các nguyên tố actinide được xếp riêng thành hai hàng ở cuối bảng.
- Một số nguyên tố kim loại thông dụng và ứng dụng của chúng trong đời sống được chỉ ra trong Hình 4.6.
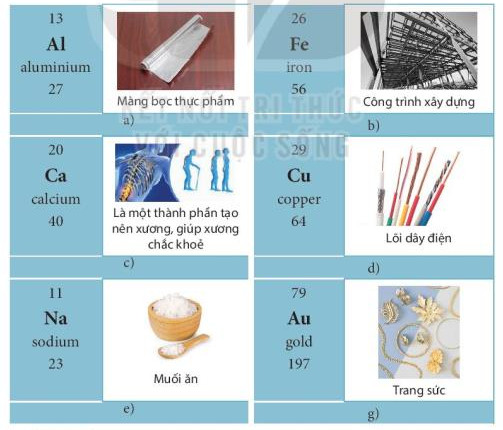
Hình 4.6. Ứng dụng của một số nguyên tố kim loại thông dụng trong đời sống
b. Các nguyên tố phi kim
- Một số phi kim rất quen thuộc trong đời sống của chúng ta như: oxygen là phi kim không thể thiếu với sự sống của hầu hết sinh vật, được tạo ra trong quá trình quang hợp và được sử dụng trong quá trình hô hấp; chlorine có thể được dùng để khử trùng nước sinh hoạt.
- Trong số 118 nguyên tố hoá học đã biết, có chưa đến 20 nguyên tố là phi kim. Ở điều kiện thường, chúng có thể ở thể rắn, thể lỏng hay thể khí (xem Hình 4.7). Trong bảng tuần hoàn, các nguyên tố phi kim chủ yếu ở góc trên bên phải của bảng, được thể hiện bằng màu hồng. Chúng gồm:
+ Hầu hết các nguyên tố thuộc nhóm VIIA, VIA, VA.
+ Một số nguyên tố thuộc nhóm IVA, IIIA.
+ Nguyên tố H nhóm IA.

a) Nguyên tố O, S thuộc nhóm VIA b) Nguyên tố Cl, Br thuộc nhóm VIIA
Hình 4.7. Trạng thái, màu sắc của một số phi kim ở nhiệt độ thường
c. Các nguyên tố khí hiếm
- Trong số 118 nguyên tố đã biết có 7 nguyên tố là nguyên tố khí hiểm. Nguyên tử của chúng có lớp electron ngoài cùng bền vững nên khó bị biến đổi hoá học. Một số ứng dụng trong đời sống của khí hiếm như: Hệ được sử dụng trong khinh khí cầu, Ne được dùng trong đèn LED,...
- Trong bảng tuần hoàn, nguyên tố khí hiếm nằm ở nhóm VIIIA và được thể hiện bằng màu vàng.
|
- Trong bảng tuần hoàn, các nguyên tố kim loại tập trung ở các nhóm IA, IIA, IIIA và các nhóm B. - Các nguyên tố phi kim tập trung ở các nhóm VA, VIA, VIIA, còn các nguyên tố khí hiếm ở nhóm VIIIA. |
|---|
Bài tập minh họa
Bài 1: Ngày nay, người ta đã xác định được hàng chục triệu chất hóa học với các tính chất khác nhau được tạo thành từ hơn một trăm nguyên tố hóa học. Liệu có nguyên tắc nào sắp xếp các nguyên tố để dễ nhận ra tính chất của chúng không?
Hướng dẫn giải
- Nguyên tắc sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân
+ Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử
+ Các nguyên tố trong cùng cột có tính chất gần giống nhau
Bài 2: Số hiệu nguyên tử của một nguyên tố hóa học cho biết những thông tin gì về nguyên tố đó?
Hướng dẫn giải
- Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton trong hạt nhân = số electron trong nguyên tử = số thứ tự của nguyên tố trong bảng tuần hoàn
- Ví dụ: Nguyên tử hydrogen có số hiệu nguyên tử là 1
→ Nguyên tố hydrogen ở ô số 1 trong bảng tuần hoàn, điện tích hạt nhân là +1 (do có 1 proton trong hạt nhân) cà có 1 electron trong nguyên tử
Bài 3: Quan sát bảng tuần hoàn, cho biết số hiệu nguyên tử, số lớp electron lần lượt của nguyên tử carbon (C) và nhôm (Al). Hai nguyên tố đó nằm ở chu kì nào trong bảng tuần hoàn?
Hướng dẫn giải
- Nguyên tố carbon:
+ Có số hiệu nguyên tử: 6
+ Nằm ở chu kì 2 → Có 2 lớp electron
- Nguyên tố nhôm:
+ Có số hiệu nguyên tử: 13
+ Nằm ở chu kì 3 →Có 3 lớp electro
Luyện tập Bài 4 Khoa học tự nhiên 7 KNTT
Học xong bài học này, em có thể:
- Nêu được các nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học.
- Mô tả được cấu tạo bảng tuần hoàn gồm ô, nhóm, chu kì.
- Sử dụng được bảng tuần hoàn để chỉ ra các nhóm nguyên tố kim loại, phi kim, khí hiếm.
3.1. Trắc nghiệm Bài 4 Khoa học tự nhiên 7 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Khoa học tự nhiên 7 Kết nối tri thức Chương 1 Bài 4 cực hay có đáp án và lời giải chi tiết.
-
- A. O, F, N, C.
- B. F, O, N, C.
- C. O, N, C, F.
- D. C, N, O, F.
-
- A. K, Na, Li, Rb.
- B. Li, K, Rb, Na.
- C. Na, Li, Rb, K.
- D. Li, Na, K, Rb.
-
Câu 3:
Cho các nguyên tố sau O, P, N. Hãy chỉ ra thứ tự sắp xếp đúng theo chiều tính phi kim tăng dần
- A. O, P, N.
- B. N, P, O.
- C. P, N, O.
- D. O, N, P.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 4 Khoa học tự nhiên 7 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Khoa học tự nhiên 7 Kết nối tri thức Chương 1 Bài 4 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Hoạt động trang 23 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 24 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 24 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi trang 26 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Hoạt động trang 27 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi trang 27 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Hoạt động trang 28 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi trang 29 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 30 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 30 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 31 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 31 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 31 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.1 trang 14 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.2 trang 14 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.3 trang 15 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.4 trang 15 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.5 trang 15 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.6 trang 15 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.7 trang 15 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.8 trang 15 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.9 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.10 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.11 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.12 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.13 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.14 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.15 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.16 trang 16 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.17 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.18 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.19 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.20 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.21 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.22 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.23 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.24 trang 17 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.25 trang 18 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.26 trang 18 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.27 trang 18 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 4.28 trang 18 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Hỏi đáp Bài 4 Khoa học tự nhiên 7 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







