Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Ôn tập chương 4 Ôn tập chương 4 sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải bài OT4.1 trang 49 SBT Hóa học 10 Chân trời sáng tạo - CTST
Sản xuất gang trong công nghiệp bằng cách sử dụng khí CO khử Fe2O3 ở nhiệt độ cao theo phản ứng sau Fe2O3 + 3CO -> 2Fe + 3CO2. Trong phản ứng trên chất đóng vai trò chất khử là
A. Fe2O3.
B. CO.
C. Fe.
D. CO2.
-
Giải bài OT4.2 trang 49 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho các phân tử có công thức cấu tạo sau:
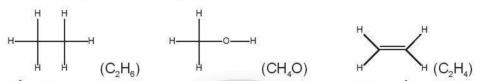
Số oxi hoá trung bình của nguyên tử C trong các phân tử trên lần lượt là
A. -3, -2, -2. B. -3, -3, -2. C. - 2, -2, -2. D. -3, -2, -3.
-
Giải bài OT4.3 trang 49 SBT Hóa học 10 Chân trời sáng tạo - CTST
Thực hiện các phản ứng sau
(a) Ca(OH)2 + Cl2 -> CaOCl2 + H2O
(b) 3Cl2 + 6KOH -> 5KCl + KClO3 + 3H2O
(c) Cl2 + 2FeCl2 -> 2FeCl3
(d) 2KClO3 -> 2KCl + 3O2
Số phản ứng chlorine đóng vai trò chất oxi hóa là
A. 1.
B. 2.
C. 3.
D. 4.
-
Giải bài OT4.4 trang 49 SBT Hóa học 10 Chân trời sáng tạo - CTST
Bromine vừa là chất oxi hoá, vừa là chất khử trong phản ứng nào sau đây?
A. 3Br2 + 6NaOH -> 5NaBr + NaBrO3 + 3H2O
B. Br2 + H2 -> 2HBr
C. 3Br2 + 2Al -> 2AlBr3
D. Br2 + 2KI -> I2 + 2KBr
-
Giải bài OT4.5 trang 49 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. SO2.
B. H2SO4.
C. H2S.
D. Na2SO3.
-
Giải bài OT4.6 trang 49 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tính số oxi hoá các nguyên tố có đánh dấu *
a) \(N{a_2}\mathop {Cr}\limits^* {O_4},{\rm{ }}C{a_3}{\left( {\mathop P\limits^* {O_4}} \right)_2},{\rm{ }}Ca\mathop {Si}\limits^* {O_3},{\rm{ }}Na\mathop {Cr}\limits^* {O_2},{\rm{ }}Fe\mathop {{S_2}}\limits^* \)
b) \(\mathop N\limits^* {H_4}^ + ,{\rm{ }}\mathop {C{r_2}}\limits^* {O_7}^ - ,{\rm{ }}\mathop {Mn}\limits^* {O_4}^{2 - },{\rm{ }}\mathop N\limits^* {O_2}^ - \)
-
Giải bài OT4.7 trang 50 SBT Hóa học 10 Chân trời sáng tạo - CTST
Chất được gạch chân trong các phương trình hoá học sau đây là chất oxi hoá hay chất khử, nếu lí do
a) Br2 + 2KI -> I2 + 2KBr
b) 3Zn + 8HNO3 → 3Zn(NO3)2 + 3NO + 4H2O
c) K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
-
Giải bài OT4.8 trang 50 SBT Hóa học 10 Chân trời sáng tạo - CTST
Dẫn ra hai phản ứng, trong đó có một phản ứng oxi hoá - khử và một không phải phản ứng oxi hoá khử
-
Giải bài OT4.9 trang 50 SBT Hóa học 10 Chân trời sáng tạo - CTST
Dưới tác dụng của các chất xúc tác, glucose tạo thành các sản phẩm khác nhau.
– Lên men tạo thành ethanol
\({C_6}{H_{12}}{O_6}(glucose)\mathop \to \limits^{enzyme} {C_2}{H_5}OH(ethanol) + C{O_2}\) (1)
– Ethanol lên men thành acetic acid:
\(C{H_3} - C{H_2} - OH + {O_2}\mathop \to \limits^{enzyme} C{H_3} - COOH(aceticacid) + {H_2}O\) (2)
a) Cho biết vai trò của các chất trong các phản ứng (1) và (2).
b) Tính lượng glucose cần dùng để thu được 1 lit acetic acid 1 M. Giả sử hiệu suất của cả quá trình là 50%.
-
Giải bài OT4.10 trang 50 SBT Hóa học 10 Chân trời sáng tạo - CTST
Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không binh thường là dấu hiệu của bệnh. Đề xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
KMnO4 + CaC2O4 + H2SO4 -> CaSO4 + K2SO4 + MnSO4 + CO2 + H2O
a) Cân bằng phương trình phản ứng.
b) Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch potassium permanganate (KMnO4) 4,88.10-4 M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca2+/100 mL máu.
-
Giải bài OT4.11 trang 50 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hỗn hợp ammonium perchlorate (NH4ClO4) và bột nhôm là nhiên liệu rắn của tàu vũ trụ con thoi theo phản ứng sau:
NH4ClO4 -> N2 + Cl2 + O2 + H2O
Mỗi một lần phóng tàu con thoi tiêu tốn 750 tấn ammonium perchlorate. Giả sử tất cả oxygen sinh ra tác dụng với bột nhôm, hãy tính khối lượng nhôm phản ứng với oxygen và khối lượng aluminium oxide sinh ra.
-
Giải bài OT4.12 trang 50 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho 30,3 g hỗn hợp Al và Zn tác dụng vừa đủ với 11,15 lít O2 (đkc), thu được hỗn hợp các oxide. Viết các phương trình phản ứng xảy ra và tính khối lượng các oxide tạo thành.
-
Giải bài OT4.13 trang 51 SBT Hóa học 10 Chân trời sáng tạo - CTST
Sodium peroxide (Na2O2), potassium superoxide (KO2) là những chất oxi hoá mạnh, dễ dàng hấp thụ khí carbon dioxide và giải phóng khí oxygen. Do đó, chúng được sử dụng trong bình lặn hoặc tàu ngầm để hấp thụ khi carbon dioxide và cung cấp khí oxygen cho con người trong hô hấp theo các phản ứng sau:
Na2O2 + CO2 -> Na2CO3 + O2
KO2 + CO2 -> K2CO3 + O2
a) Cân bằng các phản ứng biết rằng nguyên tử oxygen trong Na2O2, KO2 là nguyên tố tự oxi hoá - khử
b) Theo nghiên cứu, khi hô hấp, thể tích khí carbon dioxide một người thải ra xấp xỉ thể tích khí oxygen hít vào. Cần trộn Na2O2 và KO2 theo tỉ lệ số mol như thế nào để thể tích khí carbon dioxide hấp thụ bằng thể tích khí oxygen sinh ra?
-
Giải bài OT4.14 trang 51 SBT Hóa học 10 Chân trời sáng tạo - CTST
Copper(II) sulfate được sử dụng làm nguyên liệu trong phân bón, làm thuốc kháng nấm. Ngoài ra còn dùng để diệt rêu – tảo trong bể bơi,… Copper(II) sulfate được sản xuất chủ yếu sử dụng từ nguồn nguyên liệu tái chế. Phế liệu được tinh chế cùng kim loại nóng chảy được đổ vào nước để tạo thành những mảnh xốp. Hỗn hợp này được hoà tan trong dung dịch sulfuric acid loãng trong không khí theo phương trình:
Cu + O2 + H2SO4 -> CuSO4 + H2O (1)
Ngoài ra, copper(II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với dung dịch sulfuric acid đặc, nóng:
Cu + H2SO4 -> CuSO4 + SO2 + H2O (2)

a) Cân bằng 2 phản ứng trên theo phương pháp thăng bằng electron.
b) Trong hai cách trên, cách nào ít làm ô nhiễm môi trường hơn?
-
Giải bài OT4.15 trang 51 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho 1,12 g kim loại X tác dụng với dung dịch sulfuric acid đặc, nóng, dư thu được 0,7437 lít khí SO2 (đkc) và muối X2(SO4)3.
a) Viết phản ứng và cân bằng phương trình hoá học theo phương pháp thăng bằng electron.
b) Xác định kim loại X.






