Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 2 Bài 2: Thành phần của nguyên tử môn Hóa học lớp 10 CTST giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 13 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 2.1, cho biết thành phần nguyên tử gồm những loại hạt nào?
.jpg)
Hình 2.1. Mô hình nguyên tử
-
Giải câu hỏi 2 trang 14 SGK Hóa học 10 Chân trời sáng tạo - CTST
Cho biết vai trò của màn huỳnh quang trong thí nghiệm ở Hình 2.2
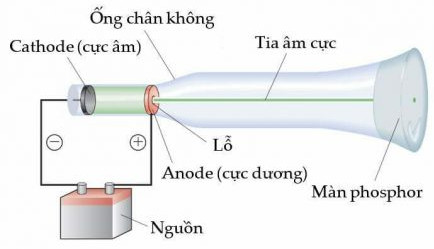
Hình 2.2. Thí nghiệm của Thomson
-
Giải câu hỏi 3 trang 14 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 2.2, giải thích vì sao tia âm cực bị hút về cực dương của trường điện

Hình 2.2. Thí nghiệm của Thomson
-
Giải câu hỏi 4 trang 14 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nếu đặt một chong chóng nhẹ trên đường đi của tia âm cực thì chong chóng sẽ quay. Từ hiện tượng đó, hãy nêu kết luận về tính chất của tia âm cực
-
Giải câu hỏi 5 trang 16 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 2.3, cho biết các hạt α có đường đi như thế nào. Dựa vào Hình 2.4, giải thích kết quả thí nghiệm thu được
.jpg)
Hình 2.3. Thí nghiệm khám phá hạt nhân nguyên tử của Rutherford
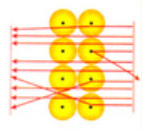
Hình 2.4. Kết quả thí nghiệm khám phá hạt nhân nguyên tử của Rutherford
-
Luyện tập trang 16 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử oxygen có 8 electron, cho biết hạt nhân của nguyên tử này có điện tích là bao nhiêu
-
Giải câu hỏi 6 trang 16 SGK Hóa học 10 Chân trời sáng tạo - CTST
Điện tích của hạt nhân nguyên tử do thành phần nào quyết định? Từ đó, rút ra nhận xét về mối quan hệ giữa số đơn vị điện tích hạt nhân và số proton.
-
Luyện tập trang 17 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử natri (sodium) có điện tích hạt nhân là +11. Cho biết số proton và số electron trong nguyên tử này?
-
Giải câu hỏi 7 trang 17 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 2.6, hãy lập tỉ lệ giữa đường kính nguyên tử và đường kính hạt nhân của nguyên tử carbon. Từ đó, rút ra nhận xét
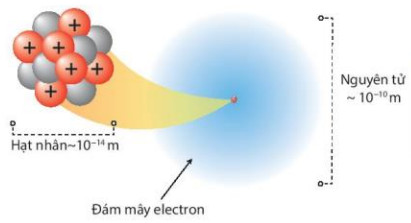
Hình 2.6. Đường kính nguyên tử, hạt nhân trong nguyên tử carbon
-
Giải câu hỏi 8 trang 18 SGK Hóa học 10 Chân trời sáng tạo - CTST
Dựa vào Bảng 2.1, hãy lập tỉ lệ khối lượng của một proton với khối lượng của một electron. Kết quả này nói lên điều gì?
Bảng 2.1. Một số tính chất của các loại hạt cơ bản trong nguyên tử
.jpg)
-
Luyện tập trang 18 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử oxygen -16 có 8 proton, 8 neutron và 8 electron. Tính khối lượng nguyên tử oxygen theo đơn vị gam và amu
-
Vận dụng trang 19 SGK Hóa học 10 Chân trời sáng tạo - CTST
Sử dụng sơ đồ tư duy để mô tả cấu tạo nguyên tử và hệ thống hóa kiến thức của bài học
-
Giải bài 1 trang 19 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hãy cho biết dữ kiện nào trong thí nghiệm của Rutherford chứng minh nguyên tử có cấu tạo rỗng
-
Giải bài 2 trang 19 SGK Hóa học 10 Chân trời sáng tạo - CTST
Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu
B. Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu
C. Neutron không mang điện, khối lượng gần bằng 1 amu
D. Nguyên tử trung hòa về điện, có kích thước lớn hơn nhiều so với hạt nhân, nhưng có khối lượng gần bằng khối lượng hạt nhân
-
Giải bài 3 trang 19 SGK Hóa học 10 Chân trời sáng tạo - CTST
Mỗi phát biểu dưới đây mô tả loại hạt nào trong nguyên tử?
a) Hạt mang điện tích dương
b) Hạt được tìm thấy trong hạt nhân và không mang điện
c) Hạt mang điện tích âm
-
Giải bài 4 trang 19 SGK Hóa học 10 Chân trời sáng tạo - CTST
a) Cho biết 1g electron có bao nhiêu hạt
b) Tính khối lượng của 1 mol electron (biết hằng số Avogadro có giá trị là 6,022x1023)
-
Giải bài 2.1 trang 7 SBT Hóa học 10 Chân trời sáng tạo - CTST
Phát biểu nào dưới đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron.
C. Vỏ nguyên tử được cấu thành bởi các hạt electron
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
-
Giải bài 2.2 trang 7 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho 1 mol kim loại X. Phát biểu nào dưới đây đúng?
A. 1 mol X chứa số lượng nguyên tử bằng số lượng nguyên tử trong 1 mol nguyên tử hydrogen.
B. 1 mol X chứa số lượng nguyên tử bằng số lượng nguyên tử trong \(\frac{1}{{12}}\) mol carbon.
C. 1 mol X có khối lượng bằng khối lượng 1 mol hydrogen.
D. 1 mol X có khối lượng bằng \(\frac{1}{2}\) khối lượng 1 mol carbon.
-
Giải bài 2.3 trang 7 SBT Hóa học 10 Chân trời sáng tạo - CTST
Thành phần nào không bị lệch hướng trong trường điện?
A. Tia α.
B. Proton
C. Nguyên tử hydrogen
D. Tia âm cực
-
Giải bài 2.4 trang 7 SBT Hóa học 10 Chân trời sáng tạo - CTST
Phát biểu nào sai khi nói về neutron?
A. Tồn tại trong hạt nhân nguyên tử.
B. Có khối lượng bằng khối lượng proton.
C. Có khối lượng lớn hơn khối lượng electron.
D. Không mang điện.
-
Giải bài 2.5 trang 7 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử R có điện tích lớp vỏ nguyên tử là 41,6.10-19C. Điều khẳng định nào sau đây là không chính xác?
A. Lớp vỏ nguyên tử R có 26 electron.
B. Hạt nhân nguyên tử R có 26 proton.
C. Hạt nhân nguyên tử R có 26 neutron.
D. Nguyên tử R trung hòa về điện.
-
Giải bài 2.6 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
A. 12.
B. 24.
C. 13.
D. 6.
-
Giải bài 2.7 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong nguyên tử Al, số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong Al là bao nhiêu?
A. 13.
B. 15.
C. 27.
D. 14.
-
Giải bài 2.8 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Đặc điểm của electron là
A. mang điện tích dương và có khối lượng.
B. mang điện tích âm và có khối lượng.
C. không mang điện và có khối lượng.
D. mang điện tích âm và không có khối lượng.
-
Giải bài 2.9 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nhận định nào sau đây không đúng?
A. Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
B. Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện.
C. Lớp vỏ nguyên tử chứa electron mang điện tích âm.
D. Khối lượng nguyên tử hầu hết tập trung ở hạt nhân.
-
Giải bài 2.10 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho các phát biểu sau:
(1) Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và neutron.
(2) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3) Trong nguyên tử, số electron bằng số proton.
(4) Trong hạt nhân nguyên tử, hạt mang điện là proton và electron.
(5) Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
-
Giải bài 2.11 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Kết quả nào trong thí nghiệm bắn phá lá vàng của Rutherford chỉ ra sự tồn tại của hạt nhân nguyên tử?
-
Giải bài 2.12 trang 8 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hãy điền những dữ liệu còn thiếu vào các chỗ trống trong các câu sau:
a) Trong ống tia âm cực, tia âm cực được phát ra từ điện cực âm được gọi là (1) ….
b) Đơn vị nhỏ nhất của một nguyên tố có thể tồn tại đơn lẻ hoặc tồn tại trong các phân tử được gọi là (2) …..
c) Hạt mang điện tích dương được tìm thấy trong hạt nhân nguyên tử được gọi là (3) ….
d) Hạt không mang điện tồn tại trong hạt nhân nguyên tử được gọi là (4) ….
e) Hạt trong nguyên tử có khối lượng nhỏ nhất và khối lượng lớn nhất, tương ứng là (5) …. và (6) …..
-
Giải bài 2.13 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tia âm cực phát ra trong ống âm cực bị lệch hướng khi đặt trong trường từ. Một dây dẫn mang điện cũng có thể bị hút bởi trường từ. Tia âm cực bị lệch hướng khi đặt gần một vật mang điện âm. Tính chất nào của tia âm cực được thể hiện qua các hiện tượng này?
-
Giải bài 2.14 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
Electron sinh ra trong ống tia âm cực chứa khí neon có khác electron sinh ra trong ống tia âm cực chứa khí chlorine không? Vì sao?
-
Giải bài 2.15 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử mang điện tích dương, điện tích âm hay trung hòa? Giải thích vì sao một nguyên tử có thể tồn tại ở trạng thái này.
-
Giải bài 2.16 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
X là nguyên tố hóa học có trong thành phần của chất có tác dụng oxi hóa và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong lĩnh vực thủy sản, diệt nhuộm, xử lí nước cấp, nước thải, nước bể bơi. Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định thành phần cấu tạo của nguyên tử X.
-
Giải bài 2.17 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
Các hợp chất của nguyên tố Y được sử dụng như là vật liệu chịu lửa trong các lò sản xuất sắt, thép, kim loại màu, thủy tinh và xi măng. Oxide của Y và các hợp chất khác cũng được sử dụng trong nông nghiệp, công nghiệp hóa chất và xây dựng. Nguyên tử Y có tổng số các hạt là 36. Số hạt không mang điện bằng một nửa hiệu số giữa tổng số hạt với số hạt mang điện tích âm. Xác định thành phần cấu tạo của nguyên tử Y.
-
Giải bài 2.18 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nitrogen giúp bảo quản tinh trùng, phôi, máu và tế bào gốc. Biết nguyên tử nitrogen có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Xác định số đơn vị điện tích hạt nhân của nitrogen.
-
Giải bài 2.19 trang 9 SBT Hóa học 10 Chân trời sáng tạo - CTST
Magnesium oxide (MgO) được sử dụng để làm dịu cơn đau ợ nóng và chua của chứng đau dạ dày. Tổng số hạt mang điện trong hợp chất MgO là 40. Số hạt mang điện trong nguyên tử Mg nhiều hơn số hạt mang điện trong nguyên tử O là 8. Xác định điện tích hạt nhân của Mg và O.
-
Giải bài 2.20 trang 10 SBT Hóa học 10 Chân trời sáng tạo - CTST
Helium là một khí hiếm được sử dụng rộng rãi trong nhiều ngành công nghiệp như hàng không, hàng không vũ trụ, điện tử, điện hạt nhân và chăm sóc sức khỏe. Nguyên tử helium có 2 proton, 2 neutron và 2 electron. Cho biết khối lượng của electron trong nguyên tử helium chiếm bao nhêu phần trăm khối lượng nguyên tử.
-
Giải bài 2.21 trang 10 SBT Hóa học 10 Chân trời sáng tạo - CTST
Khi phóng chùm tia α vào một lá vàng mỏng, người ta thấy rằng trong khoảng 108 hạt α có một hạt gặp hạt nhân.
a. Một cách gần đúng, hãy xác định đường kính của hạt nhân so với đường kính của nguyên tử.
b. Với sự thừa nhận kết quả trên, hãy tính đường kính của nguyên tử nếu ta coi hạt nhân có kích thước như một quả bóng bàn có đường kính bằng 3 cm.
-
Giải bài 2.22 trang 10 SBT Hóa học 10 Chân trời sáng tạo - CTST
Calcium là một loại khoảng chất có vai trò rất quan trọng trong cơ thể người. Trong cơ thể, calcium chiếm 1,5 – 2% trọng lượng, 99% lượng calcium tồn tại trong xương, răng, móng và 1% trong máu. Calcium kết hợp với phosphorus là thành phần cấu tạo cơ bản của xương và răng, làm cho xương và răng chắc khỏe. Khối lượng riêng của calcium kim loại là 1,55 g/cm3. Giả thiết rằng trong tinh thể calcium, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Xác định bán kính nguyên tử calcium. Cho nguyên tử khối của calcium la 40.
Cho biết công thức tính thể tích hình cầu là \(V = \frac{{4\pi {r^3}}}{3}\)trong đó r là bán kính hình cầu.
-
Giải bài 2.23 trang 10 SBT Hóa học 10 Chân trời sáng tạo - CTST
Bán kính nguyên tử và khối lượng mol nguyên tử iron lần lượt là 1,28 Å và 56 g/mol. Tính khối lượng riêng của iron. Biết rằng trong tinh thể, các tinh thể iron chiếm 74% thể tích, còn lại là phần rỗng.
-
Giải bài 2.24 trang 10 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử Fe ở 20oC có khối lượng riêng là 7,87 g/cm3. Với giả thiết này, tinh thể nguyên tử Fe là những hình cầu chiếm 75% thể tích tinh thể, phần còn lại là những khe rỗng giữa các quả cầu. Cho biết khối lượng nguyên tử của Fe là 55,847. Tính bán kính nguyên tử gần đúng của Fe.
-
Giải bài 2.25 trang 10 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử kẽm (Zn) có nguyên tử khối bằng 65u. Thực tế hầu như toàn bộ khối lượng nguyên tử tập trung ở hạt nhân, với bán kính r = 2×10-15 m. Khối lượng riêng của hạt nhân nguyên tử kẽm là bao nhiêu tấn trên một centimet khối (tấn/cm3)?






