Dưới đây là lý thuyết và bài tập minh họa Bài 9: Ôn tập chương 2 chương trình SGK môn Hóa 10 Kết nôi tri thức. Bài giảng đã được HỌC247 biên soạn ngắn gọn, đầy đủ, dễ hiểu sẽ giúp các em dễ dàng nắm được nội dung chính của chương bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn. Mời các em cùng tham khảo.
Tóm tắt lý thuyết
1.1. Cấu tạo bảng tuần hoàn
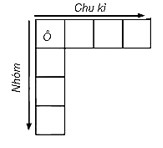
a. Ô nguyên tố
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
b. Chu kỳ
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần. Số thứ tự của chu kỳ trùng với số lớp electron của nguyên tử các nguyên tố trong chu kỳ đó.
+ Chu kỳ nhỏ: gồm chu kỳ 1, 2, 3.
+ Chu kỳ lớn: gồm chu kỳ 4, 5, 6, 7.
c. Nhóm nguyên tố: là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
d. Khối các nguyên tố
- Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA. Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
- Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He). Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
- Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B. Nguyên tố d là các nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
- Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini. Nguyên tố f là các nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
1.2. Xu hướng biến đổi trong bảng tuần hoàn
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân:
+ Bán kính nguyên tử và tính kim loại của các nguyên tố tăng dần.
+ Giá trị độ âm điện và tính phi kim của các nguyên tố giảm dần.
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân:
+ Bán kính nguyên tử và tính kim loại của các nguyên tố giảm dần.
+ Giá trị độ âm điện và tính phi kim của các nguyên tố tăng dần.
1.3. Bảng tuần hoàn và cấu tạo nguyên tử
Các cấu hình electron trong nguyên tử và vị trí của các nguyên tố đó trong bảng tuần hoàn có mối quan hệ qua lại với nhau.
- Số thứ tự của ô nguyên tố = tổng số e của nguyên tử
- Số thứ tự của chu kì = số lớp e
- Số thứ tự của nhóm:
+ Nếu cấu hình e lớp ngoài cùng có dạng nsansp thì nguyên tố thuộc nhóm (a+b) A
+ Nếu cấu hình e kết thúc ở dạng (n-1)dxnsy thì nguyên tố thuộc nhóm B:
- Nhóm (x+y)B nếu 3 ≤ (x + y) ≤ 7.
- Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10.
- Nhóm (x + y - 10)B nếu 10 < (x + y).
1.4. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Bài tập minh họa
Bài 1
a. Điền các cụm từ "số lớp electron", "điện tích hạt nhân" và "số electron hoá trị’’ vào chỗ trống trong các mệnh đề sau theo đúng các nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn.
……………?…….......… tăng dần.
Cùng …………?………… cùng chu kì (hàng).
Cùng …………?………… cùng nhóm (cột).
b. Trong bảng tuần hoàn hiện nay có bao nhiêu nguyên tố, bao nhiêu chu kì, bao nhiêu nhóm?
Hướng dẫn giải
a. Điện tích hạt nhân tăng dần.
Cùng số lớp electron → cùng chu kì (hàng).
Cùng số electron hóa trị → cùng nhóm (cột).
b. Bảng tuần hoàn có 118 nguyên tố, 7 chu kỳ, 8 nhóm A và 8 nhóm B.
Bài 2: Điền các đại lượng và tính chất dưới đây vào bên trong các mũi tên (theo chiều tăng dần) để thấy xu hướng biến đổi của các đại lượng và tính chất đó.
Bán kính nguyên tử
Giá trị độ âm điện
Tính kim loại
Tính phi kim
Tính acid – base của các oxide và hydroxide
.jpg)
Hướng dẫn giải
(1) Bán kính nguyên tử
(2) Tính kim loại
(3) Giá trị độ âm điện
(4) Tính phi kim
(5) Tính phi kim
(6) Giá trị độ âm điện
(7) Tính acid – base của các oxide và hydroxide.
Bài 3: Chọn từ hoặc cụm từ thích hợp để hoàn thành nội dung của định luật tuần hoàn:
Tính chất của các …?... và đơn chất cũng như thành phần và …?... của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của …?... nguyên tử.
Hướng dẫn giải
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Luyện tập Bài 9 Hóa 10 KNTT
Sau bài học này, học sinh nắm được
- Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Xu hướng biến đổi một số tính chất của các nguyên tố trong một chu kì và trong một nhóm
- Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì.
- Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
3.1. Trắc nghiệm Bài 9 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 KNTT Bài 9 cực hay có đáp án và lời giải chi tiết.
-
- A. Số electron thuộc lớp ngoài cùng như nhau.
- B. Số electron như nhau.
- C. Số lớp electron như nhau.
- D. Cùng số electron s hay p.
-
- A. 1
- B. 3
- C. 2
- D. 4
-
- A. số lớp electron
- B. số electron ở lớp ngoài cùng
- C. số electron
- D. số electron hóa trị
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 9 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 KNTT Bài 9 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 46 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 47 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 47 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 47 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 5 trang 47 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 6 trang 47 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.1 trang 24 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.2 trang 24 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.3 trang 24 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.4 trang 24 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.5 trang 24 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.6 trang 24 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.7 trang 25 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.8 trang 25 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.9 trang 25 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.10 trang 25 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.11 trang 25 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.12 trang 26 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.13 trang 26 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.14 trang 26 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.15 trang 26 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 9.16 trang 27 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 9 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







