Liên kết cộng hóa trị là gì? Liên kết cộng hóa trị có cực và không cực khác nhau thế nào? Chúng được hình thành trong phân tử đơn chất và hợp chất như thế nào? Và làm sao để phân loại liên kết hóa học theo độ âm điện, chúng ta cùng tìm hiểu qua Bài 11: Liên kết cộng hóa trị môn Hóa học 10 chương trình SGK Cánh Diều nhé!
Tóm tắt lý thuyết
1.1. Liên kết cộng hóa trị
- Ngoài cách nhường và nhận electron để hình thành hợp chất ion, quy tắc octet có thể đạt được bằng cách góp chung electron. Electron chung là electron được coi như thuộc về đồng thời hai nguyên tử tham gia liên kết. Liên kết do sự dùng chung cặp electron là loại liên kết rất phổ biển, thường gặp giữa phi kim với phi kim.
- Liên kết cộng hoá trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Ví dụ 1
- Nguyên tử hydrogen (H) có cấu hình electron 1s1, chlorine (Cl) có cấu hình electron [Ne]3s23p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron chung cho cả hai nguyên tử (Hình 11.2).
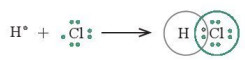
Hình 11.2. Sự hình thành cặp electron chung của HCl
- Như vậy, liên kết giữa nguyên tử H và Cl được tạo nên bởi 1 cặp electron chung. Công thức .jpg) gọi là công thức electron của HCl.
gọi là công thức electron của HCl.
- Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (-) và gọi là liên kết đơn. Khi đó, HCl được biểu diễn như sau: 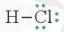
- Công thức trên được gọi là công thức Lewis của HCl.
- Như vậy, công thức Levis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung và các electron hoá trị riêng.
- Hợp chất HCl được tạo nên chi bởi liên kết cộng hoá trị nên thuộc loại hợp chất cộng hoá trị.
Ví dụ 2
- Hình 11.3 mô tả các cặp electron chung trong phân tử CO2. Công thức cấu tạo của CO2 là O=C=O

Hình 11.3. Các cặp electron chung và electron hoá trị riêng trong phân tử CO2
- Nếu giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Ví dụ 3
- Hình 11.4 mô tả các electron chung của hai nguyên tử trong phân tử N2.
- Công thức cấu tạo của N2 là N\( \equiv \)N.
.jpg)
Hình 11.4. Các cặp electron chung và electron hoá trị riêng trong phân tử N2
- Nếu giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba (\( \equiv \)) và gọi là liên kết ba.
Ví dụ 4
- Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium (NH4+) (Hình 11.5).
.jpg)
Hình 11.5. Sự hình thành liên kết cho nhận trong NH4+
- Trên nguyên tử N còn 1 cặp electron hoá trị riêng, khi hình thành NH4+, cặp electron này trở thành cặp electron chung cho N và H, cả N và các nguyên tử H đều thoả mãn quy tắc octet. Như vậy, liên kết đơn giữa nguyên tử N trong NH3 với H+ được tạo thành bởi một cặp electron góp chung của nguyên tử N.
- Để chỉ rõ sự khác biệt về nguồn gốc cặp electron chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên (\( \to \)) xuất phát từ N. Loại liên kết này được gọi là liên kết cho nhận.
- Liên kết cho nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
|
- Liên kết cộng hoá trị được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử. - Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết và các electron riêng. - Liên kết cho nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử. |
|---|
1.2. Phân loại liên kết theo độ âm điện
- Dựa vào hiệu độ âm điện (\(\Delta \chi \), đọc là đen-ta khi) giữa hai nguyên tử A và B có thể cho biết kiểu liên kết giữa hai nguyên tử đó.
\(\Delta \chi \) = \({\chi _B}\) - \({\chi _A}\), trong đó \({\chi _B}\) > \({\chi _A}\)
- Quy tắc phân loại liên kết theo độ âm điện
\(0 \le \Delta \chi < 0,4\): Liên kết cộng hóa trị không cực
\(0,4 \le \Delta \chi < 1,7\): Liên kết cộng hóa trị có cực
\(\Delta \chi \ge 1,7\): Liên kết ion
- Có một số trường hợp ngoại lệ không tuân theo quy tắc trên như hợp chất cộng hoá trị HF, hợp chất ion MnI2,...
| Dựa theo độ âm điện, có thể dự đoán liên kết thuộc loại ion, cộng hoá trị không cực hay có cực. |
|---|
1.3. Liên kết Sigma (\(\sigma \)) và liên kết Pi (\(\pi \))
- Liên kết cộng hoá trị được hình thành từ cặp electron chung. Để tạo nên một cặp electron chung, hai AO chứa electron độc thân (hoặc giữa 1 AO trống và 1 AO bão hoà electron) cần xen phủ với nhau. Các ví dụ dưới đây chỉ xét đến sự xen phủ của AO s và AOp.
- Có hai kiểu xen phủ AO là xen phủ trục và xen phủ bên.
a. Xen phủ trục
- Xen phủ trục là xen phủ giữa hai AO dọc theo trục nối (trục z) hai nguyên tử. Có ba khả năng xen phủ trục:
+ Xen phủ giữa AO s với AO s
.jpg)
+ Xen phủ giữa AO s với AO p
.jpg)
+ Xen phủ giữa AO p với AO p
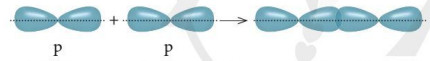
- Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma
b. Xen phủ bên
- Xen phủ bên là sự xen phi xảy ra giữa hai AO p song song với nhau.
.jpg)
- Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (\(\pi \)).
- Liên kết đơn còn gọi là liên kết \(\sigma \), liên kết đôi gồm một liên kết \(\sigma \) và một liên kết \(\pi \), liên kết ba gồm một liên kết \(\sigma \) và hai liên kết \(\pi \).
|
- Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma \(\sigma \). - Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (\(\pi \)). Liên kết \(\sigma \) bền hơn liên kết \(\pi \). |
|---|
1.4. Năng lượng của liên kết cộng hóa trị
- Khi các nguyên tử liên kết với nhau sẽ tạo thành một hệ bền vững hơn, quá trình này giải phóng năng lượng. Do vậy, để phá vỡ liên kết giữa các nguyên tử thì phải cung cấp năng lượng.
Ví dụ:
- Để phá vỡ liên kết H-H trong 1 mol khí H2 ở 25°C và 1 bar cần năng lượng là 436 kJ.
- Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khi, tại 25°C và 1 bar. Đơn vị của năng lượng liên kết thường là kJ mol-1. Năng lượng liên kết càng lớn, liên kết đó càng bền.
Ví dụ: Năng lượng liên kết của H-H là 436 kJ mol-1, của H-I là 297 kJ mol-1. Như vậy, liên kết H-H bền hơn liên kết H-I. Có thể thấy điều này qua nhiệt độ bắt đầu xảy ra sự phân huỷ tạo thành các nguyên tử từ phân tử: của H2 là khoảng 2000°C, trong khi của HI chỉ khoảng 200°C.
| Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25°C và 1 bar. Đơn vị của năng lượng liên kết thường là k mol-1. Năng lượng liên kết càng lớn, liên kết càng bền. |
|---|
Bài tập minh họa
Bài 1: Công thức của CH2O có thể biểu diễn ở dạng công thức (1) hoặc ở dạng công thức (2). Hãy viết công thức của N2 theo cách (2) và cho biết công thức này có thể hiện được quy tắc octet hay không?
.jpg)
Hướng dẫn giải
- 2 nguyên tử N liên kết với nhau bằng 1 nối ba.
⟹ Có 3 cặp electron dùng chung
⟹ Công thức của N2 theo cách (2): 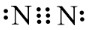
- Mỗi nguyên tử N cùng góp chung 3e để đạt cấu hình electron khí hiếm bền vững.
⟹ Công thức (2) thể hiện được quy tắc octet.
Bài 2: Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nàotrong các chất sau đây: AlCl3, CaCl2, CaS, Al2S3?
Hướng dẫn giải
Hiệu dộ âm điện CaCl2 : 2, 16 → Liên kết ion.
Hiệu độ âm điện AlCl3, CaS, Al2S3lần lượt là : 1,55 ; 1,58 ; 0,97 → Liên kết cộng
hóa trị có cực.
Bài 3: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Hướng dẫn giải
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16 , có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực
Luyện tập Bài 11 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hoá trị (liên kết đơn, đôi, ba) khi áp dụng quy tắc octet.
- Viết được công thức Lewis của một số chất đơn giản.
- Trình bày được khái niệm về liên kết cho nhận.
- Phân biệt được các loại liên kết dựa theo độ âm điện.
- Giải thích được sự hình thành liên kết \(\sigma \) và liên kết \(\pi \) qua sự xen phủ AO.
- Trình bày được khái niệm năng lượng liên kết (cộng hoá trị).
- Lắp được mô hình phân tử một số chất.
3.1. Trắc nghiệm Bài 11 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 11 cực hay có đáp án và lời giải chi tiết.
-
- A. Giữa các phi kim với nhau.
- B. Trong đó cặp electron chung bị lệch về một nguyên tử.
- C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
- D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
-
- A. Trong liên kết cộng hóa trị cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
- B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
- C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
- D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
-
- A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
- B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
- C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
- D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 11 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 11 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 57 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 1 trang 58 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 58 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 58 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 3 trang 58 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 1 trang 59 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 59 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 3 trang 59 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 59 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 61 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 61 SGK Hóa học 10 Cánh Diều - CD
Vận dụng trang 62 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 62 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 63 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 63 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 63 SGK Hóa học 10 Cánh Diều - CD
Giải bài 4 trang 63 SGK Hóa học 10 Cánh Diều - CD
Giải bài 5 trang 63 SGK Hóa học 10 Cánh Diều - CD
Giải bài 11.1 trang 30 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.2 trang 30 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.3 trang 30 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.4 trang 30 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.5 trang 30 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.6 trang 30 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.7 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.8 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.9 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.10 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.11 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.12 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.13 trang 31 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.14 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.15 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.16 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.17 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.18 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.19 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.20 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.21 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.22 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.23 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.24 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.25 trang 33 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 11 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







