Một nội dung được nhắc đến trong hóa 10 mà các em bắt buộc phải học qua chính là liên kết ion. Nhiều em đang cảm thấy băn khoăn và khó hiểu về nội dung bài học này đúng không? HOC247 sẽ giúp bạn hiểu hơn về lý thuyết và phương pháp giải các bài tập liên quan thông qua nội dung Bài 10: Liên kết ion môn Hóa học 10 chương trình SGK Cánh Diều bên dưới đây nhé!
Tóm tắt lý thuyết
1.1. Khái niệm và sự hình thành liên kết ion
- Liên kết ion là một loại liên kết phổ biến trong hoá học, đặc biệt trong các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình.
a. Khái niệm
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trải dấu.
- Khi các phần tử mang điện trái dấu hút nhau tạo thành liên kết hoá học, năng lượng của hệ giảm đi (quá trình toả năng lượng), nên tạo ra hệ bền vững hơn. Sự hình thành liên kết ion từ các cation (ion mang điện tích dương) và anion (ion mang điện tích âm) tuân theo nguyên tắc này.
Ví dụ
- Liên kết ion trong hợp chất NaCl tạo bởi lực hút tĩnh điện giữa ion dương Na+ và ion âm Cl-
Na+ + Cl- → NaCl
- Liên kết ion cũng có thể được hình thành từ ion đa nguyên tử, ví dụ như quá trình:
K+ +NO3- → KNO3
NH4+ + NO3- → NH4NO3
Mg2+ + CO32- → MgCO3
- Các hợp chất được tạo nên từ cation và anion gọi là hợp chất ion
b. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
- Quá trình hình thành liên kết ion như sau:
+ Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron và nguyên tử phi kim nhận electron theo quy tắc octet.
+ Nguyên tử kim loại điển hình nhường electron tạo thành cation. Nguyên tử phi kim điển hình nhận electron tạo thành anion.
Ví dụ
Na → Na+ + 1e
- Số electron trên các lớp 2, 8, 1 2, 8
- Cấu hình electron [Ne]3s1 [Ne]
Cl + 1e → Cl-
- Số electron trên các lớp 2, 8, 7 2, 8, 8
- Cấu hình electron [Ne]3s23p5 [Ar]
- Các ion trải dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng không.
Na+ + Cl- → NaCl
- Nhận xét: Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
|
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu. - Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình. Hợp chất ion được tạo nên từ cation và anion. |
|---|
1.2. Tinh thể ion
- Ở điều kiện thường, các hợp chất ion tồn tại ở dạng tinh thể, đó là các chất rắn mà sự sắp xếp các cation và anion trong không gian tuân theo một trật tự nhất định tạo nên tinh thể ion.
a. Khái niệm
- Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion.
Ví dụ
- Tinh thể muối ăn (NaCl) được hình thành từ các ion Na+ và Cl- sắp xếp cạnh nhau một cách luân phiên (Hình 10.2).
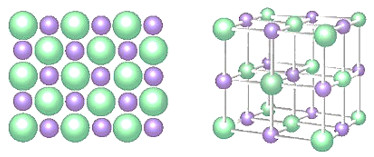
a) Một phần bề mặt của tinh thể NaCl b) Một phần tinh thể NaCl

Hình 10.2. Mô hình cấu trúc tinh thể NaCl
b. Đặc điểm của hợp chất ion
- Các phần tử tạo nên hợp chất ion là các cation và anion. Chủng hút nhau mạnh bằng lực hút tĩnh điện. Do vậy, các phần tử này không chuyển động tự do được. Đây là lí do vì sao các hợp chất son thường là tinh thể rắn ở điều kiện thường. Cũng vì lí do này, các hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao.
Ví dụ
NaCl nóng chảy ở 801°C, sôi ở 1 465°C, NaF nóng chảy ở 993°C, sôi ở 1695°C, CaO nóng chảy ở 2572°C, sôi ở 2850°C.
| Ở điều kiện thường, hợp chất ion thường tồn tại ở dạng tinh thể rắn. |
|---|
Bài tập minh họa
Bài 1: Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
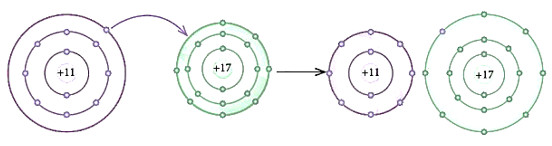
Hình 10.1. Sơ đồ chuyển dịch electron khi hình thành liên kết giữa Na và Cl
Hướng dẫn giải
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng → Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng → Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
→ Cl đã nhận thêm 1 electron từ Na để trở thành các ion
→ Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1
Bài 2: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s2, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. cho nhận.
B. kim loại.
C. cộng hoá trị.
D. ion.
Hướng dẫn giải
X có chứa 2 e lớp ngoài cùng → X là kim loại
Y có 7 e lớp ngoài cùng → Y là phi kim
Vậy liên kết giữa X và Y thuộc loại liên kết ion.
→ Đáp án D
Bài 3: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa canxi và clo trong hợp chất CaCl2 thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Hướng dẫn giải
Cl (Z = 17) : 1s22s22p63s23p5
Ca (Z = 20) : 1s22s22p63s23p64s2
- Clo nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
- Canxi nằm ở ô số 20, chu kỳ 4, nhóm IIA.
- Liên kết trong hợp chất CaCl2 là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
- Sơ đồ hình thành liên kết:
2Cl + 2e → 2Cl-
Ca → Ca2+ + 2e
- Các ion Ca2+và Cl-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất CaCl2: Ca2+ + 2Cl- → CaCl2
Luyện tập Bài 10 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Trình bày được khái niệm và sự hình thành liên kết ion.
- Nêu được cấu tạo tinh thể NaCl. Giải thích được vì sao các hợp chất ion thường ở trạng thái rắn trong điều kiện thường (dạng tinh thể ion).
- Lắp ráp được mô hình tinh thể NaCl (theo mô hình có sẵn).
3.1. Trắc nghiệm Bài 10 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 10 cực hay có đáp án và lời giải chi tiết.
-
- A. AlCl3
- B. CaCl2
- C. CaS
- D. Al2S3
-
- A. HCl.
- B. NH3.
- C. H2O.
- D. MgCl2
-
- A. 2
- B. 3
- C. 4
- D. 5
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 10 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 10 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi trang 53 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 54 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi trang 54 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 54 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 3 trang 54 SGK Hóa học 10 Cánh Diều - CD
Thực hành trang 55 SGK Hóa học 10 Cánh Diều - CD
Vận dụng trang 55 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 56 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 56 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 56 SGK Hóa học 10 Cánh Diều - CD
Giải bài 10.1 trang 27 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.2 trang 28 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.3 trang 28 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.4 trang 28 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.5 trang 28 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.6 trang 28 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.7 trang 29 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.8 trang 29 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.9 trang 29 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.10 trang 29 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.11 trang 29 SBT Hóa học 10 Cánh Diều - CD
Giải bài 10.12 trang 29 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 10 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







