Giải bài 11.17 trang 32 SBT Hóa học 10 Cánh Diều
Xét phân tử H2O, những phát biểu nào sau đây là đúng?
A. Liên kết H – O là liên kết cộng hoá trị không phân cực.
B. Liên kết H – O là liên kết cộng hoá trị phân cực.
C. Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
D. Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử H.
E. Cặp electron dùng chung trong liên kết H – O phân bố đều giữa hai nguyên tử.
G. Nguyên tử O còn hai cặp electron hoá trị riêng.
Hướng dẫn giải chi tiết bài 11.17
Phương pháp giải:
- Dựa vào công thứ lewis của H2O
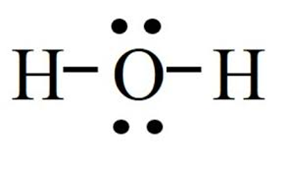
- Nguyên tử O có độ âm điện lớn hơn nguyên tử H
Lời giải chi tiết:
Phát biểu đúng là: B, C, G.
+ B do hiệu độ âm điện của liên kết giữa H và O = 3,44 - 2,20 = 1,24
+ C do oxygen có độ âm điện cao hơn nên cặp electron dùng chung lệch về phía O
+ G do trong công thức lewis của H2O là:
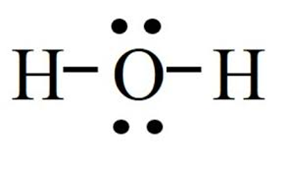
-> oxygen còn 2 cặp electron hóa trị riêng
-- Mod Hóa Học 10 HỌC247
Chưa có câu hỏi nào. Em hãy trở thành người đầu tiên đặt câu hỏi.
Bài tập SGK khác
Giải bài 11.15 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.16 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.18 trang 32 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.19 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.20 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.21 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.22 trang 33 SBT Hóa học 10 Cánh Diều - CD
Giải bài 11.23 trang 33 SBT Hóa học 10 Cánh Diều - CD





