HOC247 xin giới thiệu đến quý thầy cô giáo và các em học sinh Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 được biên soạn và tổng hợp từ đề thi của Trường THPT Lý Thường Kiệt, đề thi gồm có các câu trắc nghiệm và tự luận với đáp án đi kèm sẽ giúp các em luyện tập, làm quen các dạng đề đồng thời đối chiếu kết quả, đánh giá năng lực bản thân từ đó có kế hoạch học tập phù hợp. Mời các em cùng tham khảo!
|
TRƯỜNG THPT LÝ THƯỜNG KIỆT |
ĐỀ THI THỬ VÀO LỚP 10 NĂM 2021 MÔN HÓA HỌC THỜI GIAN 90 PHÚT |
ĐỀ SỐ 1
Câu 1 (3,5 điểm). Dẫn luồng khí CO dư qua hỗn hợp các chất: BaO, CuO, Fe3O4, Al2O3 nung nóng (các chất có số mol bằng nhau). Kết thúc các phản ứng thu được chất rắn X và khí Y. Cho X vào H2O (lấy dư) thu được dung dịch E và phần không tan Q. Cho Q vào dung dịch AgNO3 (số mol AgNO3 bằng hai lần tổng số mol các chất trong hỗn hợp ban đầu) thu được dung dịch T và chất rắn F. Lấy khí Y cho sục qua dung dịch T được dung dịch G và kết tủa H.
1. Xác định thành phần các chất của X, Y, E, Q, F, T, G, H.
2.Viết các phương trình hóa học xảy ra.
Câu 2 (2,5 điểm). Nêu hiện tượng, viết các phương trình hóa học xảy ra trong các thí nghiệm sau:
1. Cho Na vào dung dịch CuSO4.
2. Cho từ từ đến dư dung dịch KOH vào dung dịch AlCl3.
3. Cho bột Cu vào dung dịch FeCl3.
4. Cho rất từ từ đến dư dung dịch HCl vào dung dịch K2CO3 và khuấy đều.
Câu 3 (4,0 điểm). 1. Axit CH3 – CH = CH – COOH vừa có tính chất hóa học tương tự axit axetic vừa có tính chất hóa học tương tự etilen. Viết các phương trình hóa học xảy ra giữa axit trên với: K, KOH, C2H5OH (có mặt H2SO4 đặc, đun nóng) và dung dịch nước brom để minh họa nhận xét trên.
2. Cho sơ đồ biến hóa:
A → B → C → D → E → F ®→ G → H
Hãy gán các chất: C4H10, CH4, C2H4, C2H2, CH3COONa, CH3COOH, C2H5OH, CH3COOC2H5, CH2=CHCl ứng với các chữ cái (không trùng lặp) trong sơ đồ trên và viết các phương trình hóa học thực hiện sơ đồ biến hóa đó.
Câu 4 (5,0 điểm). Cho x gam một muối halogen của một kim loại kiềm tác dụng với 250 ml dung dịch H2SO4 đặc, nóng (vừa đủ). Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp sản phẩm A trong đó có một khí B (mùi trứng thối). Cho khí B tác dụng với dung dịch Pb(NO3)2 (dư) thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại, làm khô thu được 342,4 gam chất rắn T. Nung T đến khối lượng không đổi, thu được 139,2 gam muối M duy nhất.
1. Tính CM của dung dịch H2SO4 ban đầu.
2. Xác định công thức phân tử muối halogen.
3. Tính x.
Câu 5 (5,0 điểm). Cho hỗn hợp X gồm 3 hidrocacbon A, B, C mạch hở, thể khí (ở điều kiện thường). Trong phân tử mỗi chất có thể chứa không quá một liên kết đôi, trong đó có 2 chất với thành phần phần trăm thể tích bằng nhau. Trộn m gam hỗn hợp X với 2,688 lít O2 thu được 3,136 lít hỗn hợp khí Y (các thể tích khí đều đo ở đktc). Đốt cháy hoàn toàn hỗn hợp Y, rồi thu toàn bộ sản phẩm cháy sục từ từ vào dung dịch Ca(OH)2 0,02 M, thu được 2,0 gam kết tủa và khối lượng dung dịch giảm đi 0,188 gam. Đun nóng dung dịch này lại thu thêm 0,2 gam kết tủa nữa (Cho biết các phản ứng hóa học đều xảy ra hoàn toàn).
1. Tính m và thể tích dung dịch Ca(OH)2 đã dùng.
2. Tìm công thức phân tử, công thức cấu tạo của 3 hidrocacbon.
3. Tính thành phần % thể tích của 3 hidrocacbon trong hỗn hợp X.
ĐÁP ÁN ĐỀ SỐ 1
Câu 1: Gọi số mol mỗi oxit là a Þ số mol AgNO3 là 8a
+ Phản ứng khi cho CO dư qua hỗn hợp các chất nung nóng:
CO + CuO → Cu + CO2 (1)
a (mol) a (mol) a (mol)
4CO + Fe3O4 → 3Fe + 4CO2 (2)
a (mol) 3a (mol) 4a (mol)
→Thành phần của X: Cu = a (mol); Fe = 3a (mol); BaO = a (mol); Al2O3 = a (mol)
→ Thành phần khí Y: CO2 = 5a (mol); CO dư
+ Phản ứng khi cho X vào nước dư:
BaO + H2O → Ba(OH)2 (3)
a (mol) a (mol)
Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O (4)
a (mol) a (mol) a (mol)
→ Thành phần dung dịch E: Ba(AlO2)2 = a(mol)
→ Thành phần Q: Cu = a(mol); Fe = 3a(mol)
+ Phản ứng khi cho Q vào dung dịch AgNO3:
Trước hết: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (5)
3a (mol) 6a (mol) 3a(mol) 6a(mol)
Sau đó: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (6)
a(mol) 2a(mol) a(mol) 2a(mol)
→ Thành phần dung dịch T: Fe(NO3)2 = 3a(mol); Cu(NO3)2 = a(mol)
→ Thành phần F: Ag = 8a(mol).
* Nếu không viết 2 phản ứng (5), (6) xảy ra theo thứ tự trừ 0,5 điểm
+ Phản ứng khi cho khí Y sục qua dung dịch T:
2CO2 + 4H2O + Ba(AlO2)2 → Ba(HCO3)2 + 2Al(OH)3 ¯ (7)
2a (mol) a(mol) a(mol) 2a(mol)
→ Thành phần dung dịch G: Ba(HCO3)2 = a(mol)
→ Thành phần H: Al(OH)3 = 2a(mol)
Câu 2: Các phương trình hóa học xảy ra:
1. Hiện tượng: xuất hiện bọt khí và có kết tủa màu xanh
2Na + 2H2O → 2NaOH + H2 (1)
NaOH + CuSO4 → Cu(OH)2 + Na2SO4 (2)
2. Hiện tượng: xuất hiện kết tủa keo trắng, kết tủa lớn dần đến cực đại, sau tan dần đến hết tạo dung dịch trong suốt
AlCl3 + 3KOH → Al(OH)3 + 3KCl (3)
Al(OH)3 + KOH → KAlO2 + 2H2O (4)
3. Hiện tượng: Cu tan, dung dịch từ màu vàng nâu chuyển sang màu xanh
2FeCl3 + Cu → 2FeCl2 + CuCl2 (5)
4. Hiện tượng: lúc đầu chưa xuất hiện khí, sau một lúc có khí xuất hiện
K2CO3 + HCl → KHCO3 + KCl (6)
KHCO3 + HCl → KCl + H2O + CO2 (7)
Câu 3:
1. Các phương trình hóa học minh họa:
2CH3 – CH = CH – COOH + 2K → 2CH3 – CH = CH – COOK+ H2 (1)
CH3 – CH = CH – COOH + KOH → CH3 – CH = CH – COOK+ H2O (2)
CH3 – CH = CH – COOH + C2H5OH → CH3 – CH = CH – COOC2H5 + H2O (3)
CH3 – CH = CH – COOH + Br2 → CH3 – CHBr – CHBr – COOH (4)
2. Gán các chất như sau:
A: C4H10; B: CH3COOH; C: CH3COONa; D:CH4; E: C2H2; F: C2H4 ; G: C2H5OH; H: CH3COOC2H5; L: CH2 = CHCl
PTHH: 2C4H10 + 5O2 → 4CH3COOH + 2H2O (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
CH3COONa(r) + NaOH(r) → CH4 + Na2CO3 (3)
2CH4 → C2H2 + 3H2 (4)
C2H2 + H2 → C2H4 (5)
C2H4 + H2O → C2H5OH 6)
CH3COOH + C2H5OH → CH3COOC2H5 + H2O (7)
nCH2 = CH2 → (- CH2 - CH2-)n (PE) (8)
CH ≡ CH + HCl → CH2 = CHCl (9)
nCH2 = CHCl → (- CH2 - CHCl-)n (PVC) (10)
Câu 4:
1. Vì khí B có mùi trứng thối, khi tác dụng với dung dịch Pb(NO3)2 tạo kết tủa đen Þ B là H2S
+ Gọi công thức tổng quát của muối halogen kim loại kiềm là RX
PƯHH: 8RX + 5H2SO4 đặc → 4R2SO4 + H2S + 4X2 + 4H2O (1)
1,0 0,8 0,2 0,8
(Có thể học sinh viết 2 phương trình hóa học liên tiếp cũng được)
Khí B tác dụng với dung dịch Pb(NO3)2
H2S + Pb(NO3)2 → PbS + 2HNO3 (2)
0,2 0,2 (mol)
Theo phương trình phản ứng (1) \({n_{{H_2}S{O_4}}}\) = 1,0 (mol)
\({C_{{M_{{H_2}S{O_4}}}}}\) = \(\frac{{1,0}}{{0,25}}\) = 4,0(M)
2.+ Sản phẩm A có: R2SO4, X2, H2O, H2S
→ chất rắn T có: R2SO4, X2 . Khi nung T, X2 bay hơi Þ = 139,2g.
→ mX2 = 342,4 – 139,2 = 203,2 (g)
Theo (1) → \({n_{{X_2}}} = 0,8(mol)\)
\({M_{{X_2}}} = \frac{{203,2}}{{0,8}}\) = 254 → Mx = 127 vậy X là Iốt (I)
Ta có \({M_{{M_2}S{O_4}}} = 2R + 96 = \frac{{139,2}}{{0,8}}\) = 174 → R = 39 → R là Kali (K)
Vậy: CTPT muối halogen là: KI
3. Tìm x:
Dựa vào (1) \( \to {n_{RX}} = 8{n_{{H_2}S}}\) = 8 = 1,6 (mol)
→ x = (39 + 127). 1,6 = 265,6 (g)
Câu 5:
1.
\({n_{{O_2}}} = \frac{{2,688}}{{22,4}}\) = 0,12 (mol), n hỗn hợp Y = \(\frac{{3,136}}{{22,4}}\) = 0,14 (mol)
n hỗn hợp X = 0,14 – 0,12 = 0,02 (mol)
Đặt công thức trung bình của A, B, C là:
PƯHH: \({C_{\overline x }}{H_{\overline y }} + (\overline x + \frac{{\overline y }}{4}){O_2} \to \overline x C{O_2} + \frac{{\overline y }}{4}{H_2}O\) (1)
Hỗn hợp sản phẩm đốt cháy Y gồm CO2, H2O, O2 (có thể dư), sục sản phẩm cháy vào dung dịch Ca(OH)2, có PƯHH
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (3)
Ca(HCO3)2 → CaCO3 + H2O + CO2 (4)
Từ (2) → \({n_{C{O_2}}} = {n_{CaC{O_3}\,\,\,(2)}} = \frac{{2,0}}{{100}}\) = 0,02 (mol)
Từ (3), (4) → \({n_{C{O_2}}} = 2{n_{CaC{O_3}\,\,\,\,(3)}} = 2.\frac{{0,2}}{{100}}\) = 0,004 (mol)
Vậy: Tổng số mol CO2 ở sản phẩm cháy tạo ra: 0,02 + 0,004 = 0,024 (mol)
mdd giảm = \({m_{CaC{O_3}\,\,\,(2)}} - ({m_{C{O_2}}} + {m_{{H_2}O}})\) = 0,188 (g)
mH2O = 2,0 - 0,024. 44 – 0,188 = 0,756 (g)
nH2O = 0,042 (mol)
Theo định luật BTKL: mX = mC + mH = 0,024.12 + 0,042. 2 = 0,372 (gam)
nCa(OH)2 = 0,02 + 0,002 = 0,022 (mol)
→ V = \(\frac{{0,022}}{{0,02}}\) = 1,1 (lít)
2. \({n_{{C_n}{H_{2n + 2}}}} = {n_{{H_2}O}} - {n_{C{O_2}}}\) = 0,042 – 0,024 = 0,018 (mol)
Từ ; nX → x = 1,2 → trong X có một chất là CH4
Vậy 3 hidrocacbon có thể có CTTQ thuộc các loại CnH2n + 2, CmH2m (Vì 3 hidrocacbon có tối đa một liên kết đôi)
Chia X thành 3 trường hợp:
Trường hợp 1: X có 3 hiđrocacbon đều có CTTQ CnH2n + 2
nX = - = 0,018 < 0,02 → loại
Trường hợp 2: X gồm CH4, một hiđrocacbon có CTTQ CnH2n + 2 và một hiđrocacbon có CTTQ CmH2m (n,m 4; m 2)
Đặt = x (mol), = y mol, = z mol
Ta có: x + y = 0,018 mol và z = 0,02 – 0,018 = 0,002 mol
a) Nếu: x = y = 0,009
nC = 0,009 .1+ 0,009 . n + 0,002. m = 0,024
→ 9n + 2m = 15
|
m |
2 |
3 |
4 |
|
n |
\(\frac{{11}}{9}\) |
1 |
\(\frac{{7}}{9}\) |
b) Nếu: y = z → x = 0,018 – 0,002 = 0,016
→ nC = 0,016 . 1 + 0,002n + 0,002m = 0,024 → n + m = 4
|
m |
2 |
3 |
4 |
|
n |
2 |
1 |
0 |
Chọn cặp nghiệm: C2H6, C2H4
Vậy công thức phân tử của hỗn hợp X: CH4, C2H6, C2H4
CTCT: CH3 – CH3 , CH2 = CH2; CH4
c) Nếu x= z = 0,02 → y = 0,016
nC = 0,002 . 1 + 0,016n + 0,002m = 0,024 → 8n + m = 11
|
m |
2 |
3 |
4 |
|
n |
9/8 |
1 |
7/8 |
Trường hợp 3: X gồm CH4, một hiđrocacbon có CTTQ CnH2n và một hiđrocacbon có CTTQ CmH2m
CTCT của C4H8
CH3 – CH = CH – CH3 CH2 = CH – CH2 – CH3 CH2 = C(CH3) – CH3
3.a) Trường hợp: CH4, C2H6, C2H4
%CH4 = . 100% = 80% , %C2H6= %C2H4 = 10%
b) Trường hợp: CH4, C2H4, C4H8
%CH4 = . 100% = 90% , %C2H4= %C4H8 = 5%
ĐỀ SỐ 2
Câu 1: (4,0 điểm)
1.1. Cho các chất: C6H6 (l) (benzen); CH3-CH2-CH3 (k); CH3-C≡CH (k); CH3-CH=CH2 (k); SO2 (k); CO2 (k); FeSO4 (dd); saccarozơ (dd). Chất nào có thể làm nhạt màu dung dịch nước brom, giải thích và viết phương trình phản ứng hóa học (nếu có).
1.2. Viết phương trình phản ứng hóa học (nếu có) khi tiến hành nhiệt phân lần lượt các chất rắn sau: KNO3; NaHCO3; Al(OH)3; (NH4)2HPO4.
Câu 2: (4,0 điểm)
a. Viết công thức cấu tạo và gọi tên của tất cả các chất ứng với công thức phân tử C2H4Cl2.
b. Đốt cháy hoàn toàn 3,465gam C2H4Cl2 bằng lượng khí oxi dư, thu được hỗn hợp X (chỉ gồm CO2; O2 dư; hơi nước và khí hiđroclorua). Dẫn từ từ toàn bộ lượng X thu được vào bình kín chứa 798,8587gam dung dịch Ca(OH)2 0,88%, phản ứng xong thu được dung dịch Y. Tính nồng độ phần trăm các chất có trong dung dịch Y?
Yêu cầu: Các kết quả tính gần đúng (câu 2 phần b), được ghi chính xác tới 04 chữ số phần thập phân sau dấu phẩy theo quy tắc làm tròn số của đơn vị tính quy định trong bài toán.
Câu 3: (2,5 điểm)
Nhỏ từ từ dung dịch chỉ chứa chất tan KOH cho đến dư vào lần lượt từng ống nghiệm có chứa các dung dịch (riêng biệt) sau: HCl (có hòa tan một giọt phenolphtalein); MgSO4; Al(NO3)3; FeCl3; Ca(HCO3)2. Giải thích hiện tượng thu được, viết phương trình phản ứng hóa học minh họa.
Câu 4: (2,5 điểm)
Cho 37,95gam hỗn hợp bột X (gồm MgCO3 và RCO3) vào cốc chứa 125,0gam dung dịch H2SO4 a% (loãng). Khuấy đều hỗn hợp cho đến khi phản ứng kết thúc, thu được dung dịch Y; chất rắn Z và 2,8lít (ở đktc) khí CO2.
Cô cạn dung dịch Y được 6,0gam muối khan, còn nung chất rắn Z tới khối lượng không đổi chỉ thu được 30,95gam chất rắn T và V lít (ở 5460 C; 2,0 atm) khí CO2.
a. Tính: a (%); khối lượng (gam) chất rắn Z và V (lít)?
b. Xác định kim loại R, biết trong X số mol của RCO3 gấp 1,5 lần số mol MgCO3.
Câu 5: (3,0 điểm)
Chia 800ml dung dịch hỗn hợp A gồm FeCl3 0,1M và HCl 0,075M thành hai phần (A1 và A2) bằng nhau.
a. Cho từ từ dung dịch NaOH 0,75M vào A1 cho đến khi vừa kết tủa hết lượng sắt (III) có trong A1 thì thấy dùng hết V (ml) và thu được dung dịch B. Tính V (ml) và nồng độ mol dung dịch B?
b. Cho m (gam) kim loại Mg vào A2. Sau khi các phản ứng xảy ra hoàn toàn, thu được 1,344gam chất rắn D và 336ml khí H2 (ở đktc). Tính m (gam)?
Câu 6: (4,0 điểm)
6.1. Đốt cháy hoàn toàn m gam một hợp chất hữu cơ A (chỉ chứa các nguyên tố C, H, N) bằng lượng không khí vừa đủ thu được 17,6gam CO2; 12,6gam H2O; 69,44lít N2 (ở đktc). Xác định m và công thức phân tử của A (biết trong không khí N2 chiếm 80% thể tích).
6.2. Một dãy chất gồm nhiều Hiđrocacbon được biểu diễn bởi công thức chung là CnH2n + 2 (n≥1 và n Î Z). Hãy cho biết thành phần phần trăm theo khối lượng của Hiđro trong các chất biến đổi như thế nào (tăng hay giảm trong giới hạn nào) khi số nguyên tử Cacbon (giá trị n) tăng dần?
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 3
Câu 1: (2,75 điểm)
1. Giải thích ngắn gọn các vấn đề nêu sau:
a. Nguyên nhân gây mưa axit là gì?
b. Tại sao các khu đông dân cư không nên lập các nhà máy sản xuất đất đèn?
2. Có một hỗn hợp bột các oxit: K2O, MgO, BaO. Bằng phương pháp hóa học hãy tách riêng từng kim loại ra khỏi hỗn hợp các oxit trên.
3. Chọn 6 chất rắn khác nhau mà khi cho 6 chất đó lần lượt tác dụng với dung dịch H2SO4 đặc nóng đều thu được sản phẩm chỉ có Fe2(SO4)3 + SO2 + H2O. Viết các phương trình phản ứng minh hoạ.
Câu 2.( 1,75 điểm)
1. Hoàn thành các phương trình phản ứng của sơ đồ sau. Ghi rõ điều kiện (nếu có):

2. Đi từ các chất ban đầu là đá vôi, than đá và được dùng thêm các chất vô cơ cần thiết, hãy viết các phương trình phản ứng điều chế ra polivinyl clorua, 1,2- đicloetan.
Câu 3: (2,5 điểm)
1. Dung dịch X chứa a mol AlCl3 và 2a mol HCl. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị sau:
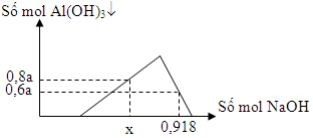
Tính giá trị của x?
2. Hoà tan hoàn toàn 8,24 gam hỗn hợp bột X gồm FexOy và Cu trong lượng dư dung dịch H2SO4 đặc nóng. Sau phản ứng thu được 0,784 lít khí SO2 (sản phẩm khí duy nhất, ở đktc) và dung dịch chứa 21,2 gam hỗn hợp hai muối sunfat.
Tìm công thức oxit sắt và tính khối lượng của mỗi chất trong hỗn hợp X .
3. Đốt 10,98 gam hỗn hợp X gồm Al và Mg trong bình đựng khí clo. Sau một thời gian phản ứng thu được 28,73 gam hỗn hợp Y gồm bốn chất rắn. Cho toàn bộ lượng hỗn hợp Y tan hết vào dung dịch HCl thì thu được V lít H2 (đktc). Dẫn V lít khí này đi qua ống đựng 40 gam CuO nung nóng, sau phản ứng thấy trong ống còn lại 36,16 gam chất rắn và chỉ có 75% lượng H2 đã phản ứng. Tính thành phần phần trăm theo khối lượng mỗi kim loại có trong hỗn hợp X.
Câu 4: (3 điểm)
1. Hỗn hợp A gồm C2H2 và H2. Cho 13,44 lít A đi qua ống đựng chất xúc tác Ni đun nóng, thu được 10,304 lít hỗn hợp khí B gồm 4 chất. Dẫn B đi chậm qua bình đựng nước brom dư cho phản ứng xảy ra hoàn toàn, thu được 7,84 lít hỗn hợp khí C. Biết rằng 1 mol A có khối lượng 8 gam và các thể tích khí đều đo ở điều kiện tiêu chuẩn. Hãy viết các phương trình phản xảy ra và tính thành phần phần trăm theo thể tích của các khí trong hỗn hợp A, B, C.
2. Một hỗn hợp gồm 2 hidrocacbon mạch hở CxH2x và CyH2y. Cứ 9,1 gam X làm mất màu vừa hết 40 gam brom trong dung dịch. Xác định công thức phân tử của 2 hidrocacbon đó. Biết trong X thành phần thể tích của chất có phân tử khối nhỏ hơn nằm trong khoảng từ 65% đến 75%.
3. Cho hidrocacbon X có công thức CnH2n+2 tác dụng với clo trong điều kiện có chiếu sáng thu được 16,65 gam hỗn hợp các dẫn xuất monoclo và điclo. Khí HCl bay ra được hấp thụ hoàn toàn bằng nước sau đó trung hòa bằng dung dịch NaOH thấy cần vừa đủ 250 ml dung dịch NaOH 1,2M. Tìm CTPT của X?
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 4
Câu 1. Hãy chọn chất có phần trăm khối lượng sắt lớn nhất trong các chất sau:
A. FeS
B. FeS2
C. FeO
D. Fe₂O₃
E. Fe₃O₄
Câu 2. Cho các chất: Cu₂S , CuS, CuO, Cu₂O . Hai chất có phần trăm khối lượng Cu bằng nhau là:
A. Cu₂S và Cu₂O
B. CuS và CuO
C. Cu₂S và CuO
D. Không có cặp chất nào
Câu 3. Khử hoàn toàn 0,25 mol Fe₃O₄ bằng H₂ . Sản phẩm hơi cho hấp thụ vào 18 g dung dịch H₂SO₄ 80%. Sau khi hấp thụ nồng độ H₂SO₄ là:
A. 20 %
B. 30 %
C. 40 %
D. 50 %
Câu 4. Khử 16g Fe₂O₃ bằng CO dư, sản phẩm khí thu được cho đi vào bình đựng dung dịch Ca(OH)₂ dư thu được a g kết tủ
A. Giá trị của a là:
A. 10g
B. 20g
C. 30g
D. 40g
Câu 5. Cho a g CuO tác dụng với dung dịch H₂SO₄ thu được 200g dung dịch CuSO₄ nồng độ 16%. Giá trị của a là:
A. 12g
B. 14g
C. 15g
D. 16g
Câu 6. Kim loại nào sau đây nhẹ nhất ( có khối lượng riêng nhỏ nhất) trong số tất cả các kim loại?
A. Liti (Li)
B. Natri (Na)
C. Kali (K)
D. Rubidi (Rb)
Câu 7. Chọn câu phát biển đúng nhất:
Sắt, đồng, nhôm đều có những tính chất vật lí giống nhau:
A. Đều có ánh kim
B. Đều có tính dẫn điện, dẫn nhiệt
C. Đều có thể kéo dài và dát mỏng
D. Cả A, B, C
Câu 8. Kim loại mạnh đẩy kim loại yếu hơn ra khỏi dung dịch muối của nó. Thí dụ minh họa là cặp phản ứng nào sau đây?
A. Na + CuSO₄ -->
B. Zn + FeCO₃ -->
C. Cu + NaCl -->
D. Fe + CuSO₄ -->
E. A, B, D đúng
Câu 9. Hai thanh sắt có khối lượng bằng nhau nhúng vào 2 dung dịch có số mol muối bằng nhau
- Thanh số 1 nhúng vào dung dịch AgNO₃
- Thanh số 2 nhúng vào dung dịch Cu(NO₃)₂
Khi phản ứng kết thúc lấy thanh sắt ra, sấy khô và cân sẽ cho kết quả nào sau đây?
A. Khối lượng 2 thanh vẫn như ban đầu
B. Khối lượng thanh 1 lớn hơn
C. Khối lượng thanh 2 lớn hơn
D. Khối lượng 2 thanh bằng nhau nhưng khác ban đầu
Câu 10. Cho 14,5g hỗn hợp bột Mg, Zn, Fe tác dụng với dung dịch HCl thấy thoát ra 6,72 lít H₂ (đktc). Khối lượng muối tạo ra trong dung dịch là:
A. 35,8 g
B. 36,8 g
C. 3,72 g
D. 37,5 g
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 40 của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
|
1 |
C |
11 |
A |
21 |
D |
31 |
C |
|---|---|---|---|---|---|---|---|
|
2 |
C |
12 |
D |
22 |
A |
32 |
B |
|
3 |
C |
13 |
D |
23 |
B |
33 |
C |
|
4 |
C |
14 |
C |
24 |
A |
34 |
B |
|
5 |
D |
15 |
A |
25 |
A |
35 |
C |
|
6 |
A |
16 |
A |
26 |
B |
36 |
B |
|
7 |
D |
17 |
D |
27 |
A |
37 |
B |
|
8 |
D |
18 |
B |
28 |
C |
38 |
A |
|
9 |
B |
19 |
B |
29 |
A |
39 |
B |
|
10 |
A |
20 |
D |
30 |
A |
40 |
A |
ĐỀ SỐ 5
Câu 1 (2,0 điểm)
1. Viết phương trình phản ứng xảy ra (nếu có) khi:
a) Cho mẩu Ba vào dung dịch NaCl
b) Cho một mẫu Natri vào dung dịch FeCl3.
c) Cho bột Fe vào dung dịch AgNO3 dư.
d) Sục khí SO2 vào dung dịch KMnO4 sau đó cho tiếp dung dịch BaCl2 dư vào.
2. Trong tự nhiên các nguyên tố Ca, Mg có trong quặng đôlômit: CaCO3.MgCO3. Từ quặng này, hãy trình bày phương pháp điều chế CaCO3, MgCO3 ở dạng riêng biệt tinh khiết?
Câu 2 (2,0 điểm)
1. Cho 5 chất khí: CO2, C2H4, C2H2, SO2, CH4 đựng trong 5 bình riêng biệt mất nhãn. Chỉ dùng hai thuốc thử, trình bày phương pháp hóa học phân biệt mỗi bình trên và viết các phương trình phản ứng xảy ra. Các dụng cụ thí nghiệm có đủ.
2. Dùng một lượng dung dịch H2SO4 10%, đun nóng để hòa tan vừa đủ 0,4 mol CuO. Sau phản ứng, làm nguội dung dịch. Khối lượng CuSO4.5H2O tách ra khỏi dung dịch là 30 gam. Tính độ tan của CuSO4 trong điều kiện thí nghiệm trên.
Câu 3 (2,0 điểm):
1.Có sơ đồ biến đổi sau: X→ Y → Z → X → Q
Biết rằng X là đơn chất của phi kim T còn Y, Z là hợp chất gồm 2 nguyên tố, trong đó có chứa T. Dung dịch chất Y làm quỳ tím hóa đỏ. Z là muối của kali, trong đó kali chiếm 52,35% về khối lượng. Q là hợp chất (gồm ba nguyên tố) tạo thành khi cho X tác dụng với dung dịch xút ở nhiệt độ thường.Xác định CTHH của các chất X, Y, Z, Q và viết PTHH biểu diễn các biến đổi trên.
2. Đốt cháy 8,64 gam hỗn hợp Mg và Fe trong khí O2, thu được 12,32 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 12,8 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Tính m?
Câu 4 (2,0 điểm):
1. Cho 3 chất hữu cơ đơn chức: axit X (RCOOH); rượu Y (R'OH); este Z tạo bởi axit X và rượu Y (RCOOR').
Nếu lấy một lượng hỗn hợp gồm X và Z tác dụng vừa đủ với 150 ml dung dịch NaOH 2M (đun nóng) thì thu được 24,6 gam muối Natri.
Nếu lấy 13,8 gam Y tác dụng hết với 11,5 gam Natri thì thu được 25 gam bã rắn khan. Xác định công thức cấu tạo của X, Y, Z.
2. Ba chất hữu cơ A, B, C chứa cùng nhóm chức có công thức phân tử tương ứng là CH2O2, C2H4O2, C3H4O2.
a) Viết công thức cấu tạo và gọi tên các chất A, B, C.
b) Tính khối lượng chất B trong dung dịch thu được khi lên men 1 lít rượu etylic 9,2o. Biết hiệu suất phản ứng quá trình lên men là 80% và khối lượng riêng của rượu etylic nguyên chất là 0,8g/ml.
Câu 5 (2,0 điểm):
1. A là ancol có công thức R(OH)n với R là gốc hidrocacbon. Cho 12,8 gam dung dịch của A trong nước có nồng độ 71,875% tác dụng với Na dư thu được 5,6 lít H2 (đktc). Xác định công thức phân tử và vết công thức cấu tạo của A biết khối lượng phân tử của A là 92.
2. Xà phòng hoá hoàn toàn 0,1 mol một este no đơn chức (có công thức CnH2n+1COOCmH2m+1, n, m nguyên, n ≥ 0, m ≥1) bằng 28 gam dung dịch MOH 20% (M là kim loại kiềm) rồi tiến hành chưng cất sản phẩm thu được 27 gam chất lỏng X và 9,8 gam chất rắn khan Y. Đốt cháy hoàn toàn chất rắn Y thu được V lít CO2 (đktc), H2O và 7,42 gam một muối duy nhất. Tìm công thức của este, tính giá trị của V?
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
Trên đây là phần trích dẫn nội dung Bộ 5 đề thi thử vào lớp 10 môn Hóa học năm 2021 có đáp án Trường THPT Lý Thường Kiệt, để xem nội dung đềy đủ, chi tiết vuii lòng truy cập vào hệ thống hoc247.net!
Ngoài ra các em học sinh có thể tham khảo thêm một số tài liệu cùng chuyên mục khác tại đây:
- Đề tuyển sinh vào lớp 10 Chuyên Hóa năm 2019 - Tỉnh Điện Biên
- Đề thi tuyển sinh vào lớp 10 môn Hóa năm 2019 - Trường THPT Chuyên Thoại Ngọc Hầu
- Đề thi tuyển sinh vào lớp 10 môn Hóa tỉnh Nam Định năm 2019
Chúc các em học tập tốt!











