Để giúp các em học sinh có thêm nhiều tài liệu ôn luyện kiến thức và kĩ năng giải bài tập chuẩn bị cho kì thi học kì sắp tới, HOC247 xin gửi đến Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Mỹ Thọ. Mời các em cùng tham khảo.
|
TRƯỜNG THPT MỸ THỌ |
ĐỀ THI HỌC KÌ 2 NĂM 2021 MÔN HÓA HỌC 10 THỜI GIAN 45 PHÚT |
ĐỀ SỐ 1
A. PHẦN TRẮC NGHIỆM: (4 điểm)
Câu 1: Thuốc thử dùng để phân biệt hai dung dịch NaI và NaCl là
A. Hồ tinh bột. B. Dung dịch AgNO3.
C. Dung dịch nước vôi trong. D. Quỳ tím.
Câu 2: Cho các dung dịch axit: HCl, HF, HBr, HI. Dung dịch có tính axit mạnh nhất là
A. HCl. B. HF. C. HBr. D. HI.
Câu 3: Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của MnO2 là chất
A. môi trường. B. khử. C. bị khử. D. bị oxi hóa.
Câu 4: Hòa tan hoàn toàn 3,6 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là
A. 0,448 lít. B. 4,48 lít. C. 6,72lít. D. 0,672 lít.
Câu 5: Cho khí clo tác dụng với dung dịch X ở nhiệt độ thường thu được Clorua vôi. Dung dịch X là
A. dd KI. B. dd AgNO3. C. dd NaOH. D. dd Ca(OH)2.
Câu 6: Cho 6,72 lít khí clo (đktc) tác dụng hết với m gam nhôm. Giá trị của m là
A. 5,4 gam. B. 2,7 gam. C. 4,05 gam. D. 8,1 gam.
Câu 7: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu.
(c) Dung dịch NaF loãng được dùng làm thuốc ngừa sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5, +7
Trong số các phát biểu trên, số phát biểu sai là
A. 4 B. 1 C. 2 D. 3
Câu 8: Số oxi hóa của Clo trong các hợp chất HCl, HClO, KClO3, HClO2 lần lượt là
A. -1, +1, +5, -1. B. -1, +1, +3, -1. C. -1, +1, +5, +3. D. +1, +1, +5, +3.
Câu 9: Cho các phát biểu sau:
(1) Các halogen là những phi kim mạnh nhất trong mỗi chu kỳ.
(2) Các halogen đều tác dụng trực tiếp với oxi.
(3) Các halogen đều có 7 electron lớp ngoài cùng thuộc phân lớp s và p.
(4) Tính oxi hoá của các halogen tăng dần từ flo đến iot.
Số phát biểu sai là
A. 4. B. 1. C. 3. D. 2.
Câu 10: Cho các phản ứng sau
4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 4. C. 3. D. 1.
Câu 11: Cho phản ứng sau: NaXrắn + H2SO4 đặc NaHSO4 + HX khí
Các hiđro halogennua (HX) có thể điều chế theo phản ứng trên là
A. HF, HCl, HBr, HI. B. HCl, HBr, HI. C. HF, HCl. D. HBr, HI.
Câu 12: Halogen X ở điều kiện thường là chất rắn, màu đen tím. X là
A. Cl2. B. I2. C. Br2. D. F2.
Câu 13: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiệm như sau:
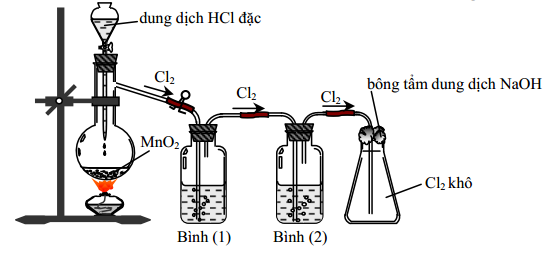
Bình (1) đựng NaCl, bình (2) đựng dung dịch H2SO4 đặc. Vai trò của bình (1) là
A. Giữ lại khí HCl. B. Giữ lại hơi nước.
C. Hòa tan khí Cl2. D. Làm sạch bụi.
Câu 14: Quá trình khử là quá trình
A. nhường proton. B. nhận proton.
C. thu electron. D. nhường electron.
Câu 15: Thể tích khí clo (đktc) thu được khi cho KMnO4 tác dụng hết với dung dịch chứa 0,8 mol HCl (giả thiết hiệu suất đạt 100%) là
A. 4,48 lít. B. 5,6 lít. C. 1,12 lít. D. 8,96 lít.
Câu 16: Cho các kim loại: Na, Zn, Fe, Cu, Ag. Số kim loại phản ứng được với dung dịch HCl là
A. 3. B. 1. C. 4. D. 2.
B. PHẦN TỰ LUẬN: (6 điểm)
Câu 1: (1,0đ) Lập phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron:
HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Câu 2: (2,0đ) Viết phương trình hóa học xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho:
a) Cl2 + H2O b) O2 + I2
c) Ca + F2 d) MgBr2 + AgNO3
Câu 3: (2,0đ) Hòa tan 20 gam hỗn hợp gồm hai kim loại Cu và Al bằng lượng dư dung dịch HCl, sau khi phản ứng hoàn toàn V lít khí H2 (đktc) và còn 3,8 gam kim loại không tan.
a) Tìm % khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Tìm giá trị của V.
Câu 4: (1,0đ) Cho 8,96 lít khí Cl2 (đktc) vào 200 gam dung dịch NaOH 20% ở nhiệt độ thường thu được dung dịch X. Tính khối lượng các chất tan trong dung dịch X.
ĐÁP ÁN ĐỀ SỐ 1
I. Phần trắc nghiệm:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
B |
D |
C |
D |
D |
A |
B |
C |
D |
A |
C |
B |
A |
C |
B |
A |
II. Tự luận:
Câu 1:
HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
- Chất khử HCl
Chất oxi hóa: KMnO4
- Sự oxi hóa: 2Cl → Cl2 + 2e
Sự khử: Mn + 5e → Mn
16HCl+2KMnO4 → 2KCl+2MnCl2+5Cl2+ 8H2O
Câu 2:
a) Cl2 + H2O → HCl + HClO
b) O2 + I2 → (không pư)
c) Ca + F2 → CaF2
d) MgBr2 + AgNO3 → 2AgBr + Mg(NO3)2
Câu 3:
a) Cu + HCl → (Không pư) (*)
2Al + 6HCl → 2AlCl3 + 3H2 (**)
mCu= 3,8 gam
% mCu = 3,8*100/20 = 19%
%mAl = 100 – 19 = 81%
Câu 4:
Cl2 + 2NaOH → NaCl + NaClO + H2O
nNaOH > 2 nCl2 → NaOH dư
pthh => nNaCl = nNaClO = 0,4 mol
mNaCl = 23,4 gam
mNaClO = 29,8 gam
mNaOH(dư) = 8 gam
b) nAl = 16,2/27 = 0,6 (mol)
pt(**) → nH2 = 0,9 (mol)
VH2 = 0,9*22,4 = 20,16 lít
ĐỀ SỐ 2
Câu 1: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là
A. \(n{s^2}n{p^3}.\) B. \(n{s^2}n{p^4}.\) C. \(n{s^2}n{p^5}.\) D. \(n{s^2}n{p^1}.\)
Câu 2: Phản ứng hóa học nào sau đây chứng tỏ HCl có tính khử?
A. \(HCl{\text{ }} + {\text{ }}NaOH \to NaCl + {H_2}O.\) B. \(HCl\; + \;N{H_3} \to N{H_4}Cl.\)
C. \(2HCl\; + Mg\; \to MgC{l_2}\; + {H_2}.\) D. \(4HCl\; + Mn{O_2}\; \to MnC{l_2}\; + C{l_2}\; + \;2{H_2}O.\)
Câu 3: Thuốc thử để nhận biết iot là
A. quỳ tím. B. nước brom. C. hồ tinh bột. D. phenolphtalein.
Câu 4: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
A. Nồng độ các chất tham gia phản ứng.
B. Thời gian xảy ra phản ứng.
C. Bề mặt tiếp xúc giữa các chất phản ứng.
D. Chất xúc tác.
Câu 5: Oxi và ozon là
A. hai hợp chất của oxi. B. hai dạng thù hình của oxi.
C. hai đồng vị của oxi. D. hai đồng phân của oxi.
Câu 6: Chất nào sau đây có tính axit yếu?
A. HF. B. HCl. C. H2SO4 D. HBr
Câu 7: Cho phương trình phản ứng: Để cân bằng chuyển dịch theo chiều thuận cần
A. tăng nhiệt độ. B. giảm áp suất và tăng nồng độ.
C. tăng nồng độ và thêm chất xúc tác. D. thêm chất xúc tác và giảm nhiệt độ.
Câu 8: Cho 200ml dung dịch HCl tác dụng vừa đủ với 300ml dung dịch NaOH 2M. Nồng độ mol của dung dịch sau phản ứng là
A. 1,2M. B. 3,4M. C. 2,1M. D. 4,2M.
Câu 9: Ở dung dịch HCl đặc nhất có nồng độ
A. 20%. B. 37%. C. 68%. D. 98%.
Câu 10: Cặp kim loại nào sau đây thụ động với đặc nguội?
A. Cu, Ag. B. Cu, Cr. C. Al, Fe. D. Zn, Al.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 30 của đề thi số 1 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
|
1C |
2D |
3C |
4B |
5B |
6A |
7A |
8A |
9B |
10C |
|
11C |
12C |
13A |
14B |
15C |
16A |
17D |
18C |
19B |
20D |
|
21D |
22C |
23B |
24A |
25B |
26D |
27C |
28A |
29B |
30C |
ĐỀ SỐ 3
Câu 1. Đặc điểm nào dưới đây là đặc điểm chung của các nguyên tố halogen?
A. Có tính oxi hóa mạnh B. Tác dụng mạnh với nước
C. Vừa có tính oxi hóa vừa có tính khử mạnh D. Ở điều kiện thường là chất khí
Câu 2. Cần bao nhiêu lít khí clo (đktc) đủ để tác dụng với kim loại nhôm tạo ra 26,7 gam AlCl3?
A. 3,36 lít B. 5,6 lít C. 4,48 lít D. 6,72 lít
Câu 3. Hòa tan 100g SO3 vào 1 lít dung dịch H2SO4 17% (D = 1,12 g/ml) thu được dung dịch X. Nồng độ % của dung dịch X:
A. 25,65% B. 30% C. 47,47% D. 40%
Câu 4. Để pha loãng dung dịch H2SO4 đặc trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
A.cho nhanh axit vào nước và khuấy đều. B. cho từ từ nước vào axit và khuấy đều
C.cho nhanh nước vào axit và khuấy đều D. cho từ từ axit vào nước và khuấy đều.
Câu 5. Bằng phương pháp hóa học chất dùng để phân biệt khí H2S và khí SO2 là
A. Dung dịch Pb(NO3)2 B. Dung dịch NaOH C. Dung dịch brom D. Dung dịch KOH
Câu 6. Khí có oxi lẫn hơi nước. Chất nào sau đây là tốt nhất để tách nước ra khỏi oxi?
A. Nhôm oxit B. Nước vôi trong C. Dung dịch natri hidroxit D. Acid sunfuric đặc
Câu 7. Ag để trong không khí bị biến thành màu đen do không khí bị nhiễm bẩn chất nào dưới đây?
A. SO2 và SO3. B. Ozon hoặc hiđrosunfua.
C. HCl hoặc Cl2. D. H2 hoặc hơi nước.
Câu 8. Cho các chất : Cl2, O2, S , SO2, SO3 , H2S , HCl , H2SO4 . Có mấy chất vừa có tính oxi hóa vừa có tính khử ? ?
A. 4 B. 6 C. 5 D. 3
Câu 9. Hệ cân bằng sau được thực hiện trong bình kín : 2SO2 (k) + O2 (k) ⮀ 2 SO3 (k) <0.
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. Biến đổi nhiệt độ B. Biến đổi dung tích của bình phản ứng
C. Biến đổi áp suất D. Sự có mặt chất xúc tác
Câu 10. Chỉ ra đâu không phải là ứng dụng của clorua vôi ?
A. Dùng làm chất khử chua cho đất nhiễm phèn.
B. Tẩy trắng vải, sợi, giấy , tẩy uế cống rãnh, chuồng trại....
C. Dùng để xử lí các chất độc, bảo vệ môi trường.
D. Dùng trong tinh chế dầu mỏ.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 32 của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
|
1A |
2D |
3A |
4D |
5A |
6D |
7B |
8A |
|
9D |
10A |
11D |
12D |
13D |
14D |
15A |
16B |
|
17A |
18B |
19C |
20C |
21C |
22B |
23A |
24C |
|
25A |
26B |
27C |
28D |
29A |
30D |
31A |
32D |
ĐỀ SỐ 4
Câu 1. Hòa tan 100g SO3 vào 1 lít dung dịch H2SO4 17% (D = 1,12 g/ml) thu được dung dịch X. Nồng độ % của dung dịch X:
A. 40% B. 30% C. 25,65% D. 47,47%
Câu 2. Lớp ngoài cùng của nguyên tử các nguyên tố halogen có?
A. 6 electron ở lớp ngoài cùng B. 5 electron ở lớp ngoài cùng
C. 7 electron ở lớp ngoài cùng D. 2 electron ở lớp ngoài cùng
Câu 3. Cho một lượng oxit của kim loại hóa trị II tác dụng vừa đủ với dung dịch H2SO4 20% thì thu được dung dịch muối có nồng độ 22,6% . xác định kim loại trong oxit ?
A. Zn B. Ca C. Fe D. Mg
Câu 4. Cho phản ứng thuận nghịch ở trạng thái cân bằng:
4 NH3 (k) + 3 O2 (k) ⮀ 2 N2 (k) + 6 H2O(h) <0. Cân bằng sẽ chuyển dịch theo chiều thuận khi:
A. Giảm nhiệt độ B. Thêm hơi nước C. Thêm chất xúc tác D. Tăng áp suất
Câu 5. Thuốc thử đặc trưng để nhận biết iot (I2)
A. Qùy tím B. khí oxi C. Nước brom D. Hồ tinh bột
Câu 6. Khi bắt đầu phản ứng , nồng độ một chất là 0,024 mol/l . Sau 20 giây xảy ra phản ứng , nồng độ của chất đó là 0,022 mol/l. Tốc độ trung bình phản ứng trong trường hợp này là :
A. 0,0002 mol/l.s. B. 0,00015 mol/l.s. C. 0,0003 mol/l.s D. 0,0001 mol/l.s.
Câu 7. Cho 3 bình riêng biệt đựng 3 dung dịch HCl, Ba(NO3)2 và H2SO4. Thuốc thử dùng thêm để phân biệt các dung dịch trên là:
A. Dung dịch NaCl B. Quì tím C. Dung dịch NaNO3 D. Dung dịch NaOH
Câu 8. Tìm câu sai: Tại thời điểm cân bằng hóa học thiết lập thì :
A. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
B. Số mol các chất tham gia phản ứng không đổi.
C. Phản ứng không xảy ra nữa.
D. Số mol các sản phẩm không đổi.
Câu 9. Hãy xác định công thức ôlêum tạo thành khi cho 180g dung dịch H2SO4 98% hấp thụ hết 22,4 l SO3 (đktc).
A. H2SO4.1,4SO3 B. H2SO4.SO3 C. H2SO4.0,4SO3 D. H2SO4.2SO3
Câu 10. Cần bao nhiêu lít khí clo (đktc) đủ để tác dụng với kim loại nhôm tạo ra 26,7 gam AlCl3?
A. 6,72 lít B. 4,48 lít C. 3,36 lít D. 5,6 lít
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 32 của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
|
1C |
2C |
3D |
4A |
5D |
6D |
7B |
8C |
|
9C |
10A |
11B |
12B |
13B |
14A |
15A |
16B |
|
17C |
18B |
19B |
20B |
21A |
22A |
23C |
24B |
|
25D |
26D |
27B |
28B |
29C |
30C |
31B |
32C |
ĐỀ SỐ 5
Câu 1. Đặc điểm nào dưới đây là đặc điểm chung của các nguyên tố halogen?
A. Có tính oxi hóa mạnh B. Vừa có tính oxi hóa vừa có tính khử mạnh
C. Ở điều kiện thường là chất khí D. Tác dụng mạnh với nước
Câu 2. Khẳng định nào sai?
A. SO3 làm mất màu dung dịch Brom
B. SO2 và SO3 đều là oxit axit
C. SO2 là khí không màu, mùi hắc, nặng hơn không khí.
D. SO2 và H2S đều có tính khử
Câu 3. Hệ cân bằng sau được thực hiện trong bình kín : 2SO2 (k) + O2 (k) ⮀ 2 SO3 (k) <0.
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. Sự có mặt chất xúc tác
B. Biến đổi dung tích của bình phản ứng
C. Biến đổi nhiệt độ
D. Biến đổi áp suất
Câu 4. Tìm câu sai: Tại thời điểm cân bằng hóa học thiết lập thì :
A. Phản ứng không xảy ra nữa.
B. Số mol các sản phẩm không đổi.
C. Số mol các chất tham gia phản ứng không đổi.
D. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Câu 5. Hòa tan 100g SO3 vào 1 lít dung dịch H2SO4 17% (D = 1,12 g/ml) thu được dung dịch X. Nồng độ % của dung dịch X:
A. 25,65% B. 30% C. 40% D. 47,47%
Câu 6. Cần bao nhiêu lít khí clo (đktc) đủ để tác dụng với kim loại nhôm tạo ra 26,7 gam AlCl3?
A. 4,48 lít B. 3,36 lít C. 6,72 lít D. 5,6 lít
Câu 7. Cho 3 bình riêng biệt đựng 3 dung dịch HCl, Ba(NO3)2 và H2SO4. Thuốc thử dùng thêm để phân biệt các dung dịch trên là:
A. Dung dịch NaOH B. Dung dịch NaNO3 C. Quì tím D. Dung dịch NaCl
Câu 8. Khi bắt đầu phản ứng , nồng độ một chất là 0,024 mol/l . Sau 20 giây xảy ra phản ứng , nồng độ của chất đó là 0,022 mol/l. Tốc độ trung bình phản ứng trong trường hợp này là :
A. 0,0002 mol/l.s. B. 0,0003 mol/l.s C. 0,0001 mol/l.s. D. 0,00015 mol/l.s.
Câu 9. Tính nồng độ mol của150ml dung dịch HCl để phản ứng vừa đủ 200 ml dung dịch AgNO3 1,5M?
A. 1M B. 3M C. 1,5M D. 2M
Câu 10. Khí có oxi lẫn hơi nước. Chất nào sau đây là tốt nhất để tách nước ra khỏi oxi?
A. Acid sunfuric đặc B. Nhôm oxit C. Dung dịch natri hidroxit D. Nước vôi trong
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 32 của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 5
|
1A |
2A |
3A |
4A |
5A |
6C |
7C |
8C |
|
9D |
10A |
11B |
12B |
13B |
14C |
15B |
16B |
|
17D |
18A |
19D |
20B |
21D |
22D |
23D |
24A |
|
25B |
26A |
27D |
28B |
29C |
30D |
31A |
32D |
Trên đây là một phần trích dẫn nội dung Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Mỹ Thọ. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
- Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Phan Đình Phùng
- Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Yên Lạc 2
Chúc các em học tốt!













