Hoc247 xin giới thiệu đến các bạn tài liệu Phân dạng bài tập Chương 5 môn Hóa học 10 năm 2019 - 2020 tài liệu bao gồm các hỏi ở mức độ thông hiểu sẽ giúp các em ôn tập hiệu quả nhất phần Kim loại, kim loại kiềm, kim loại kiềm thổ trong chương trình Hóa học 10. Hy vọng với tài liệu này sẽ cung cấp những kiến thức bổ ích cho các em trong quá trình ôn tập nâng cao kiến thức trước khi bước vào kì thi của mình. Mời các em cùng tham khảo!
PHÂN DẠNG BÀI TẬP CHƯƠNG 5 MÔN HÓA HỌC 10 NĂM HỌC 2019 - 2020
I. BÀI TẬP LÝ THUYẾT
1. Tính chất hóa học
Câu 1: Cho dãy các chất sau, chất nào có khả năng tác dụng với clo? Viết phương trình hóa học của phản ứng xảy ra, gi rõ điều kiện pư: Fe2O3, Fe, FeCl2, CuO, NaOH, H2S, NaBr, NaI.
Câu 2: Cho dãy các chất sau, chất nào có khả năng tác dụng được với axit HCl? Viết phương trình hóa học của phản ứng xảy ra, ghi rõ điều kiện của phản ứng: Fe, FeCl2, FeO, Fe2O3, Fe3O4, KMnO4, Cu, AgNO3, H2SO4, Mg(OH)2.
Câu 3: Giải thích các hiện tượng sau, viết phương trình phản ứng:
a) Cho luồng khí clo qua dung dịch kali bromua một thời gian dài.
b) Thêm dần dần nước clo vào dung dịch kali iotua có chứa sẵn một ít tinh bột.
c) Đưa ra ánh sáng ống nghiệm đựng bạc clorua có nhỏ thêm ít giọt dung dịch quỳ tím.
d) Sục khí lưu huỳnh đioxit vào dung dịch nước brom.
e) Tại sao có thể điều chế nước clo nhưng không thể điều chế nước flo?
f) Tại sao có thể dùng bình thép khô đựng khí Clo mà không được dùng bình thép ướt?
Câu 4: Viết PTHH của các phản ứng xảy ra khi cho clo và iot lần lượt tác dụng với dung dịch KOH ở nhiệt độ thường. Giải thích vì sao có sự khác nhau ở 2 phản ứng đó?
Câu 5: Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, xác định rõ vai trò của các chất?
a. Cl2 + SO2 + H2O → H2SO4 + HCl
b. Cl2 + H2S + H2O → H2SO4 + HCl
c. Cl2 + KOH → KCl + KClO3 + H2O
d. MnO2 + HCl → MnCl2 + Cl2 + H2O
e. KMnO4 + HCl → MnCl2 + KCl + Cl2 + H2O
f. K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O
g. HClO3 + HCl → Cl2 + H2O
Câu 6: a. Viết các ptpư chứng minh độ hoạt động hoá học của: F2 > Cl2 > Br2 > I2.
b. Viết ptpư xảy ra theo thứ tự ưu tiên khi sục khí Cl2 vào dd chứa đồng thời 3 muối: NaCl, NaBr, NaI.
c. Cho Kali pemanganat tác dụng với axit Clohiđric đặc thu được một chất khí màu vàng lục. Dẫn khí thu được vào dung dịch KOH ở nhiệt độ thường và vào dung dịch KOH đã được đun nóng tới 1000C. Viết các ptpư xảy ra.
Câu 7: Lấy một bình cầu đựng đầy nước clo úp ngược lên chậu đựng nước clo rồi đưa cả bình và chậu đó ra ngoài ánh sáng mặt trời. Khí gì sinh ra và tụ lại ở đáy bình cầu?
2. Điều chế các chất
Câu 1: Trong các hình vẽ mô tả cách thu khí clo sau đây, hình vẽ nào mô tả đúng cách thu khí clo trong phòng thí nghiệm? Giải thích?
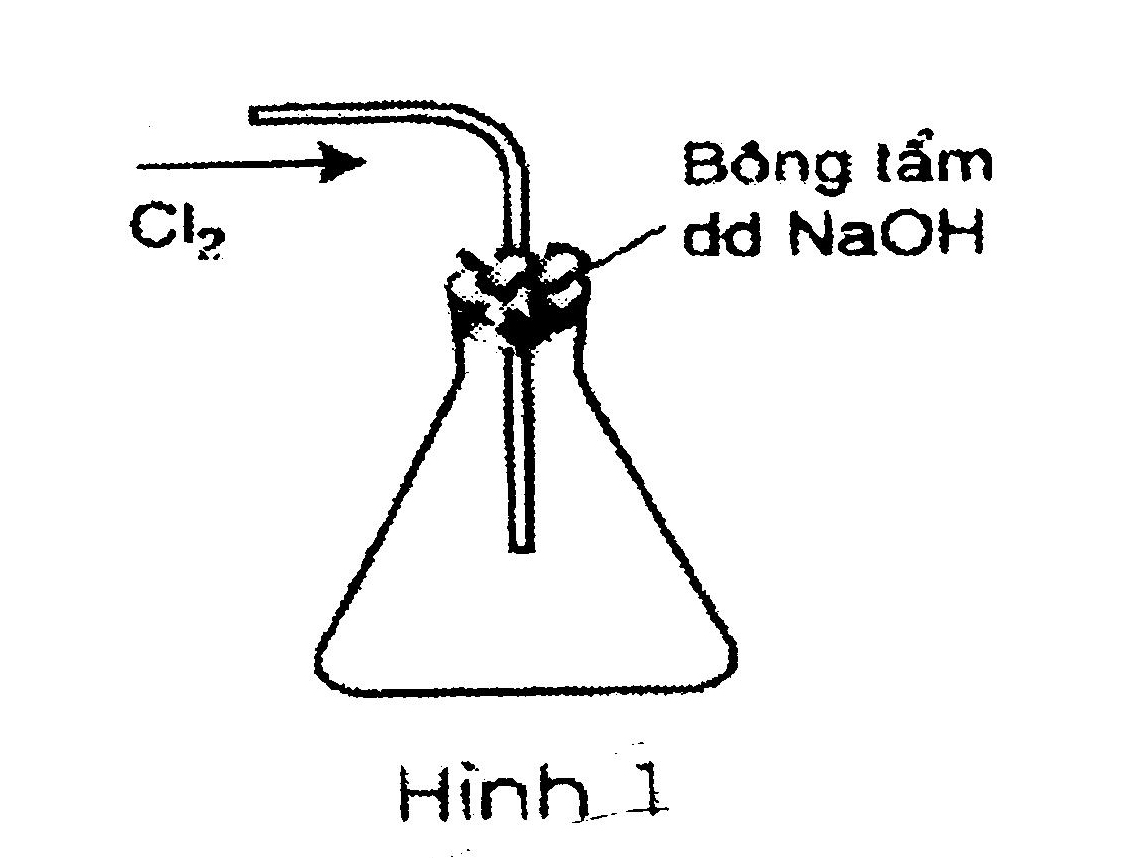
.jpg)
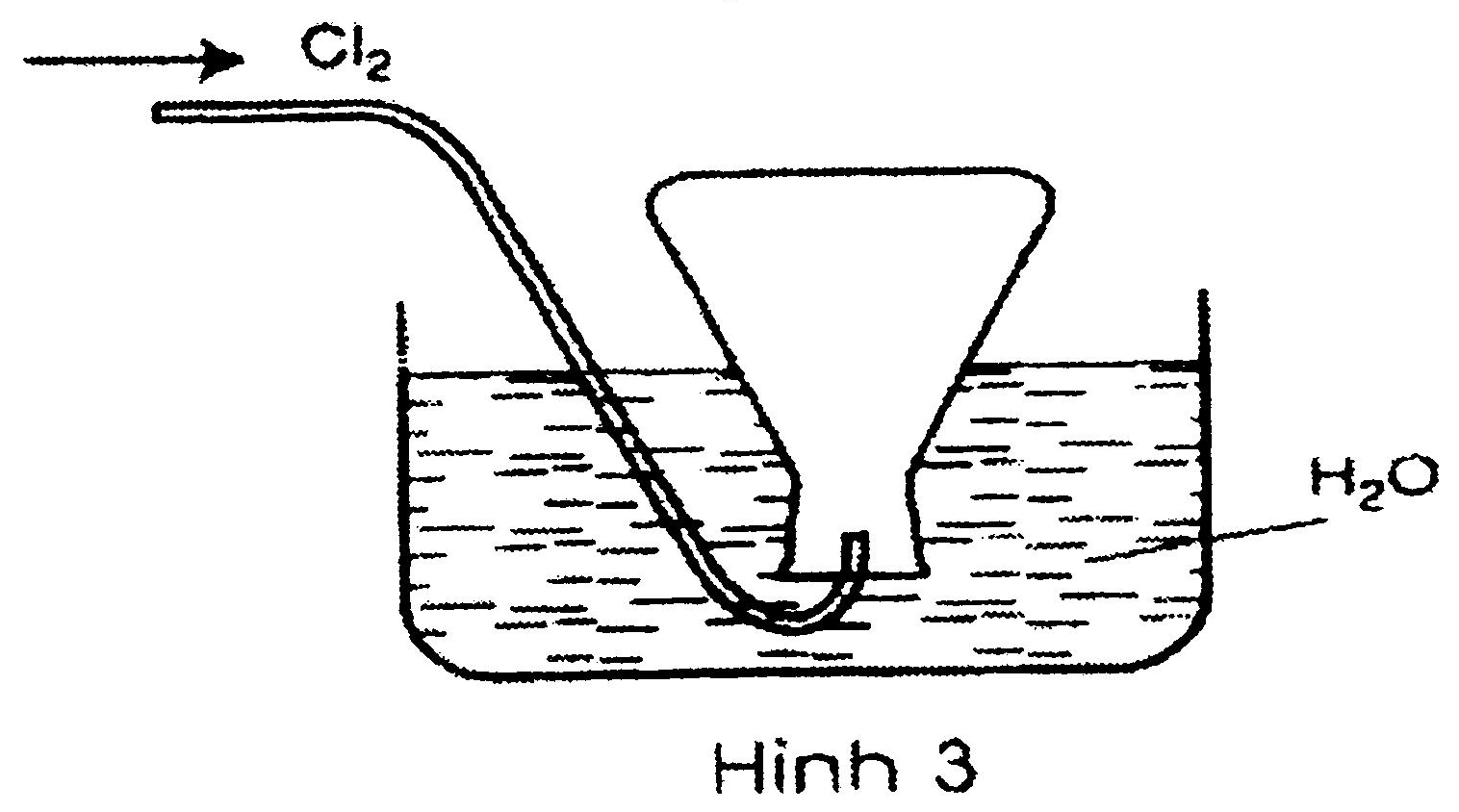
.jpg)
Câu 2: Trong các hình vẽ sau, hình vẽ nào mô tả đúng nhất cách thu khí HCl trong phòng thí nghiệm?
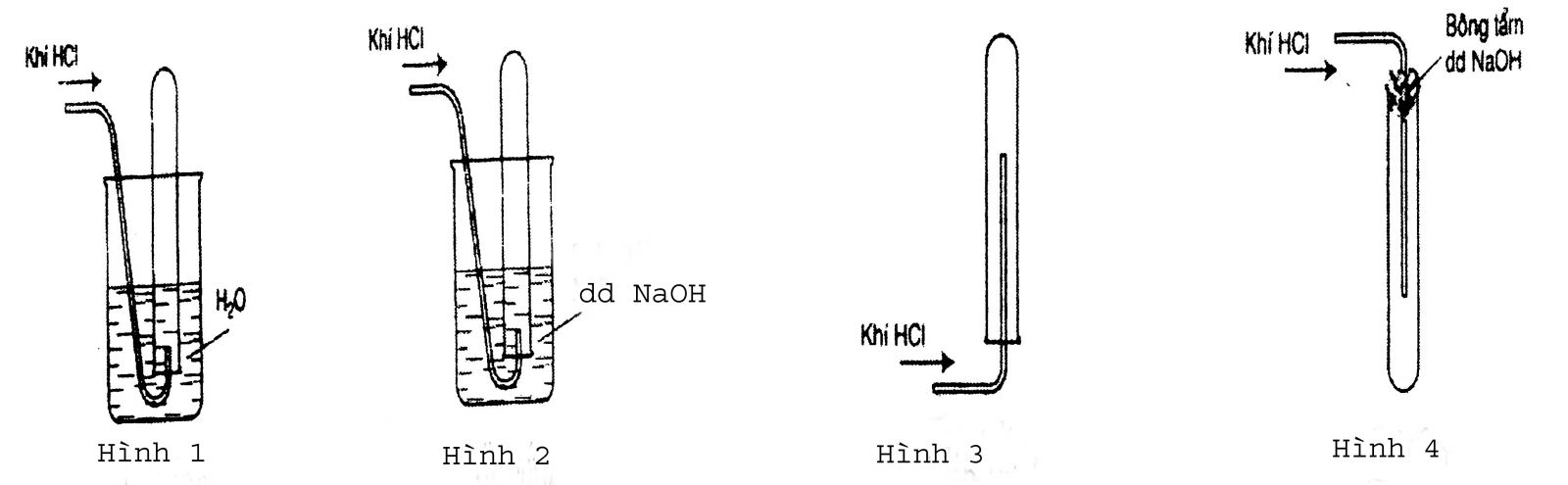
Câu 3: Hãy giải thích:
a. Vì sao người ta có thể điều chế hiđro clorua (HCl), hiđro florua (HF) bằng cách cho H2SO4 đặc tác dụng với muối clorua hoặc florua. Nhưng không thể áp dụng phương pháp này để điều chế hiđro bromua (HBr), hoặc hiđro iotua (HI) ? Viết ptpư điều chế các hiđro haglogenua.
b. Vì sao người ta có thể điều chế các halogen: Cl2, Br2, I2 bằng cách cho hỗn hợp H2SO4 đặc và MnO2 tác dụng với muối clorua, bromua, iotua. Nhưng phương pháp này không thể áp dụng điều chế F2? Viết các phương trình phản ứng điều chế các halogen.
Bằng cách nào có thể điều chế được flo (F2) ? Viết phương trình phản ứng điều chế Flo.
Câu 4: Từ NaCl, MnO2, H2SO4 đặc, Zn, H2O. Hãy viết phương trình hóa học để điều chế khí hiđroclorua và khí clo bằng 2 cách khác nhau?
Câu 5: Từ các chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl đặc.
a. Nếu cho các chất oxi hóa có số mol bằng 1, axít HCl dùng dư thì thể tích khí clo trong mỗi trường hợp thu được tối đa bao nhiêu? Trường hợp nào thu được nhiều khí clo nhất?
b. Nếu cho các chất oxi hóa có cùng khối lượng 100 gam, dùng dư axit HCl thì thể tích khí clo thu được ở mỗi trường hợp là bao nhiêu? Trường hợp nào thu được nhiều khí clo nhất?
Câu 6: Cần bao nhiêu gam KMnO4 và bao nhiêu ml dd axit HCl 2M để điều chế đủ khí clo tác dụng với sắt để tạo nên 16,25 gam FeCl3?
3. Hoàn thành phản ứng
Câu 1: Viết các phương trình phản ứng xảy ra cho các sơ đồ sau:
a) HCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl
b) KMnO4→ Cl2→ HCl → FeCl3 → AgCl → Cl2 → Br2 → I2 → ZnI2 → Zn(OH)2
c) MnO2 → Cl2 → KClO3 → KCl → HCl → Cl2 → Clorua vôi
d) Cl2 → KClO3 → KCl → Cl2 → Ca(ClO)2 → CaCl2 → Cl2 → O2
e) KMnO4 → Cl2 → KClO3 → KCl → Cl2 → HCl → FeCl2 → FeCl3 → Fe(OH)3
f) CaCl2 → NaCl → HCl → Cl2 → CaOCl2 → CaCO3 → CaCl2 → NaCl → NaClO
...
Trên đây là một phần trích dẫn nội dung Phân dạng bài tập Chương 5 môn Hóa học 10 năm 2019 - 2020. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập .
Các em quan tâm có thể tham khảo thêm các tài liệu cùng chuyên mục:
Chúc các em học tập tốt !







