Bộ câu hỏi ôn tập Lý thuyết và bài tập Chương Halogen năm 2020 môn Hóa học 10 Trường THPT Nguyễn Trung Ngạn được Hoc247 sưu tầm và biên tập, nhằm giúp các em học sinh ôn tập và củng cố lại các kiến thức đã học, đồng thời làm quen với các bài tập ôn luyện, hình thành cơ sở kiến thức vững chắc để các em tự tin bước vào kì thi của mình. Mời các em cùng theo dõi!
LÝ THUYẾT VÀ BÀI TẬP CHUYÊN ĐỀ NHÓM HALOGEN MÔN HÓA HỌC 10 NĂM 2020
A. TÓM TẮT LÝ THUYẾT
KIẾN THỨC CƠ BẢN:
I. Đặc điểm cấu tạo:
Nguyên tử halogen có 7e lớp ngoài cùng ns2np5, bán kính nguyên tử nhỏ, có độ âm điện lớn Þ dễ nhận e, halogen có tính oxi hóa mạnh và là phi kim điển hình.
Ion halogenua X- có mức oxi hóa thấp nhất nên thể hiện tính khử.
|
I2 - Br2 - Cl2 - F2 |
Tính oxi hóa tăng dần |
|
2I- - 2Br- - 2Cl- - 2F- |
Tính khử giảm dần |
II. Lí tính:
|
Halogen |
F2 |
Cl2 |
Br2 |
I2 |
|
Trạng thái |
Khí |
Khí |
Lỏng |
Rắn |
|
Màu sắc |
Xanh nhạt |
Vàng lục |
Đỏ nâu |
Tím than |
- Giữa các phân tử X2 chỉ có lực hút Van der Waals yếu nên các halogen hoặc ở trạng thái khí (F2, Cl2) hoặc ở trạng thái lỏng (Br2) dễ bay hơi, cũng có thể ở trạng thái rắn(I2) dễ thăng hoa.
III. Tính oxi hóa của halogen:
Nhóm halogen với 7 điên tử ở lớp ngoài cùng và độ âm điện lớn, nguyên tử halogen X dễ dàng lấy 1 điện tử tạo ra X- có cấu hình khí trơ bền vững.
ns2np5 → ns2np6
Do đó tính chất quan trọng nhất của nhóm halogen là tính oxi hóa, tính này giảm dần từ F2 (chất oxi hóa mạnh nhất) đến I2 (chất oxi hóa trung bình).
Các bậc oxi hóa đặc trưng của các halogen là: -1, 0, + 1, +3, + 5, + 7.
Ở dạng đơn chất, các halogen tồn tại dưới dạng phân tử X2. Có bậc oxi hóa trung gian là 0 là bậc oxi hóa trung gian. Nên nó vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
1. Tính oxi hóa mạnh
Tính oxi hóa: F2 > Cl2 > Br2 > I2.
a) Tác dụng với kim loại: muối halogenua
2M + nX2 → 2MXn
(n: là hóa trị cao nhất của kim loại M).
- F2: Oxi hóa được tất cả các kim loại.
2Au + 3F2 → 2AuF3 (Vàng florua)
- Cl2: Oxi hóa được hầu hết các kim loại (trừ Au, Pt), phản ứng cần đun nóng.
2Fe + 3Cl2 → 2FeCl3 (Sắt (III) clorua)
Cu + Cl2 → CuCl2 (Đồng (II) clorua)
- Br2: Oxi hóa được nhiều kim loại (trừ Au, Pt), phản ứng cần đun nóng.
2Fe + 3Br2 → 2FeBr3 (Sắt (III) bromua)
- I2: Oxi hóa được nhiều kim loại, phản ứng chỉ xảy ra khi đun nóng hoặc khi có mặt của chất xúc tác.
2Al + 3I2 → 2AlI3 (Nhôm iotua)
b) Tác dụng với phi kim.
Các halogen tác dụng được với hầu hết các phi kim trừ N2, O2, C (kim cương).
2P + 3Cl2 → 2PCl3 (Photpho triclorua)
2P + 5Cl2 → 2PCl5 (Photpho pentaclorua)
c) Tác dụng với hiđro khí hiđrohalogenua. (X2 + H2 → 2HX)
|
Tính chất |
F2 |
Cl2 |
Br2 |
H2 |
|
Điều kiện phản ứng |
Ngay trong bóng tối, ở nhiệt độ -252oC |
Cần có ánh sáng, chiếu sáng nổ mạnh |
Cần nhiệt độ cao |
Nhiệt độ cao, xúc tác, phản ứng tn |
|
Phản ứng |
F2+H2 → 2HF |
Cl2+H2 → 2HCl |
Br2+ H2 → 2HBr |
I2+H2 → 2HI |
Ghi nhớ: Khí HX tan trong nước tạo ra dung dịch axit HX, đều là các dung dịch axit mạnh (trừ HF).
d) Tác dụng với hợp chất có tính khử:
F2 + H2S → 2HF + S
F2 + H2O → HF + O2
Cl2 + H2S → 2HCl + S
3FeCl2 + 3Cl2 → 2FeCl3
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
Br2 + H2 → 2HBr
Br2 + 2NaI → 2NaBr + I2
Ghi nhớ: - Halogen có tính OXH mạnh hơn đấy được halogen có tính OXH yếu hơn ra khỏi dung dịch muối (trừ F2)
VD: F2 + dd NaCl không xảy ra phản ứng: F2 + 2NaCl → 2NaF + Cl2
mà xảy ra phản ứng: F2 + H2O → HF + O2
- Nước clo, brom có tính oxi hóa rất mạnh luôn oxihóa chất khử lên bậc oxi hóa cao nhất.
3Cl2 + S + 4H2O → 6HCl + H2SO4
Cl2 + SO2 + 2H2O → 2HCl + H2SO4
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
3Br2 + S + 4H2O → 6HBr + H2SO4
Br2 + SO2 + 2H2O → 2HBr + H2SO4 (phản ứng nhận biết khí SO2).
4Br2 + H2S + 4H2O → 8HBr + H2SO4
2. Vừa oxi hóa – vừa khử.
a) Với H2O.
- Cl2: Phản ứng không hoàn toàn ở nhiệt độ thường
Cl2 + H2O → HCl + HClO (axit hipocloro)
Lưu ý: Nước clo có tính sát khuẩn, tẩy màu là do HClO có tính oxi hóa rất mạnh.
HClO → HCl + O; 2O → O2
- Br2: Ở ứng ở nhiệt độ tường, chậm hơn clo.
Br2 + H2O → HBr + HBrO (axit hipobromo)
- I2: Hầu như không phản ứng.
b) Với dung dịch bazơ.
Cl2 + 2NaOH → NaCl + NaClO + H2O
nước gia ven
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Cl2 + Ca(OH)2 → CaOCl2 + H2O
(cloruavôi)
3Br2 + 6NaOH → 5NaBr + NaBrO3 + 3H2O
Ghi nhớ: Nước gia ven, cloruavôi đều là chất oxi hóa mạnh, tác nhân oxi hóa là Cl+1. Chúng có tính tẩy màu và sát trùng.
---(Nội dung đầy đủ, chi tiết vui lòng xem tại online hoặc đăng nhập để tải về máy)---
Câu 30: Để thu được muối NaCl tinh khiết có lẫn tạp chất NaI ta tiến hành như sau:
A. sục khí F2 đến dư, sau đó nung nóng, cô cạn. B. sục khí Cl2 đến dư, sau đó nung nóng, cô cạn.
C. sục khí Br2 đến dư, sau đó nung nóng, cô cạn. D. Cách làm khác.
Câu 31: Để biết được trong muối NaCl có lẫn tạp chất NaI ta có thể dùng:
A. khí Cl2. B. dung dịch hồ tinh bột.
C. giấy quỳ tím. D. khí Cl2 và dung dịch hồ tinh bột.
Câu 32: Trong dung dịch nước clo có chứa các chất sau:
A. HCl, HClO, Cl2. B. Cl2 và H2O. C. HCl và Cl2. D. HCl, HClO, Cl2 và H2O.
Câu 33: Trong thiên nhiên, clo chủ yếu tồn tại dưới dạng:
A. đơn chất Cl2. B. muối NaCl có trong nước biển.
C. khoáng vật cacnalit (KCl.MgCl2.6H2O). D. khoáng vật sinvinit (KCl.NaCl).
Câu 34: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiêm như sau:
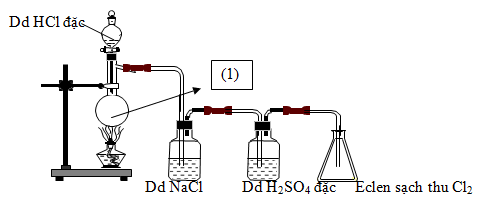
Hóa chất được dung trong bình cầu (1) là:
A. MnO2 B. KMnO4 C. KClO3 D. CaOCl2.
Câu 35: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiệm như sau:

Bình (1) đựng NaCl, bình (2) đựng dung dịch H2SO4 đặc. Vai trò của bình (1) là gì?
A. Hòa tan khí Cl2. B. Giữ lại khí HCl.
C. Giữ lại hơi nước. D. Làm sạch bụi.
Câu 36: Phương pháp để điều chế khí F2 trong công nghiệp là:
A. oxi hóa muối florua. B. dùng halogen khác đẩy flo ra khỏi muối.
C. điện phân hỗn hợp KF và HF ở thể lỏng. D. không có phương pháp nào.
Câu 37: Sẽ quan sát được hiện tượng gì khi ta thêm dần dần nước clo vào dung dịch KI có chứa sẵn một ít hồ tinh bột ?
A. không có hiện tượng gì. B. Có hơi màu tím bay lên.
C. Dung dịch chuyển sang màu vàng. D. Dung dịch có màu xanh đặc trưng.
Câu 38: Số oxi hóa của brom trong các hợp chất HBr, HBrO, KBrO3, BrF3 lần lượt là:
A. -1, +1, +1, +3. B. -1, +1, +2, +3. C. -1, +1, +5, +3. D. +1, +1, +5, +3.
Câu 40: Cho m gam bột sắt vào dung dịch hỗn hợp gồm 0,15 mol CuSO4 và 0,2 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kim loại. Giá trị của m là
A. 16,0. B. 18,0. C. 16,8. D. 11,
Câu 41: Phương pháp để loại bỏ tạp chất HCl có lẫn trong khí H2S là: Cho hỗn hợp khí lội từ từ qua một lượng dư dung dịch
A. Pb(NO3)2. B. NaHS. C. AgNO3. D. NaOH.
Câu 42: Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24%. B. 11,79%. C. 28,21%. D. 15,76%.
Câu 43: Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol (hoặc mol/l) của HCl trong dung dịch đã dùng là
A. 0,75M. B. 1M. C. 0,25M. D. 0,5M.
Câu 44: Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị hai không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M
A. Mg. B. Ca. C. Be. D. Cu.
Câu 45: Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hóa trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là
A. Ba. B. Be. C. Mg. D. Ca.
Câu 46: Hoà tan hoàn toàn 25,12 gam hỗn hợp Mg, Al, Fe trong dung dịch HCl dư thu được 13,44 lít khí H2 (đktc) và m gam muối. Giá trị của m là
A. 67,72. B. 46,42. C. 68,92 D. 47,02.
Câu 47: Cho 42,4 gam hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3 : 1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn. Giá trị của m là
A. 12,8. B. 19,2. C. 9,6. D. 6,4.
Câu 48: Khi hoà tan hoàn toàn 0,02 mol Au bằng nước cường toan thì số mol HCl phản ứng và số mol NO (sản phẩm khử duy nhất) tạo thành lần lượt là
A. 0,03 và 0,02. B. 0,06 và 0,01. C. 0,03 và 0,01. D. 0,06 và 0,02.
Câu 49: Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là
A. N, P, F, O. B. N, P, O, F. C. P, N, O, F. D. P, N, F, O.
Câu 50: Cho 31,84g hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa. Công thức của 2 muối là
A. NaBr và NaI. B. NaF và NaCl. C. NaCl và NaBr. D. Không xác định được.
Câu 51: Trong các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5, +7
(e) Tính khử của các halogenua tăng dần theo thứ tự F-, Cl-, Br-, I-.
Trong số các phát biểu trên, số phát biểu đúng là
A. 2 B. 3 C. 4 D. 5
Câu 52: Cho các phản ứng sau
4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 3. B. 1. C. 4. D. 2.
Câu 53: Cho các phản ứng sau
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
2HCl + Fe → FeCl2 + H2.
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
6HCl + 2Al → 2AlCl3 + 3H2.
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 4. B. 2. C. 3. D. 1.
Câu 54: Cho dãy các chất và ion: Cl2, F2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn2+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hoá và tính khử là
A. 3. B. 4. C. 5. D. 6.
Câu 55: Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là
A. KMnO4. B. CaOCl2. C. K2Cr2O7. D. MnO2.
Câu 56: Cho m gam đơn chất halogen X2 tác dụng với Mg dư thu được 19g muối. Cũng m gam X2 cho tác dụng với Al dư thu được 17,8g muối. X là
A. Flo. B. Clo. C. Iot. D. Brom.
Câu 57: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 52,8%. B. 58,2%. C. 47,2%. D. 41,8%.
Câu 58: Trong các chất: FeCl2, FeCl3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3. Số chất có cả tính oxi hoá và tính khử là
A. 3. B. 2. C. 5. D. 4.
Câu 59: Phản ứng giữa hydro và chất nào sau đây thuận nghịch
A. Flo. B. Clo. C. Iot. D. Brom
Câu 60: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân dung dịch NaCl có màng ngăn. B. điện phân nóng chảy NaCl.
C. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl. D. cho dd HCl đặc tác dụng với MnO2, đun nóng.
Câu 61: Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là (cho Cl = 35,5; K = 39)
A. 0,48M. B. 0,24M. C. 0,4M. D. 0,2M.
Câu 62: Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 28,7. B. 68,2. C. 57,4. D. 10,8.
Câu 63: Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I
A. Có số oxi hoá -1 trong mọi hợp chất
B. Tạo ra hợp chất liên kết cộng hoá trị co cực với hidro
C. Nguyên tử chỉ co khả năng thu thêm 1 e
D. Lớp electron ngoài cùng của nguyên tử có 7 electron
Câu 64: Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA (phân nhóm chính nhóm II) tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là (cho Be = 9, Mg = 24, Ca = 40, Sr = 87, Ba = 137)
A. Ca và Sr. B. Sr và Ba. C. Mg và Ca. D. Be và Mg.
Câu 65: Chất dùng để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc . B. Na2SO3 khan.
C. dung dịch NaOH đặc. D. CaO .
Câu 66: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. Mg(HCO3)2, HCOONa, CuO. B. AgNO3, (NH4)2CO3, CuS.
C. KNO3, CaCO3, Fe(OH)3. D. FeS, BaSO4, KOH.
Câu 67: Cho phản ứng sau: NaXrắn + H2SO4 đặc → NaHSO4 + HX khí
Các hiđro halogennua (HX) có thể điều chế theo phản ứng trên là
A. HCl, HBr, HI B. HF, HCl C. HBr, HI D. HF, HCl, HBr, HI
Câu 68: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (ở đktc) đã phản ứng là
A. 17,92 lít B. 6,72 lít C. 8,96 lít D. 11,2 lít
Câu 69: Dẫn 4,48 lít khí gồm N2 và Cl2 vào dung dịch Ca(OH)2 dư. Sau khi các phản ứng xảy ra hoàn toàn, còn lại 1,12 lít khí thoát ra. Biết thể tích các khí đo ở đktc. Phần trăm thể tích khí Cl2 trong hỗn hợp trên là
A. 88,38% B. 75,00% C. 25,00% D. 11,62%
...
Trên đây là nội dung Lý thuyết và bài tập Chương Halogen năm 2020 môn Hóa học 10 Trường THPT Nguyễn Trung Ngạn. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập .
Ngoài ra các em có thể tham khảo thêm một số tài liệu cùng chuyên mục sau đây:
- Bộ câu hỏi ôn tập Chương Halogen môn Hóa học 10 năm học 2019-2020 Trường THPT Nam Hưng
- Đề kiểm tra 1 tiết Chương Halogen môn Hóa học 10 năm 2019-2020 Trường THPT Vĩnh Lộc
Chúc các em học tập tốt !







