Với mong muốn có thêm tài liệu cung cấp giúp các em học sinh ôn tập rèn luyện chuẩn bị cho kì thi giữa Học kì 2 lớp 10 sắp tới. HOC247 giới thiệu đến các em tài liệu Đề cương ôn tập giữa học kì 2 môn Hoá 10 CTST năm 2022-2023 trường THPT Gia Định. Hi vọng đây là tài liệu hữu ích cho các em trong quá trình học tập và ôn thi môn Hoá học 10.
|
TRƯỜNG THPT GIA ĐỊNH |
ĐỀ CƯƠNG ÔN TẬP GIỮA HỌC KÌ 2 NĂM HỌC 2022 – 2023 MÔN: HOÁ HỌC 10 − CTST |
A. TRẮC NGHIỆM
Câu 1: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
Câu 2: Hợp chất nào dưới đây không tạo được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. NH3
D. HF
Câu 3: Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
Câu 4: Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác (có độ âm điện lớn thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết là
A. liên kết ion.
B. liên kết cộng hóa trị có cực.
C. liên kết hydrogen.
D. liên kết cộng hóa trị không cực.
Câu 5: Liên kết hydrogen và tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất.
C. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
D. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất.
Câu 6: Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất
A. Kr.
B. Ne.
C. Ar.
D. Xe.
Câu 7: So sánh nhiệt độ sôi và nhiệt độ nóng chảy của các chất F2, Cl2, Br2, I2.
A. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 > Br2 > I2 > Cl2.
B. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 > Cl2 > Br2 > I2.
C. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 < Br2 < I2 < Cl2.
D. Nhiệt độ sôi và nhiệt độ nóng chảy: F2 < Cl2 < Br2 < I2.
Câu 8: Nguyên nhân làm cho các liên kết phân cực là
A. sự chênh lệch năng lượng liên kết.
B. do bán kính của nguyên tử.
C. do liên kết hidro trong phân tử.
D. sự chênh lệch độ âm điện lớn.
Câu 9: Tương tác van der Waals tăng khi
A. khối lượng phân tử giảm, kích thước phân tử tăng.
B. khối lượng phân tử tăng, kích thước phân tử giảm.
C. khối lượng phân tử tăng, kích thước phân tử tăng.
D. khối lượng phân tử giảm, kích thước phân tử giảm.
Câu 10: Giữa nước và HF có thể tạo ra ít nhất được bao nhiêu kiểu liên kết hydrogen?
A. 2.
B. 5.
C. 4.
D. 3.
Câu 11: Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:
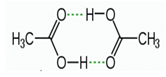
Trong sơ đồ trên, đường nét đứt đại diện cho
A. liên kết hydrogen.
B. liên kết ion.
C. liên kết cho – nhận.
D. liên kết cộng hóa trị có cực.
Câu 12: Chất khử là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 13: Chất oxi hóa là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 14: Quá trình oxi hóa( Sự oxi hóa) là quá trình
A. chất oxi hóa cho electron
B. chất khử cho electron
C. chất khử nhận electron
D. chất oxi hóa nhận electron
Câu 15: Quá trình khử( Sự khử) là quá trinh
A. chất oxi hóa cho electron
B. chất khử cho electron
C. chất khử nhận electron
D. chất oxi hóa nhận electron
Câu 16: Cho quá trình: \(\;\mathop {Fe}\limits^{ + 2} \to \;\mathop {Fe}\limits^{ + 3} + {\rm{ }}1e.\) Đây là quá trình gì?
A. Quá trình oxi hóa.
B. Quá trình khử .
C. Quá trình nhận proton.
D. tự oxi hóa – khử.
Câu 17: Cho quá trình: \(\mathop N\limits^{ + 5} + 3e \to \;\mathop N\limits^{ + 2} .\) Đây là quá trình gì?
A. Quá trình oxi hóa.
B. Quá trình khử .
C. Quá trình nhận proton.
D. tự oxi hóa – khử.
Câu 18: Quá trình oxh - khử nào không đúng?
\(\begin{array}{l} {\rm{A}}{\rm{.}}\,\mathop S\limits^{ + 4} + 4e \to \mathop S\limits^0 \\ {\rm{B}}{\rm{.}}\,\mathop S\limits^{ + 6} + 4e \to \mathop S\limits^{ + 2} \\ {\rm{C}}{\rm{.}}\,\mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} + 2e\\ {\rm{D}}{\rm{.}}\,\mathop S\limits^{ + 4} \to \mathop S\limits^0 + 4e \end{array}\)
Câu 19: Cho phản ứng: 2Na + Cl2→ 2NaCl. Trong phản ứng này, nguyên tử sodium
A. bị oxi hóa
B. bị khử
C. vừa bị oxi hóa, vừa bị khử
D. môi trường
Câu 20: Cho phản ứng: Zn + 2HCl → ZnCl2 + H2 Trong phản ứng này, chất oxi hóa là
A. Zn
B. HCl
C . ZnCl2
D. H2
...
B. TỰ LUẬN
Câu 1: Có nhiều hiện tượng xảy ra xung quanh ta, hãy nêu một phản ứng oxi hóa- khử và cho biết tác dụng(tác hại) đối với cuộc sống hằng ngày. Nêu chất khử và chất oxi hóa trong phản ứng đó.
Câu 2: Lập phương trình hóa học của các phản ứng oxi hóa-khử bằng phương pháp thăng bằng electron.
(Thực hiện đầy đủ 4 bước)
a/ MnO2 + HCl → MnCl2 + Cl2 + H2O
b/ NH3 + O2 → NO + H2O.
c/ H2S + O2 → SO2 + H2O.
d/ Al + HNO3 →Al(NO3)3 + N2O + H2O
e/ FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
f/ SO2 + KMnO4 + H2O K2SO4 + MnSO4 + H2SO4
Câu 3: Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
a) Hãy viết phương trình hóa học của phản ứng.
b) Khi chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20 mL dung dịch K2Cr2O7 0,01M. Người lái xe đó có vi phạm luật hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
Câu 4: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Tính biến thiên enthalpy chuẩn của phản ứng.
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
Câu 5: Xác định biến thiên enthalpy chuẩn của phản ứng C2H2(g) + 2H2(g) →C2H6(g)
biết năng lượng liên kết (ở điều kiện chuẩn):
Eb (H–H) = 436 kJ/mol; Eb (C–H) = 418 kJ/mol; Eb (C-C) = 347 kJ/mol; Eb (C =C) = 614 kJ/mol; Eb (C C) = 839 kJ/mol.
...
---(Để xem tiếp nội dung câu hỏi trắc nghiệm và tự luận, các em vui lòng xem online hoặc đăng nhập để tải về máy)---
Trên đây là một phần trích đoạn nội dung Đề cương ôn tập giữa học kì 2 môn Hoá 10 CTST năm 2022-2023. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Chúc các em học tập tốt!







