HOC247 xin giới thiệu đến các em học sinh Bộ 5 đề thi giữa HK2 môn Hóa học 10 năm 2021-2022 Trường THPT Nguyễn Khuyến. Tài liệu các câu hỏi trắc nghiệm có đáp án đi kèm. Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập hiệu quả và đạt điểm số cao trong kì thi sắp tới.
|
TRƯỜNG THPT NGUYỄN KHUYẾN |
ĐỀ THI GIỮA HỌC KÌ 2 MÔN HÓA HỌC 10 NĂM HỌC 2021-2022 Thời gian làm bài 45 phút |
ĐỀ THI SỐ 1
A. PHẦN TRẮC NGHIỆM
Câu 1: Thể tích khí clo (đktc) thu được khi cho MnO2 tác dụng hết với dung dịch chứa 0,8 mol HCl (giả thiết hiệu suất đạt 100%) là
A. 4,48 lít. B. 8,96 lít. C. 1,12 lít. D. 5,6 lít.
Câu 2: Cho các phản ứng sau
2HCl + Fe → FeCl2 + H2.
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
6HCl + 2Al → 2AlCl3 + 3H2.
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 3. B. 4. C. 1. D. 2.
Câu 3: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiệm như sau:
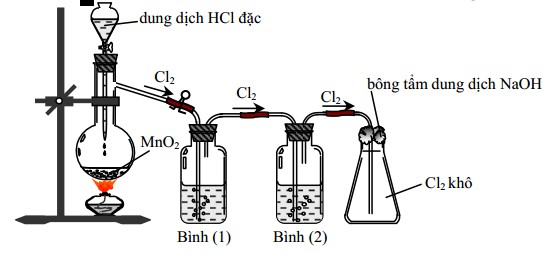
Bình (1) đựng NaCl, bình (2) đựng dung dịch H2SO4 đặc. Vai trò của bình (2) là
A. Giữ lại hơi nước.
B. Hòa tan khí Cl2.
C. Giữ lại khí HCl.
D. Làm sạch bụi.
Câu 4: Cho khí clo tác dụng với dung dịch X ở nhiệt độ thường thu được nước Gia-ven. Dung dịch X là
A. dd KI. B. dd Ca(OH)2. C. dd NaOH. D. dd AgNO3.
Câu 5: Cho V lít khí clo (đktc) tác dụng hết với 2,7 gam nhôm. Giá trị của V là
A. 3,36 lít. B. 2,24 lít. C. 6,72 lít. D. 4,48 lít.
Câu 6: Số oxi hóa của brom trong các hợp chất HBr, HBrO, KBrO3, AlBr3 lần lượt là
A. -1, +1, +5, +3. B. +1, +1, +5, +3. C. -1, +1, +3, -1. D. -1, +1, +5, -1.
Câu 7: Thuốc thử dùng để phân biệt hai dung dịch HCl và HF là
A. Dung dịch AgNO3.
B. Dung dịch nước vôi trong.
C. Quỳ tím.
D. Hồ tinh bột.
Câu 8: Cho các kim loại: Na, Zn, Fe, Cu, Ag. Số kim loại không phản ứng với dung dịch HCl là
A. 3. B. 1. C. 2. D. 4.
Câu 9: Halogen X ở điều kiện thường là chất lỏng, màu đỏ nâu. X là
A. Br2. B. Cl2. C. I2. D. F2.
Câu 10: Quá trình oxi hóa là quá trình
A. nhận proton.
B. nhường proton.
C. nhường electron.
D. thu electron.
Câu 11: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu.
(c) Dung dịch NaF loãng được dùng làm thuốc ngừa sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5, +7
Trong số các phát biểu trên, số phát biểu đúng là
A. 2 B. 1 C. 3 D. 4
Câu 12: Hòa tan hoàn toàn 36 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là
A. 4,48 lít. B. 0,448 lít. C. 0,672 lít. D. 6,72lít.
Câu 13: Cho các phát biểu sau:
(1) Các halogen là những phi kim mạnh nhất trong mỗi chu kỳ.
(2) Các halogen đều tác dụng trực tiếp với oxi.
(3) Các halogen đều có 7 electron lớp ngoài cùng thuộc phân lớp s và p.
(4) Tính oxi hoá của các halogen tăng dần từ flo đến iot.
Số phát biểu đúng là
A. 2. B. 1. C. 3. D. 4.
Câu 14: Trong phản ứng: 2FeCl3 + H2S → 2FeCl2 + S + 2HCl. Cho biết vai trò của FeCl3 là
A. chất khử. B. môi trường. C. chất oxi hóa . D. chất bị oxi hóa.
Câu 15: Cho phản ứng sau: NaXrắn + H2SO4 đặc → NaHSO4 + HX khí
Các hiđro halogennua (HX) không thể điều chế theo phản ứng trên là
A. HF, HCl, HBr, HI. B. HF, HCl. C. HBr, HI. D. HCl, HBr, HI.
Câu 16: Cho các dung dịch axit: HCl, HF, HBr, HI. Dung dịch có tính axit yếu nhất là
A. HBr. B. HCl. C. HF. D. HI.
B. PHẦN TỰ LUẬN:
Câu 1: Lập phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron:
Br2 + H2S + H2O → HBr + H2SO4
Câu 2: Viết phương trình hóa học xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho:
a) Br2 + O2
b) H2 + Cl2
c) Al + F2
d) CuCl2 + AgNO3
Câu 3: Hòa tan 15 gam hỗn hợp gồm hai kim loại Fe và Cu bằng lượng dư dung dịch HCl, sau khi phản ứng hoàn toàn V lít khí H2 (đktc) và còn 3,8 gam kim loại không tan.
a) Tìm % khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Tìm giá trị của V.
Câu 4: Cho 3,36 lít khí Cl2 (đktc) vào 60 gam dung dịch NaOH 25% ở nhiệt độ thường thu được dung dịch X. Tính khối lượng các chất tan trong dung dịch X.
ĐÁP ÁN ĐỀ THI SỐ 1
I. Phần đáp án câu trắc nghiệm:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
A |
D |
A |
C |
A |
D |
A |
C |
A |
C |
C |
D |
A |
C |
C |
C |
II. Tự luận:
Câu 1:
0 +1 -2 +1 -2 +1 -1 +1 +6 -2
Br2 + H2S + H2O → HBr + H2SO4
- Chất khử H2S
Chất oxi hóa: Br2
- Sự oxi hóa -2 +6
S → S + 8e x1
Sự khử 0 -1
Br2 + 2e→ 2Br x4
0 +1 -2 +1 -2 +1 -1 +1 +6 -2
4Br2 + H2S + 4H2O → 8HBr + H2SO4
Câu 2:
a) Br2 + O2 → (Không pư)
b) H2 + Cl2 → 2HCl
c) 2Al + 3F2 → 2AlF3
d) CuCl2 + AgNO3 → 2AgCl+Cu(NO3)2
Câu 3:
a) Cu + HCl →(Không pư) (*)
Fe + 2HCl → FeCl2 + H2 (**)
mCu= 3,8 gam
% mCu = 3,8*100/15 = 25,33%
%mFe = 100 – 25,33 = 74,67%
b) nFe = 11,2/56 = 0,2 (mol)
pt(**) → nH2 = 0,2 (mol)
VH2 = 0,9*22,4 = 4,48 lít
Câu 4:
Cl2 + 2NaOH → NaCl + NaClO + H2O
nNaOH > 2 nCl2 → NaOH dư
pthh → nNaCl = nNaClO = 0,15 mol
mNaCl = 8,775 gam
mNaClO = 11,175 gam
mNaOH(dư) = 3 gam
ĐỀ THI SỐ 2
ĐỀ THI GIỮA HK2 MÔN HOÁ HỌC 10 NĂM 2022 TRƯỜNG THPT NGUYỄN KHUYẾN - ĐỀ SỐ 2
I. Trắc nghiệm
Câu 1: Phát biểu nào sau đây là sai?
A. Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo.
B. Độ âm điện của brom lớn hơn độ âm điện của iot.
C. Tính khử của ion Br- lớn hơn tính khử của ion Cl-.
D. Tính axit của HF mạnh hơn tính axit của HCl.
Câu 2: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. Ag, CaCO3, CuO.
B. FeS, BaSO4, KOH.
C. AgNO3, (NH4)2CO3, Cu.
D. Mg(HCO3)2, AgNO3, CuO.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 4: Cho kim loại M tác dụng với Cl2 được muối X; cho kim loại M tác dụng với dung dịch HCl được muối Y. Nếu cho kim loại M tác dụng với dung dịch muối X ta cũng được muối Y. Kim loại M có thể là
A. Mg.
B. Zn.
C. Al.
D. Fe.
Câu 5: Khi cho dung dịch AgNO3 phản ứng với dung dịch nào sau đây sẽ cho kết tủa màu vàng đậm nhất?
A. Dung dịch HI.
B. Dung dịch HCl.
C. Dung dịch HBr.
D. Dung dịch HF.
Câu 6: Trong phản ứng: Cl2 + H2O ↔ HCl + HClO, clo đóng vai trò
A. không là chất oxi hóa, không là chất khử.
B. là chất oxi hóa.
C. là chất khử.
D. vừa là chất oxi hóa, vừa là chất khử.
Câu 7: Trong phòng thí nghiệm, dung dịch HF không được bảo quản trong bình làm bằng chất liệu nào?
A. Nhựa.
B. Gốm sứ.
C. Thủy tinh.
D. Polime.
Câu 8: Cho 5,4 gam Al phản ứng hoàn toàn với dung dịch HCl loãng, dư thu được bao nhiêu lít khí H2 (đktc)?
A. 4,48 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 7,84 lít.
Câu 9: Cho 0,1 mol KMnO4 tác dụng với dung dịch HCl dư, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít.
B. 5,6 lít.
C. 2,24 lít.
D. 0,112 lít.
Câu 10: Khi cho mẩu quỳ tím ẩm vào bình đựng khí Cl2, hiện tượng thu được là
A. quỳ tím chuyển sang màu đỏ.
B. quỳ tím không chuyển màu.
C. quỳ tím chuyển sang màu đỏ, sau đó mất màu.
D. quỳ tím chuyển sang màu xanh.
II. Tự luận
Câu 1: Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: MgCl2, KBr, KCl.
Câu 2: Cho m gam hỗn hợp G gồm: CaCO3 và Al vào một lượng vừa đủ V lít dung dịch HCl 2M. Sau phản ứng thu được dung dịch A và 8,96 lít khí B ở đktc. Cô cạn A thu được 37,8 gam muối khan.
1/ Xác định % khối lượng của các chất trong G.
2/ Tính CM của các chất trong A.
Câu 3: Cho 5,965gam hỗn hợp A gồm: NaX, NaY (X,Y là hai halogen liên tiếp, nguyên tử khối của X < Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 1,435gam kết tủa. Xác định hai nguyên tố X, Y.
Câu 4: Sục V lít Cl2 ở đktc vào 100ml dung dịch C gồm: NaF 1M; NaBr 3M và KI 2M thu được dung dịch D. Cô cạn D thu được 41,1 gam chất rắn khan E. Xác định V.
ĐÁP ÁN ĐỀ THI SỐ 2
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
D |
B |
D |
A |
D |
C |
C |
B |
C |
---(Để xem tiếp nội dung phần còn lại của đề thi số 2 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐỀ THI SỐ 3
ĐỀ THI GIỮA HK2 MÔN HOÁ HỌC 10 NĂM 2022 TRƯỜNG THPT NGUYỄN KHUYẾN - ĐỀ SỐ 3
I. Trắc nghiệm
Câu 1: Số electron lớp ngoài cùng của các nguyên tố halogen là
A. 4.
B. 5.
C. 6.
D. 7.
Câu 2: X là nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn. Trong oxit cao nhất của X, oxi chiếm 61,202% về khối lượng. Nguyên tố X là?
A. F.
B. Cl.
C. Br.
D. I.
Câu 3: Dẫn khí clo vào nước xảy ra hiện tượng nào sau đây?
A. Hiện tượng vật lý.
B. Hiện tượng hóa học.
C. Vừa xảy ra hiện tượng vật lý, vừa xảy ra hiện tượng hóa học.
D. Không có hiện tượng nào xảy ra.
Câu 4: Cho 0,2 gam một muối canxi halogen (A) tác dụng với một lượng dư dung dịch AgNO3 thì thấy thu được 0,376 gam kết tủa bạc halogenua. Công thức của muối A là
A. CaF2.
B. CaCl2.
C. CaBr2.
D. CaI2.
Câu 5: Nhận xét nào sau đây là đúng về tính oxi hóa của Br2?
A. Tính oxi hóa của brom mạnh hơn flo nhưng yếu hơn clo.
B. Tính oxi hóa của brom mạnh hơn clo nhưng yếu hơn iot.
C. Tính oxi hóa của brom mạnh hơn iot nhưng yếu hơn clo.
D. Tính oxi hóa của brom mạnh hơn flo nhưng yếu hơn iot.
Câu 6: Clorua vôi thu được khi cho clo phản ứng với
A. Ca(OH)2.
B. NaOH.
C. KOH.
D. H2O.
Câu 7: Cho 0,25 mol MnO2 tác dụng với lượng dư HCl đặc, đun nóng. Thể tích khí clo thu được ở đktc là?
A. 2,24 lít.
B. 3,36 lít.
C. 5,6 lít.
D. 6,72 lít.
Câu 8: Cho 1,15 gam Na tác dụng vừa đủ với halogen (X2) thu được 5,15 gam muối. Nguyên tố halogen X là
A. Flo.
B. Clo.
C. Brom.
D. Iot.
Câu 9: Muốn điều chế axit clohiđric từ khí hiđroclorua, ta có thể dùng phương pháp nào sau đây?
A. Cho khí này hòa tan trong nước.
B. Oxi hóa khí này bằng MnO2.
C. Oxi hóa khí này bằng KMnO4.
D. Cho khí này tác dụng với H2SO4 loãng.
Câu 10: Nguyên tố X có cấu hình electron là 1s22s22p63s23p5. Nguyên tố X có đặc điểm nào sau đây?
A. X thuộc ô 17, chu kì 3, nhóm VIIA trong bảng tuần hoàn.
B. X là kim loại có 7 electron lớp ngoài cùng.
C. X có 17 nơtron trong nguyên tử.
D. X là flo.
II. Tự luận
Câu 1: Viết các phương trình hóa học xảy ra trong các trường hợp sau:
a/ Sắt tác dụng với clo
b/ Flo tác dụng với nước
c/ CuO tác dụng với dd HCl
d/ Điều chế clorua vôi.
Câu 2 ( 2 điểm): Bằng phương pháp hóa học hãy phân biệt các dung dịch sau chứa trong các lọ riêng biệt mất nhãn: KCl, BaCl2, NaI. Viết phương trình hóa học xảy ra.
Câu 3 ( 2 điểm): Cho 2,92 gam hỗn hợp A gồm Fe và Mg tác dụng hoàn toàn với 200 ml ddHCl 1M. Sau phản ứng thu được dung dịch B và 1,232 lít khí (đktc). Tính % khối lượng mỗi chất trong A và khối lượng HCl đã tham gia phản ứng.
Câu 4 ( 1 điểm): ): Một muối được tạo bởi kim loại hóa trị II và phi kim hóa trị I. Hòa tan m gam muối này vào nước và chia dung dịch làm hai phần bằng nhau:
- Phần I: Cho tác dụng với dung dịch AgNO3 có dư thì được 2,87 gam kết tủa.
- Phần II : Nhúng một thanh sắt vào dung dịch muối, sau một thời gian phản ứng kết thúc khối lượng thanh sắt tăng lên 0,08 gam.
Tìm công thức phân tử của muối.
ĐÁP ÁN ĐỀ THI SỐ 3
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
B |
C |
C |
C |
A |
C |
C |
A |
A |
---(Để xem tiếp nội dung phần còn lại của đề thi số 3 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐỀ THI SỐ 4
ĐỀ THI GIỮA HK2 MÔN HOÁ HỌC 10 NĂM 2022 TRƯỜNG THPT NGUYỄN KHUYẾN - ĐỀ SỐ 4
I. Trắc nghiệm
Câu 1: Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5?
A. Nhóm IVA.
B. Nhóm VB.
C. Nhóm VIA.
D. Nhóm VIIA.
Câu 2: Chất khí nào sau đây dùng để diệt trùng nước sinh hoạt, nước bể bơi...?
A. Cl2.
B. SO2.
C. HCl.
D. O2.
Câu 3: Cho 0,1 mol K2Cr2O7 tác dụng với lượng dư HCl đặc. Thể tích khí clo thu được ở đktc là?
A. 2,24 lít.
B. 3,36 lít.
C. 5,6 lít.
D. 6,72 lít.
Câu 4: Đổ dung dịch chứa 1 gam NaOH vào dung dịch chứa 1 gam HCl. Nhúng giấy quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu đỏ.
B. Màu xanh.
C. Không đổi màu.
D. Không xác định được.
Câu 5: Cho 0,05 mol halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam muối. Nguyên tố halogen là
A. Br.
B. Cl.
C. F.
D. I.
Câu 6: Trong các đơn chất halogen, chất ở trạng thái lỏng là
A. Cl2.
B. F2.
C. Br2.
D. I2.
Câu 7: Công thức của clorua vôi là
A. Ca2OCl.
B. CaClO2.
C. Ca(OCl)2.
D. CaOCl2.
Câu 8: Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,2 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 27,05 gam.
B. 39,75 gam.
C. 10,8 gam.
D. 14,35 gam.
Câu 9: Mức độ phân cực của liên kết hóa học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là
A. HI, HCl, HBr.
B. HCl, HBr, HI.
C. HI, HBr, HCl.
D. HBr, HI, HCl.
Câu 10: Tổng hệ số nguyên tối giản của phương trình hóa học:
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O là
A. 35.
B. 34.
C. 36.
D. 33.
II. Tự luận
Câu 1: Viết các phương trình phản ứng trong các trường hợp sau:
a/ Cl2 tác dụng với nước
b/ I2 tác dụng với H2 (tº, xúc tác Pt)
c/ Fe(OH)3 tác dụng với dd HCl.
d/ Cl2 tác dụng với dd NaBr
Câu 2: Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: MgCl2, KBr, HCl. Viết phương trình hóa học xảy ra.
Câu 3: Cho 5,7 gam hỗn hợp X gồm Fe và FeCO3 vào một lượng vừa đủ dung dịch HCl. Kết thúc phản ứng thấy thu được dung dịch A và 1,68 lít khí B ở đktc. Tính % khối lượng mỗi chất có trong hỗn hợp X.
Câu 4: Cho 6,72 lít (đktc) hỗn hợp X gồm O2, Cl2 có dX/H2=22,5 tác dụng vừa đủ với m (g) hỗn hợp Y gồm Al và Zn thu được 31,9 gam hỗn hợp B gồm muối clorua và oxit của 2 kim loại. Tính m và %m mỗi chất trong Y?
ĐÁP ÁN ĐỀ THI SỐ 4
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
A |
D |
A |
A |
C |
D |
D |
B |
A |
---(Để xem tiếp nội dung phần còn lại của đề thi số 5 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐỀ THI SỐ 5
ĐỀ THI GIỮA HK2 MÔN HOÁ HỌC 10 NĂM 2022 TRƯỜNG THPT NGUYỄN KHUYẾN - ĐỀ SỐ 5
I. Trắc nghiệm
Câu 1: Trong các halogen sau, halogen nào có tính khử mạnh nhất?
A. Flo.
B. Clo.
C. Brom.
D. Iot.
Câu 2: Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I)?
A. Có số oxi hoá -1 trong mọi hợp chất.
B. Tạo ra hợp chất liên kết cộng hoá trị có cực với hiđro.
C. Nguyên tử có khả năng thu thêm 1e.
D. Lớp electron ngoài cùng của nguyên tử có 7 electron.
Câu 3: Nội dung nào dưới đây là sai?
A. Ở điều kiện thường, clo là chất khí, màu vàng lục.
B. Khí clo tan tốt trong các dung môi hữu cơ như benzen, etanol...
C. Tính chất hóa học cơ bản của clo là tính khử mạnh.
D. Trong các hợp chất với oxi, clo đều có số oxi hóa dương.
Câu 4: Cho 0,672 gam Fe và 0,02 mol Cl2 tham gia phản ứng hoàn toàn với nhau. Khối lượng muối thu được là
A. 2,17 gam.
B. 1,95 gam.
C. 4,34 gam.
D. 3,90 gam.
Câu 5: Trong y tế, đơn chất halogen nào được hòa tan trong etanol để dùng làm chất sát trùng vết thương?
A. Cl2.
B. F2.
C. I2.
D. Br2.
Câu 6: Cho 1,62 gam khí HX (X là halogen) vào nước thu được dung dịch A. Cho dung dịch A tác dụng với lượng dư dung dịch AgNO3 thu được 3,76 gam kết tủa. Khí HX là
A. HI.
B. HF.
C. HCl.
D. HBr.
Câu 7: Cho các phương trình hóa học sau:
(a) Cl2 + 2NaBr → 2NaCl + Br2
(b) F2 + 2NaCl → 2NaF + Cl2
(c) HF + AgNO3 → AgF + HNO3
(d) HCl + AgNO3 → AgCl + HNO3
Số phương trình hóa học viết đúng là
A. 4.
B. 1.
C. 2.
D. 3.
Câu 8: Chỉ dùng một thuốc thử nào sau đây có thể phân biệt các dung dịch HCl, MgBr2, KI?
A. AgNO3.
B. NaCl.
C. NaOH.
D. Ba(NO3)2.
Câu 9: Chất nào sau đây được dùng để tẩy uế chuồng trại chăn nuối, cống rãnh, hố rác…?
A. Clo.
B. Axit clohiđric.
C. Natri clorua.
D. Clorua vôi.
Câu 10: Cho 1,2 gam một kim loại X có hóa trị II vào một lượng HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng lên 1,1 gam. Kim loại X là
A. Fe.
B. Mg.
C. Ba.
D. Ca.
II. Tự luận
Câu 1 ( 2,5 điểm): Viết các PTHH theo sơ đồ sau:
MnO2 → Cl2 → FeCl3 → Fe(OH)3 → FeCl3 → AgCl.
Câu 2 ( 1,5 điểm): Cho hỗn hợp X gồm 1,4 gam Fe và 1,6 gam Cu phản ứng hoàn toàn với một lượng khí Cl2 dư. Kết thúc phản ứng thấy thu được m gam muối. Tính m và thể tích khí Cl2 ở đktc cần dùng để phản ứng hết với lượng kim loại trên.
Câu 3 ( 2 điểm): Cho 1,395 gam hỗn hợp A gồm MgX2 và MgY2 (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, MX < MY) phản ứng hoàn toàn với dd AgNO3 dư, thu được 3,315 gam kết tủa. Xác định hai nguyên tố X, Y.
Câu 4 ( 1 điểm): Hoà tan hỗn hợp bột gồm m gam Cu và 4,64 gam Fe3O4 vào dung dịch HCl rất dư, sau khi các phản ứng kết thúc chỉ thu được dung dịch X. Dung dịch X làm mất màu vừa đủ 50 ml dung dịch KMnO4 0,1M. Giá trị của m là ?
ĐÁP ÁN ĐỀ THI SỐ 5
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
A |
C |
B |
C |
D |
C |
A |
D |
B |
---(Để xem tiếp nội dung phần còn lại của đề thi số 5 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
Trên đây là trích dẫn một phần nội dung Bộ 5 đề thi giữa HK2 môn Hóa học 10 năm 2021-2022 có đáp án Trường THPT Nguyễn Khuyến. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
Thi Online:
Chúc các em học tốt!









