Để chuẩn bị cho kì thi giữa học kì 1 sắp tới, HOC247 giới thiệu đến các em tài liệu Bộ 5 đề thi giữa HK1 môn Hóa học 10 Cánh Diều có đáp án năm 2022-2023 Trường THPT Đức Thọ được tổng hợp và biên soạn giúp các em không những hoàn thiện kiến thức Hóa học 10 Cánh Diều mà còn củng cố kĩ năng làm bài. Hi vọng tài liệu này sẽ giúp các em khái quát được toàn bộ kiến thức quan trọng. Chúc các em học tốt nhé!
|
TRƯỜNG THPT ĐỨC THỌ |
ĐỀ THI GIỮA HỌC KÌ 1 MÔN HÓA HỌC 10 CD NĂM HỌC 2022-2023 Thời gian làm bài: 45 phút |
1. ĐỀ SỐ 1
I. Trắc nghiệm (5 điểm)
Câu 1: Chọn phát biểu sai
A. Lớp K là lớp gần hạt nhân nhất và có năng lượng thấp nhất
B. Phân lớp 4s có năng lượng cao hơn phân lớp 3d
C. Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 phân lớp
Câu 2: Cho các phát biểu sau
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và neutron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân, nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Câu 3: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là (11Na; 13Al; 15P; 17Cl; Fe)
A. Fe và Cl.
B. Na và Cl.
C. Al và Cl.
D. Al và P.
Câu 4: Xét ba nguyên tố X ( Z = 2); Y ( Z = 16), T ( Z =19). Phát biểu nào sau đây đúng
A. X là khí hiếm, Y là phi kim, T là kim loại.
B. X và T là kim loại, Y là phi kim.
C. X, Y là khí hiếm, T là kim loại.
D. Tất cả đều sai.
Câu 5: Cấu hình electron của nguyên tử nguyên tố X có dạng (Ne)3s23p3. Phát biểu nào sau đây là sai?
A. Lớp ngoài cùng của X có 5 electron.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Câu 6: Trong tự nhiên, nguyên tố boron có 2 đồng vị: 11B và 10B. Biết nguyên tử khối trung bình của boron là 10,812 và xem nguyên tử khối mỗi đồng vị có giá trị bằng số khối. Nếu có 406 nguyên tử 11B thì số nguyên tử 10B là
A. 94.
B. 100.
C. 50.
D. 406.
Câu 7: Nguyên tố hoá học là
A. những nguyên tử có cùng số neutron.
B. những nguyên tử có cùng điện tích hạt nhân.
C. những phân tử có cùng phân tử khối.
D. những nguyên tử có cùng số khối.
Câu 8: Nguyên tử nguyên tố X có tổng electron s là 5. Số hiệu nguyên tử của X là
A. 12
B.7
C. 11
D. 5
Câu 9: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là:
A. phi kim và kim loại.
B. kim loại và kim loại.
C. khí hiếm và kim loại.
D. kim loại và khí hiếm.
Câu 10: Cho các cấu hình electron của các nguyên tố sau
(1) 1s22s22p63s2
(2) 1s22s22p63s23p5
(3) 1s22s22p63s23p63d54s2
(4) 1s22s22p6
Nguyên tố kim loại là
A. (1), (3).
B. (1), (2), (4).
C. (2), (4).
D. (2), (3), (4).
II. Tự luận (5 điểm)
Câu 1 (3 điểm) Trong tự nhiên, chlorine có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của Chlorine bằng 35,5.
a) Tính tỉ lệ phần trăm số nguyên tử của từng đồng vị.
b) Có bao nhiêu nguyên tử 35Cl trong 2,24 lít khí Cl2 (đktc)?
c) Tính thành phần phần trăm khối lượng của đồng vị 37Cl có trong 31,2 gam BaCl2 (Cho Ba = 137).
d) Trong tự nhiên hydrogen có 2 đồng vị 1H, 2H. Hỏi có tối đa bao nhiêu loại phân tử HCl? Tính
phân tử khối của từng loại.
Câu 2 (2 điểm) Tổng số hạt proton, electron, neutron trong nguyên tử nguyên tố X là 48, trong đó số hạt mang điện gấp đôi số hạt không mang điện.
a) Tính số hạt mỗi loại, số hiệu nguyên tử, số khối của X. X là nguyên tố nào.
b) Viết cấu hình electron của X. X là kim loại? Phi kim? Khí hiếm?
c) Biểu diễn lớp ngoài cùng theo ô orbital và xác định số electron độc thân của X
ĐÁP ÁN ĐỀ SỐ 1
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
B |
C |
A |
D |
A |
B |
C |
A |
A |
Câu 1:
a) Gọi % số nguyên tử của đồng vị 35Cl là x
=> % số nguyên tử của đồng vị 37Cl là 100 – x
Áp dụng CT tính nguyên tử khối trung bình
\(\overline {{{\rm{A}}_{\rm{B}}}} {\rm{ = }}\frac{{{\rm{x}}{\rm{.35 + (100 - x)}}{\rm{.37}}}}{{{\rm{100}}}}{\rm{ = 35,5}}\)
=> x = 75%
% số nguyên tử của đồng vị 35Cl 75%
% số nguyên tử của đồng vị 37Cl là 25%
b)
\({{\rm{n}}_{{\rm{C}}{{\rm{l}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{2,24}}}}{{{\rm{22,4}}}}{\rm{ = 0,1(mol)}}\)
Số nguyên tử Cl (trong Cl2) = 0,1.2.6,02.1023 = 12,04.1022 (nguyên tử)
=> Số nguyên tử 35Cl = 12,04.1022. 75% = 9,03.1022 (nguyên tử)
c)
\({{\rm{n}}_{{\rm{BaC}}{{\rm{l}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{31,2}}}}{{{\rm{208}}}}{\rm{ = 0,15 (mol)}}\)
=> Số nguyên tử Cl trong BaCl2 = 0,15.2. 6,02.1023 = 1,806.1023 (nguyên tử)
=> Số nguyên tử 37Cl = 1,806.1023 . 25% = 4,515.1022 (nguyên tử)
d) Có thể tạo ra tối đa 4 loại phân tử HCl
(1) 1H35Cl M = 36
(2) 1H37Cl M = 38
(3) 2H35 M = 37
(4) 2H37Cl M = 39
Câu 2:
Gọi P, N, E lần lượt là số proton, neutron và electron của X cần tìm
Tổng số hạt proton, electron, neutron trong nguyên tử nguyên tố X là 48
→ P + E + N = 48 (1)
Số hạt mang điện gấp đôi số hạt không mang điện
→ P + N = 2N (2)
Mà P = E (3)
Từ (1), (2) và (3), giải hệ phương trình => P = E = 16 và N = 16
Số hiệu nguyên tử Z = P = E = 16
Số khối A = P + N = 16 + 16 = 32
=> X là sulfur (S)
b) Cấu hình e của X : 1s22s22p63s23p4
X có 6 electron lớp ngoài cùng => X là phi kim
c) Lớp ngoài cùng: n = 3
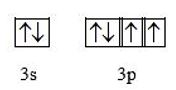
Biểu diễn theo ô orbital:
=> X có 2 electron độc thân
2. ĐỀ SỐ 2
I. Trắc nghiệm (5 điểm)
Câu 1: Vỏ nguyên tử gồm các electron chuyển động như thế nào xung quanh hạt nhân?
A. Chuyển động rất không nhanh và không theo những quỹ đạo xác định.
B. Chuyển động rất chậm và không theo những quỹ đạo xác định.
C. Chuyển động rất nhanh không theo những quỹ đạo xác định.
D. Chuyển động rất nhanh theo những quỹ đạo xác định.
Câu 2: Cho các phát biểu sau:
(a) Các electron ở lớp L có mức năng lượng gần bằng nhau
(b) Các electron ở lớp M (n=3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n=1)
(c) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K
(d) Các electron ở lớp K có mức năng lượng bằng nhau
(e) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p
Số phát biểu đúng là
A. 5 .
B. 3.
C. 2.
D. 4.
Câu 3: Cho 4,6 gam kim loại X (thuộc nhóm IA) tác dụng hết với 95,6 ml nước (d = 1g/ml), thu được 2,24 lit khí H2 (đktc). Kim loại X là :
A. K
B. Li
C. Na
D. Rb
Câu 4: Cấu hình electron của nguyên tử có số hiệu Z = 17 là
A. 1s22s22p63s23p44s1.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23d5.
D. 1s22s22p63s23p34s2.
Câu 5: Nguyên tử của một nguyên tố R có lớp ngoài cùng là lớp M trên lớp M chứa 2 electron. Cấu hình electron của R và tính chất của R là
A. 1s22s22p63s23p2, phi kim.
B. 1s22s22p63s2, phi kim.
C. 1s22s22p63s2, kim loại.
D. 1s22s22p63s23p6, khí hiếm.
Câu 6: Trong tự nhiên magie có 3 đồng vị bền 24Mg chiếm 78,99%, 25Mg chiếm 10,00% và 26Mg. Nguyên tử khối trung bình của Mg là
A. 24,89.
B. 24,00.
C. 24,32.
D. 24,11.
Câu 7: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
A. 28.
B. 26.
C. 27.
D. 23.
Câu 8: Cho kí hiệu nguyên tử \(_{{\rm{15}}}^{{\rm{31}}}{\rm{P}}\), phát biểu nào sau đây là sai?
A. Tổng số hạt mang điện trong nguyên tử P là 30.
B. Điện tích hạt nhân của nguyên tử P là 15+.
C. Hạt nhân nguyên tử P có 15 proton và 16 neutron.
D. Lớp vỏ của nguyên tử P có 16 electron.
Câu 9: Cho hai nguyên tử của nguyên tố X và Y có số hiệu nguyên tử lần lượt là 12 và 28. Phát biểu nào sau đây là sai?
A. X và Y có cùng số electron ở lớp ngoài cùng.
B. X và Y cùng là các kim loại.
C. X và Y đều là các nguyên tố s.
D. Y có nhiều hơn X một lớp electron.
Câu 10: Trong số các kí hiệu sau đây của obitan, kí hiệu nào sau đây viết không đúng?
A. 2p
B. 3d
C. 4f
D. 2d
II. Tự luận ( 5 điểm)
Câu 1 (3 điểm) Tổng số các hạt proton, nơtron và electron trong nguyên tử của một nguyên tố X là 28. Biết số hạt nơtron lớn hơn số hạt proton là 1.
a) Xác định số proron, neutron, electron của X
b) Viết kí hiệu hóa học của X
c) Biểu diễn cấu hình theo orbital nguyên tử X
d) Viết cấu hình electron của ion mà X có thể tạo thành
Câu 2 (2 điểm) Một loại khí clo có chứa 2 đồng vị .Cho Cl2 tác dụng với H2 rồi lấy sản phẩm hoà tan vào nước thu được dung dịch X. Chia dung dịch X thành hai phần bằng nhau :
- Phần thứ nhất cho tác dụng vừa đủ với 125 ml dung dịch Ba(OH)2 0,88M.
- Phần thứ hai cho tác dụng với AgNO3 vừa đủ ta thu được 31,57 gam kết tủa.
Thành phần % số nguyên tử của mỗi đồng vị là bao nhiêu ?
---(Để xem đầy đáp án của Đề thi số 02, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
3. ĐỀ SỐ 3
I. Trắc nghiệm (5 điểm)
Câu 1: Cho cấu hình electron của Mn (Ar) 3d54s2. Mn thuộc nguyên tố nào?
A. Nguyên tố s
B. Nguyên tố p
C. Nguyên tố d
d. Nguyên tố f
Câu 2: Cation R+ có cấu hình electron phân lớp ngoài cùng là 3p6. Vị trí của R trong bảng tuần hoàn là:
A. Ô thứ 20, nhóm IIA, chu kỳ 4
B. Ô thứ 19, nhóm IB. chu kỳ 4
C. Ô thứ 19, nhóm IA, chu kỳ 4
D. Ô thứ 17, nhóm VIIA, chu kỳ 3
Câu 3: Cấu hình electron của nguyên tử 29Cu là
A. 1s22s22p63s23p64s23d9
B. 1s22s22p63s23p63d94s2
C. 1s22s22p63s23p63d104s1
D. 1s22s22p63s23p64s13d10
Câu 4: Số hiệu nguyên ử Z của nuyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Nhận xét nào sau đây đúng
A. Cả 4 nguyên tố trên thuộc 1 chu kì.
B. A, M thuộc chu kì 3
C. M, Q thuộc chu kì 4.
D. Q thuộc chu kì 3.
Câu 5: Nguyên tử của nguyên tố X khi mất 2 electron lớp ngoài cùng thì tạo thành ion X2+ có cấu hình electron lớp ngoài cùng là 3p6. Số hiệu nguyên tử X là
A. 18.
B. 20.
C. 38.
D. 40.
Câu 6: Ở trạng thái cơ bản, cấu hình electron nguyên tử Nitrogen (Z = 7) có bao nhiêu phân lớp?
A. 3
B. 5
C. 1
D. 2
Câu 7: Ion có 18 electron và 16 proton mang điện tích là
A. 16+
B. 2-
C. 18+
D. 2+
Câu 8: Có các nguyên tố hóa học sau: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản
A. Al
B. Fe
C. Cr
D. P
Câu 9: Chọn câu phát biểu sai:
A. Trong một nguyên tử số proton = số electron = số đơn vị điện tích hạt nhân
B. Số khối bằng tổng số hạt proton và số neutron
C. Số proton bằng số electron
D. Tổng số proton và số electron được gọi là số khối.
Câu 10: Cấu hình electron nào sau đây là của kim loại
A. 1s22s22p63s23p5
B. 1s22s22p63s23p4
C. 1s22s22p63s23p6
D. 1s22s22p63s2
II. Tự luận (5 điểm)
Câu 1 (3 điểm) Nguyên tử Sắt có điện tích hạt nhân là 26+. Trong nguyên tử, số hạt mang điện nhiều hơn số hạt không mang điện là 22.
a) Viết kí hiệu hóa học nguyên tử Sắt.
b) Biểu diễn electron lớp ngoài cùng theo orbital nguyên tử
c) Viết cấu hình electron của ion mà Sắt có thể tạo thành
Câu 2 (2 điểm) Trong tự nhiên có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54.
a) Tính % số nguyên tử của mỗi đồng vị
b) Tính thành phần % khối lượng của 63Cu trong CuSO4
---(Để xem đầy đáp án của Đề thi số 03, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
4. ĐỀ SỐ 4
I. Trắc nghiệm (5 điểm)
Câu 1: Trong tự nhiên Gallium có 2 đồng vị là 69Ga (60,1%) và 71Ga (39,9 %). Nguyên tử khối trung bình của Gallium là:
A. 70
B. 71,20
C. 69,80
D. 70,20
Câu 2: Nguyên tố hoá học là
A. tập hợp các nguyên tử có khối lượng giống nhau
B. tập hợp các nguyên tử có số neutron giống nhau.
C. tập hợp các nguyên tử có cùng số khối.
D. tập hợp các nguyên tử có cùng điện tích hạt nhân.
Câu 3: Biết rằng nguyên tố carbon thuộc chu kì 2, nhóm VIA. Cấu hình electron của cacbon là
A. 1s22s22p2.
B. 1s22s22p3.
C. 1s22s22p63s23p64s2
D. 1s22s22p4
Câu 4: Một nguyên tử A có tổng số electron là 10, nguyên tố Y thuộc loại:
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố
D. Nguyên tố f.
Câu 5: Mệnh đề nào sau đây đúng?
A. Đồng vị là những nguyên tử có cùng số khối nhưng khác số proton.
B. Đồng vị là những nguyên tố có cùng điện tích hạt nhân nhưng khác nhau về số neutron nên số khối khác nhau.
C. Đồng vị là những nguyên tố có cùng số khối.
D. Đồng vị là những nguyên tử có cùng điện tích hạt nhân nhưng số hạt electron khác nhau.
Câu 6: Nguyên tố canxi có số hiệu nguyên tử là 20, thuộc chu kỳ 4, nhóm IIA. Điều khẳng định nào sau đây về canxi là sai ?
A. Số electron ở vỏ nguyên tử của nguyên tố canxi là 20 .
B. Vỏ nguyên tử canxi có 4 lớp và lớp ngoài cùng có 2 electron.
C. Hạt nhân nguyên tử canxi có 20 proton.
D. Nguyên tố hóa học này là một phi kim.
Câu 7: Cho 11,2 gam Fe vào dung dịch HCl dư. Tính thể tích khí H2 (đktc) thu được sau phản ứng
A. 2,24
B. 4,48
C. 3,36
D. 1,12
Câu 8: Định nghĩa nào sau đây về nguyên tố hóa học là đúng?
Nguyên tố hóa học là tập hợp các nguyên tử:
A. Có cùng điện tích hạt nhân.
B. Có cùng nguyên tử khối.
C. Có cùng số khối.
D. Có cùng số neutron trong hạt nhân.
Câu 9: Nguyên tử của nguyên tố nào sau đây luôn nhường 1 electron trong các phản ứng hóa học?
A. Na ở ô 11 trong bảng tuần hoàn.
B. Mg ở ô 12 trong bảng tuần hoàn.
C. Ba ở ô 13 trong bảng tuần hoàn.
D. Fe ở ô 14 trong bảng tuần hoàn.
Câu 10: Nguyên tử của nguyên tố Y có số electron là 13. Điện tích hạt nhân của nguyên tử Y là:
A. 13
B. 13-
C. 13+
D. +13
II. Tự luận: (5 điểm)
Câu 1: (2 điểm) Tổng số hạt p, n, e trong 2 nguyên tử kim loại A và B là 177. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 47. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 8. Tính số proton mỗi loại.
Câu 2: (3 điểm) Cho 12 gam một kim loại hoá trị II tác dụng hết với dung dịch H2SO4 loãng thu được 11,2l lit khí (đktc).
a) Xác định kim loại hoá trị II?
b) Viết cấu hình electron của kim loại đó
---(Để xem đầy đáp án của Đề thi số 04, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
5. ĐỀ SỐ 5
I. Trắc nghiệm (5 điềm)
Câu 1: Số proton và số neutron trong hạt nhân nguyên tử là:
A. 201; 80.
B. 121; 80.
C. 80; 201.
D. 80; 121.
Câu 2: Cấu hình electron nào sau đây là của nguyên tố phi kim ?
A. 1s22s1.
B. 1s22s22p6.
C. 1s2.
D. 1s22s22p63s23p5.
Câu 3: Cho các nguyên tử: . Các nguyên tử nào là đồng vị của cùng một nguyên tố hóa học?
A. X và Z.
B. Y và Z.
C. T và Z.
D. Y, Z,T.
Câu 4: Cho kí hiệu nguyên tử . Phát biểu đúng là
A. Trong hạt nhân có 38 hạt mang điện.
B. Số hiệu nguyên tử là 39.
C. Số neutron trong hạt nhân hơn số proton là 2.
D. Có lớp electron ngoài cùng là N.
Câu 5: Các đồng vị được phân biệt bởi yếu tố nào sau đây?
A. Số electron hoá trị.
B. Số neutron.
C. Số proton.
D. Số lớp electron.
Câu 6: Cho m gam kim loại Na tác dụng với dung dịch HCl dư. Sau phản ứng thu được 6,72 lít H2 (đktc). Giá trị m là
A. 4,5.
B. 13,5.
C. 2,7.
D. 13,8.
Câu 7: Nguyên tử khối trung bình của nguyên tố Br là 79,91; R có 2 đồng vị là 79Br; A1Br. Biết 79Br chiếm 54,5 %. Số khối A1 của đồng vị thứu 2 có giá trị là:
A. 80
B. 82.
C. 81.
D. 85
Câu 8: Một nguyên tử X có 26 electron. Khi mất 2 electron, cấu hình electron của ion X2+ là
A. (Ar)3d44s2
B. (Ar)3d54s1
C. (Ar)3d6
D. (Ar)3d5
Câu 9: Cấu hình electron của nguyên tố X là 1s22s22p63s23p64s2. Phát biểu sai là
A. Lớp N có 2e.
B. Lớp K có 2e.
C. Lớp L có 8e.
D. Lớp M có 6e.
Câu 10: Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có 3 electron độc thân?
A. Boron
B. Oxygen
C. Phosphorus
D. Chlorine
II. Tự luận (5 điểm)
Câu 1 (2 điểm) Nguyên tử A có số neutron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10.
a) Viết cấu hình electron của A, xác định kim loại? phi kim hay khí hiếm?
b) Biểu diễn cấu hình orbital nguyên tử lớp ngoài cùng và xác định số electron độc thân của A.
Câu 2 (3 điểm) Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau :
|
Đồng vị |
24Mg |
25Mg |
26Mg |
|
% |
78,6 |
10,1 |
11,3
|
---(Để xem đầy đáp án của Đề thi số 05, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
Trên đây là một phần trích đoạn nội dung Bộ 5 đề thi giữa HK1 môn Hóa học 10 Cánh Diều có đáp án năm 2022-2023 Trường THPT Đức Thọ. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Đề thi giữa HK1 môn Vật lý 10 CD năm 2022-2023 có đáp án Trường THPT Khương Đình
- Bộ 5 đề thi giữa HK1 môn Ngữ văn 10 CD năm 2022-2023 có đáp án Trường THPT Nghi Xuân
Hy vọng bộ đề thi này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong kì thi sắp tới.