Hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 17 Bài 17: Biến thiên Enthalpy trong các phản ứng hóa học lớp 10 KNTT giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 81 SGK Hóa học 10 Kết nối tri thức - KNTT
Khi đun nóng ống nghiệm đựng KMnO4 ( thuốc tím), nhiệt của ngọn lửa làm cho KMnO4 bị nhiệt phân, tạo ra hỗn hợp bột màu đen:
2KMnO4 → K2MnO4 + MnO2 + O2
Em hãy dự đoán phản ứng này tỏa nhiệt hay thu nhiệt.
-
Hoạt động trang 82 SGK Hóa học 10 Kết nối tri thức - KNTT
Theo dõi sự thay đổi nhiệt độ của phản ứng trung hòa
Chuẩn bị: dung dịch HCl 0,5 m, dung dịch NaOH 0,5 M, 1 cốc 150 mL, giá treo nhiệt kế, nhiệt kế (có dải đo đến 1000C), que khuấy và 2 ống đong 100 ml.
Tiến hành:
- Dùng ống đong lấy 50 mL dung dịch HCl 0,5 M cho vào cốc phản ứng, lắp nhiệt kế lên giá sao cho đầu nhiệt kế nhúng vào dung dịch trong cốc (Hình 17.1). Đọc nhiệt độ dung dịch.
- Dùng ống đong khác lấy 50 mL dung dịch NaOH 0,5M cho vào cốc phản ứng. Khuấy nhẹ.
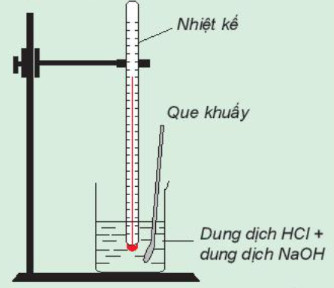
Theo dõi sự thay đổi nhiệt độ của dung dịch và trả lời câu hỏi:
1. Nhiệt độ trên nhiệt kế thay đổi như thế nào sau khi rót dung dịch NaOH vào cốc?
Phản ứng trung hòa là tỏa nhiệt hay thu nhiệt?
2. Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ thay đổi như thế nào so với thí nghiệm trên?
-
Giải câu hỏi 2 trang 83 SGK Hóa học 10 Kết nối tri thức - KNTT
Cho các phương trình nhiệt hóa học:
\(\begin{array}{l}
(1)\,\,\,CaC{O_3}(s)\, \to \,CaO(s)\,\, + \,\,C{O_2}\,(g)\,\,\,\,\Delta \gamma H_{298}^0 = + 176,0kJ\\
(2)\,\,{C_2}{H_4}(g)\,\,\, + \,\,\,{H_2}(g)\,\, \to \,\,\,{C_2}{H_6}(g)\,\,\,\,\,\Delta \gamma H_{298}^0 = 137,0kJ\\
(3)\,\,\,F{e_2}{O_3}\,\,\, + \,\,2Al(s)\,\, \to \,\,\,A{l_2}{O_3}(s)\,\,\, + \,\,2Fe(s)\,\,\,\,\Delta \gamma H_{298}^0 = - 851,5kJ
\end{array}\)Trong các phản ứng trên, phản ứng nào tỏa nhiệt, phản ứng nào thu nhiệt?
-
Giải câu hỏi 3 trang 83 SGK Hóa học 10 Kết nối tri thức - KNTT
Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
\(CO(g)\,\,\,\, + \,\,\frac{1}{2}{O_2}(g)\,\,\,\,\, \to \,C{O_2}\,(g)\,\,\,\,\,\,\,\,\,\,\,\,{\Delta _r}H_{298}^0 = - 851,5kJ\)
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng tỏa ra là bao nhiêu?
-
Giải câu hỏi 4 trang 84 SGK Hóa học 10 Kết nối tri thức - KNTT
Phản ứng tôi vôi tỏa ra nhiệt lượng rất lớn, có thể làm sôi nước. Hãy nêu các biện pháp để đảm bảo an toàn khi thực hiện quá trình tối vôi.
-
Giải câu hỏi 5 trang 86 SGK Hóa học 10 Kết nối tri thức - KNTT
Cho phản ứng:
C (kim loại) → C (graphite)
\({\Delta _r}H_{298}^0 = - 1,9kJ\)
a) Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
b) Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2(g) → CO2(g), carbon ở dạng kim cương hay graphite?
-
Giải câu hỏi 6 trang 86 SGK Hóa học 10 Kết nối tri thức - KNTT
Từ số liệu Bảng 17.1, hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane:
\(\,{C_2}{H_6}(g)\,\,\, + \,\,\,\frac{7}{2}{O_2}(g)\,\,\, \to \,\,2C{O_2}(g)\,\,\, + \,\,3{H_2}O\)
-
Giải câu hỏi 7 trang 88 SGK Hóa học 10 Kết nối tri thức - KNTT
a) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng:
N2(g) + O2(g) → 2NO(g)
b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
-
Giải câu hỏi 8 trang 88 SGK Hóa học 10 Kết nối tri thức - KNTT
Từ số liệu năng lượng liên kết ở Bảng 12.2, hãy tính biến thiên enthalpy của phản ứng đốt cháy butane theo năng lượng liên kết, biết sản phảm phản ứng đều ở thể khí.
-
Giải bài 17.1 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Phản ứng nào sau đây là phản ứng toả nhiệt?
A. Phản ứng nhiệt phân muối KNO3.
B. Phản ứng phân huỷ khí NH3.
C. Phản ứng oxi hoá glucose trong cơ thể.
D. Phản ứng hoà tan NH4Cl trong nước.
-
Giải bài 17.2 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thưởng?
A. Phản ứng nhiệt phân Cu(OH)2.
B. Phản ứng giữa H2 và O2 trong hỗn hợp khí.
C. Phản ứng giữa Zn và dung dịch H2SO4.
D. Phản ứng đốt cháy cồn.
-
Giải bài 17.3 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho phản ứng hoá học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có \({\Delta _f}H_{298}^0\), tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. toả nhiệt, NO2 bền vững hơn N2O4.
B. thu nhiệt, NO2 bền vững hơn N2O4.
C. toả nhiệt, N2O4 bền vững hơn NO2.
D. thu nhiệt, N2O4 bền vững hơn NO2.
-
Giải bài 17.4 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Nung KNO3 lên 550 °C xảy ra phản ứng:
KNO3(s) → KNO2(s) + \(\frac{1}{2}\)O2 \(\Delta H\)
Phản ứng nhiệt phân KNO3 là
A. toả nhiệt, có \(\Delta H\)< 0.
B. thu nhiệt, có \(\Delta H\)> 0.
C. toả nhiệt, có \(\Delta H\)> 0.
D. thu nhiệt, có \(\Delta H\)< 0.
-
Giải bài 17.5 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau:
2NaHCO3(s) => Na2CO3(s) + CO2(g) + H2O(g) (1)
4P(s) + 5O2(g) => 2P2O5(s) (2)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
A. phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
B. phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
C. cả 2 phản ứng đều toả nhiệt.
D. cả 2 phản ứng đều thu nhiệt.
-
Giải bài 17.6 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Tiến hành quá trình ozone hóa 100 g oxygen theo phản ứng sau:
3O2(g) (oxygen) -> 2O3(g) (ozone)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^0\) của ozone (kJ/mol) có giá trị là
A. 142,4. B. 284,8. C. -142,4. D. -284,8.
-
Giải bài 17.7 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
Liên kết
Phân tử
Eb (kJ/mol)
Liên kết
Phân tử
Eb (kJ/mol)
C=C
C2H4
612
C-C
C2H6
346
C-H
C2H4
418
C-H
C2H6
418
H-H
H2
436
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
A. 134. B. -134. C. 478. D. 284.
-
Giải bài 17.8 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho phương trình phản ứng sau:
2H2(g) + O2(g) —› 2H2O(l) ∆H=-572 kJ
Khi cho 2g khí H2 tác dụng hoàn toàn với 32g khí O2 thì phản ứng
A. toả ra nhiệt lượng 286 kJ.
B. thu vào nhiệt lượng 286 kJ.
C. toả ra nhiệt lượng 572 kJ.
D. thu vào nuệt lượng 572 kJ.
-
Giải bài 17.9 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Tính biến thiên enthalpy theo các phương trình phản ứng sau, biết nhiệt sinh của NH3 bằng -46 kJ/mol.
N2(g) + 3H2(g) -> 2NH3(g) (1)
\(\frac{1}{2}\)N2(g) + \(\frac{3}{2}\)H2(g) -> NH3 (g) (2)
So sánh \(\Delta H\) (1) và \(\Delta H\) (2). Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng toả ra hay thu vào là bao nhiêu? Tính theo hai phương trình phản ứng trên thì kết quả thu được giống nhau hay khác nhau.
-
Giải bài 17.10 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho các phản ứng sau:
CaCO3(s) -> CaO(s) + CO2(g) (1)
C(graphite) + O2(g) -> CO2(g) (2)
Tính biến thiên enthalpy của các phản ứng trên. (Biết nhiệt sinh (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1207, -635 và -393,5)
-
Giải bài 17.11 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho các phản ứng sau và biến thiên enthalpy chuẩn:
(1) 2NaHCO3(s) -> Na2CO3(s) + H2O(l) + CO2(g) \({\Delta _r}H_{298}^0 = + 20,33kJ\)
(2) 4NH3(g) + 3O2(g) -> 2N2(g) + 6H2O(l) \({\Delta _r}H_{298}^0 = - 1531kJ\)
Phản ứng nào toả nhiệt? Phản ứng nào thu nhiệt?
-
Giải bài 17.12 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Phản ứng giữa khi nitrogen và oxygen chỉ xảy ra ở nhiệt độ cao (3000 °C) hoặc nhờ tia lửa điện:
N2(g) + O2(g) → 2NO(g)
a) Phản ứng trên toả nhiệt hay thu nhiệt?
b) Bằng kiến thức về năng lượng liên kết trong phân tử các chất, hãy giải thích vì sao phản ứng trên khó xảy ra.
-
Giải bài 17.13 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành, nhiệt dung của các chất (nhiệt lượng cần cung cấp để 1 kg chất đó tăng lên 1 độ) được cho trong bảng sau:
Chất
\({\Delta _f}H_{298}^0\)
(kJ/mol)
C (J/g.K)
Chất
\({\Delta _f}H_{298}^0\)
(kJ/mol)
C (J/g.K)
Al
0
Al2O3
-16,37
0,84
Fe2O3
-5,14
Fe
0
0,67
Giả thiết phản ứng xảy ra vừa đủ, hiệu suất 100%, nhiệt độ ban đầu là 25 °C, nhiệt lượng toả ra bị thất thoát ra ngoài môi trường là 50%. Tính nhiệt độ đạt được trong lò phản ứng nhiệt nhôm.
-
Giải bài 17.14 trang 48 SBT Hóa học 10 Kết nối tri thức - KNTT
Cho phản ứng đốt cháy butane sau:
C4H10(g) + O2(g) → CO2(g) + H2O(g) (1)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
a) Cân bằng phương trình phản ứng (1).
b) Xác định biến thiên enthalpy (\({\Delta _r}H_{298}^0\)) của phản ứng (1).
c) Một bình gas chứa 12 kg butane có thể đun sôi bao nhiêu ấm nước? (Giả thiết mỗi ấm nước chứa 2L nước ở 25 °C, nhiệt dung của nước là 4,2J/g.K, có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường)






