Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 9 Bài 9: Liên kết ion môn Hóa học lớp 10 CTST giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 55 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 9.1, nhận xét số electron trên lớp vỏ với số proton trong hạt nhân của mỗi ion tạo thành

Nguyên tử sodium (Na) lon sodium (Na+)
(a)

Nguyên tử oxygen (O) lon oxide (O2-)
(b)
Hình 9.1. Minh hoạ quá trình hình thành ion
-
Giải câu hỏi 2 trang 55 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trình bày cách tính điện tích của các ion thu được khi nguyên tử nhường hoặc nhận thêm electron trong Hình 9.1

Nguyên tử sodium (Na) lon sodium (Na+)
(a)

Nguyên tử oxygen (O) lon oxide (O2-)
(b)
Hình 9.1. Minh hoạ quá trình hình thành ion
-
Giải câu hỏi 3 trang 55 SGK Hóa học 10 Chân trời sáng tạo - CTST
Ion Na+ và ion O2- thu được có bền vững về mặt hóa học không? Chúng có cấu hình electron giống cấu hình electron nguyên tử của nguyên tố nào?
-
Giải câu hỏi 4 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào có xu hướng tạo thành cation hoặc anion? Giải thích?
-
Giải câu hỏi 5 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 9.2, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl khi sodium tác dụng với chlorine
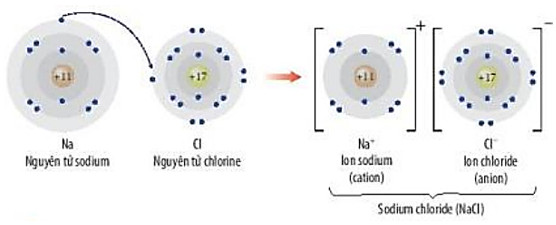
Hình 9.2. Minh hoạ sự hình thành liên kết ion trong phân tử NaCl
-
Giải câu hỏi 6 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Các ion Na+ và Cl- có cấu hình electron nguyên tử của các khí hiếm tương ứng nào?
-
Luyện tập trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trình bày sự hình thành liên kết ion trong phân tử MgO khi magnesium tác dụng với oxygen
-
Giải câu hỏi 7 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 9.3, cho biết:
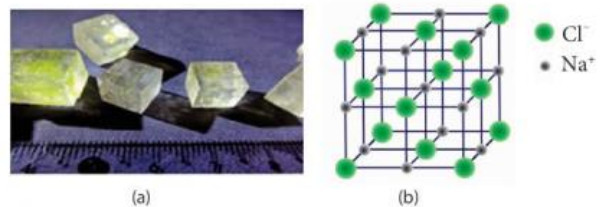
Hình 9.3. Tinh thể NaCl thực tế (a) và mô hình ô mạng tinh thể Na (b)
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
-
Giải câu hỏi 8 trang 57 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát các bước trong Hình 9.4, cho biết cần bao nhiêu thanh nối và khối cầu mỗi loại để lắp ráp thành mô hình một ô mạng tinh thể NaCl
.jpg)
Hình 9.4. Minh họa cách lắp ráp mô hình tinh thể NaCl
-
Vận dụng trang 57 SGK Hóa học 10 Chân trời sáng tạo - CTST
Ion Na+ đóng vai trò rất quan trọng trong việc điều hòa huyết áp của cơ thể. Tuy nhiên, nếu cơ thể hấp thụ một lượng lớn ion này sẽ dẫn đến các vấn đề về tim mạch và thận. Các nhà khoa học khuyến cáo lượng ion Na+ nạp vào cơ thể nên thấp hơn 2 300 mg, nhưng không ít hơn 500 mg mỗi ngày đối với một người lớn để đảm bảo sức khỏe.
Giả sử, nếu một người sử dụng 5,0 g muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể có vượt mức giới hạn cho phép không?
-
Giải bài 1 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
-
Giải bài 2 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Cho các ion sau: Ca2+, F-, Al3+ và N3-. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
-
Giải bài 3 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống.
a) Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
-
Giải bài 4 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hoàn thành những thông tin còn thiếu trong bảng sau:
Công thức hợp chất ion
Cation
Anion
CaF2
?
?
?
K+
O2-
-
Giải bài 5 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide
-
Giải bài 9.1 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Điều nào dưới đây đúng khi nói về ion S2-?
A. Có chứa 18 proton.
B. Có chứa 18 electron.
C. Trung hoà về điện.
D. Được tạo thành khi nguyên tử sulfur (S) nhận vào 2 proton.
-
Giải bài 9.2 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
A. Trong phân tử Na2O, các ion sodium Na+ và ion oxide O2- đều đạt cấu hình electron bền vững của khí hiếm neon.
B. Phân tử Na2O tạo bởi lực hút tĩnh điện giữa hai ion Na+ và một ion O2-.
C. Là chất rắn trong điều kiện thường.
D. Không tan trong nước, chỉ tan trong dung môi không phân cực như benzene, carbon tetrachloride, ...
-
Giải bài 9.3 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tính chất nào dưới đây đúng khi nói về hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp.
B. Hợp chất ion tan tốt trong dung môi không phân cực.
C. Hợp chất ion có cấu trúc tinh thể.
D. Hợp chất ion dẫn điện ở trạng thái rắn.
-
Giải bài 9.4 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là
A. sodium chloride.
B. glucose.
C. sucrose.
D. fructose.
-
Giải bài 9.5 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Tính chất nào sau đây không phải của magnesium oxide (MgO)?
A. Có nhiệt độ nóng chảy cao hơn so với NaCl.
B. Chất khí ở điều kiện thường.
C. Có cấu trúc tinh thể.
D. Phân tử tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2-.
-
Giải bài 9.6 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Sodium sulfide (Na2S) là một hợp chất hoá học được sử dụng trong ngành công nghiệp giấy và bột giấy, xử lí nước, công nghiệp dệt may và các quy trình sản xuất hoá chất khác như sản xuất cao su, thuốc nhuộm lưu huỳnh và thu hồi dầu,... Điều thú vị là sodium sulfide đã được chứng minh là có vai trò trong bảo vệ tim mạch, chống lại chứng thiếu máu cục bộ ở tim và giúp bảo vệ phổi, chống lại tổn thương phổi do máy thở. Trình bày sự tạo thành sodium sulfide khi cho sodium phản ứng với sulfur.
-
Giải bài 9.7 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Chỉ ra cấu trúc đúng của ô mạng tinh thể sodium chloride:
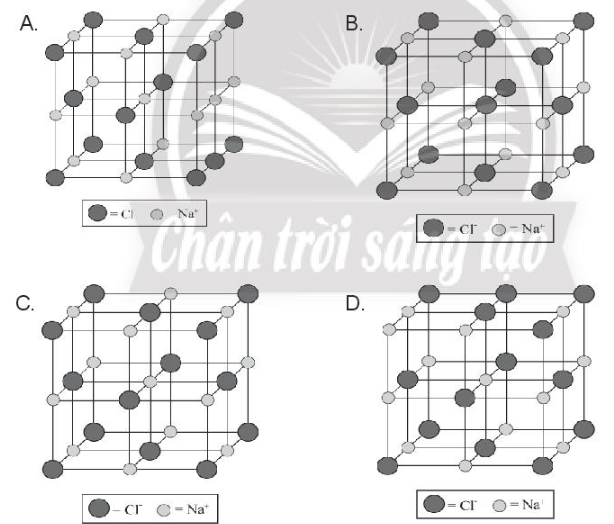
-
Giải bài 9.8 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Magnesium chloride là một chất xúc tác phổ biến trong hoá học hữu cơ. Trình bày sự hình thành phân tử MgCl2, khi cho magnesium tác dụng với chlorine.
-
Giải bài 9.9 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong đời sống, muối ăn (NaCl) và các gia vị, phụ gia (C5H8NO4Na: bột ngọt; C7H5O2Na: chất bảo quản thực phẩm) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo các cá nhân nên hạn chế lượng sodium xuống dưới 2300 mg mỗi ngày vì nếu tiêu thụ nhiều hơn sẽ ảnh hưởng đến tim mạch và thận. Nếu trung bình mỗi ngày, một người dùng tổng cộng 5,0 gam muối ăn; 0,5 gam bột ngọt và 0,05 gam chất bảo quản thì lượng sodium tiêu thụ có vượt mức giới hạn cho phép nói trên không?
-
Giải bài 9.10 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trình bày cách vẽ một ô mạng tinh thể NaCl
-
Giải bài 9.11 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Biểu đồ dưới đây cho biết mối quan hệ giữa năng lượng của hệ các ion trái dấu so với khoảng cách giữa chúng:

Biểu đồ cho thấy khoảng cách giữa các ion càng gần càng thuận lợi để hệ đạt được trạng thái năng lượng tối thiểu (bền vững). Tuy nhiên, ở khoảng cách nhỏ quả, các ion lại đầy nhau do hạt nhân của các ion đều mang điện tích dương. Năng lượng tối thiểu đại diện cho độ bền liên kết và khoảng cách ro tại mức năng lượng tối thiểu gọi là độ dài liên kết. Bằng cách thực hiện một loạt các phép tính, người ta thấy rằng các hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết mạnh hơn và các hợp chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết mạnh hơn. Sử dụng nhận định trên để dự đoán và giải thích độ bền liên kết giữa các hợp chất ion sau:
a) NaCl và Na2O.
b) NaCl và NaF.
-
Giải bài 9.12 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
X, Y, Z là các hợp chất ion thuộc trong số các chất sau: NaF, MgO và MgCl2 Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ:
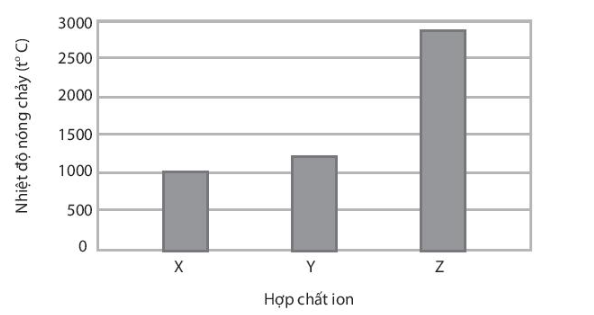
Trình bày cách xác định các chất X, Y, Z
-
Giải bài 9.13 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho biết lực hút tĩnh điện được tính theo công thức sau: F = \(k\frac{{\left| {{q_1}} \right|\left| {{q_2}} \right|}}{{{r^2}}}\) (q1, q2 là giá trị điện tích của hai điện tích điểm, đơn vị là C (coulomb); r là khoảng cách giữa hai điện tích điểm, đơn vị là m (meter); k là hằng số coulomb). Dựa vào công thức trên, hãy so sánh gần đúng lực hút tĩnh điện giữa các ion trái dấu trong phân tử NaCl và phân tử MgO. Từ đó, cho biết nhiệt độ nóng chảy và nhiệt độ sôi của hợp chất nào cao hơn.
-
Giải bài 9.14 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hình dạng và cấu trúc tinh thể của mọi hợp chất ion có giống nhau không? Giải thích.
-
Giải bài 9.15 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Vì sao các hợp chất ion thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường, nhưng lại giòn, dễ vỡ?
-
Giải bài 9.16 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Vì sao nói sodium chloride có cấu trúc mạng tinh thể kiểu lập phương tâm diện?






