Qua nội dung bài giảng Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm môn Hóa học 10 chương trình Cánh Diều được HOC247 biên soạn và tổng hợp giới thiệu đến các em học sinh, giúp các em tổng hợp kiến thức về bán kính nguyên tử, tính kim loại, phi kim, tính acid và base.... Để đi sâu vào tìm hiểu và nghiên cứu nội dung bài học, mời các em cùng tham khảo nội dung chi tiết trong bài giảng sau đây.
Tóm tắt lý thuyết
1.1. Xu hướng biến đổi bán kính nguyên tử
a. Trong một chu kì
- Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần.
- Nguyên tử các nguyên tố trong cùng chu kì có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính nguyên tử giảm.
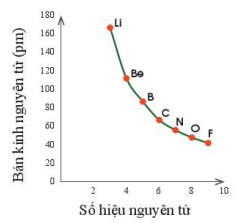
Hình 7.1. Sự thay đổi bán kính nguyên tử theo số hiệu nguyên tử của các nguyên tố chu kì 2
b. Trong một nhóm A.
- Quy luật chung đối với các nguyên tố nhóm A: Trong một nhóm, theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần.
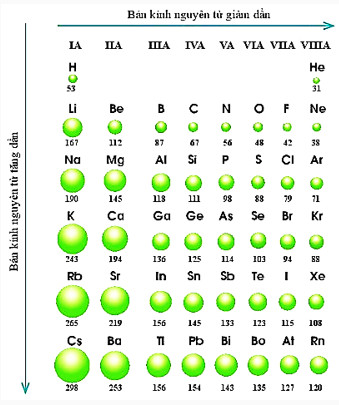
Hình 7.2. Bán kính nguyên tử (pm) của một số nguyên tố trong bảng tuần hoàn
- Trong một nhóm A, theo chiều từ trên xuống dưới, bán kinh nguyên tử tăng dần, nguyên nhân chủ yếu là do số lớp electron tăng dần.
| Bán kính nguyên tử có xu hướng giảm theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một nhóm. |
|---|
1.2. Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
a. Độ âm điện
- Độ âm điện (x) là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử.
Hình 7.3. Cặp electron liên kết bị các nguyên tử hút về phía các hạt nhân của mỗi nguyên tử H
- Độ âm điện được sử dụng rộng rãi là độ âm điện theo Pauling (Pau-linh). Theo đó, nguyên tử nguyên tố có độ âm điện lớn nhất là fluorine, X(F) = 3,98.
.jpg)
Hình 7.5. Giá trị độ âm điện của một số nguyên tố nhóm A
Ví dụ 1: Độ âm điện của H và N lần lượt là 2,20 và 3,04. Điều này có nghĩa là nguyên tử N hút electron liên kết mạnh hơn nguyên tử H, gấp 3,04 : 2,20 = 1,38 lần. Vậy trong phân tử NH3, các cặp electron liên kết sẽ bị lệch về phía nguyên tử N.
Ví dụ 2: Độ âm điện của 0 là 3,44. Vậy nguyên tử O hút electron liên kết mạnh hơn nguyên tử H, gấp 3,44 : 2,20 = 1,56 lần. Do đó, trong phân tử H2O, các cặp electron liên kết sẽ bị lệch về phía nguyên tử O.
- Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.
- Độ âm điện phụ thuộc đồng thời vào hai yếu tố: điện tích hạt nhân và bán kính nguyên tử.
+ Trong một chu kì, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần nên khả năng hút cặp electron liên kết càng mạnh, dẫn tới độ âm điện càng cao.
+ Trong một nhóm, từ trên xuống dưới, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng lên nên lực hút của hạt nhân tới cặp electron liên kết giảm, dẫn tới độ âm điện giảm.
b. Tính kim loại và tính phi kim
- Tính kim loại đặc trưng bởi khả năng nhường electron của nguyên tử. Tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử.
- Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
- Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron hoá trị tăng, làm giảm khả năng nhường electron, do đó tính kim loại của nguyên tố giảm.
- Trong một nhóm A, mặc dù điện tích hạt nhân tăng dần nhưng do bản kinh nguyên tử của các nguyên tố tăng nhanh, nên lực hút của hạt nhân tới electron hoá trị giảm dần, làm tăng khả năng nhường electron, do đó tính kim loại tăng.
- Đối với phi kim, cách giải thích hoàn toàn tương tự như trên.
|
- Độ âm điện của nguyên tử nguyên tố hoá học có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng giảm theo chiều tăng điện tích hạt nhân trong một nhóm. - Tính kim loại của nguyên tử nguyên tố hoá học có xu hướng giảm theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một nhóm. - Tính phi kim của nguyên tử nguyên tố hoá học có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng giảm theo chiều tăng diện tích hạt nhân trong một nhóm. |
|---|
1.3. Xu hướng biến đổi thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
a. Thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
- Oxide cao nhất của một nguyên tố là oxide mà nguyên tố trong đó có hoá trị cao nhất. Các nguyên tố thuộc nhóm IA đến VIIA (trừ fluorine) có hoá trị cao nhất đúng bằng số thứ tự của nhóm.
Ví dụ: Li ở nhóm IA, Cl ở nhóm VIIA, vậy hoá trị cao nhất của Li và Cl tương ứng là I và VII.
- Công thức oxide cao nhất và hoá trị tương ứng các nguyên tố nhóm A, chu kì 3 thể hiện trong Bảng 7.1.
Bảng 7.1. Oxide cao nhất của các nguyên tố nhóm A, chu kì 3
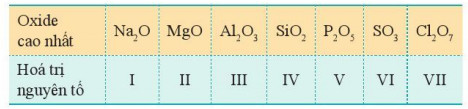
- Xu hướng biến đổi thành phần của các oxide cao nhất: Trong một chu kì, theo chiều tăng điện tích hạt nhân, tỉ lệ số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất có xu hướng tăng dần.
- Quy luật về sự biến đổi 1 chung của tỉnh acid và tính | base của oxide cao nhất ngược chiều nhau trong mỗi chu kì và mỗi nhóm.
- Xu hướng biến đổi tính acid, tính base của oxide cao nhất: Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
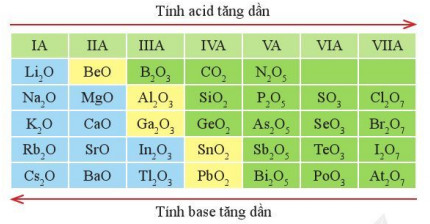
Hình 7.6. Xu hướng biến đổi tính acid, tính base của một số oxide cao nhất
Ví dụ: Trong dãy oxide cao nhất của các nguyên tố chu kì 3: Na2O có tính base mạnh nhất (Na2O là basic oxide); Cl2O7, có tính acid mạnh nhất (Cl2O7 là acidic oxide) và Al2O3 vừa có tính acid, vừa có tính base.
Al2O3+ 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6HCl → 2A1Cl3 + 3H2O
b. Thành phần và tính acid, tính base của các hydroxide trong một chu kì
- Hydroxide của nguyên tố kim loại M hoá trị n có dạng M(OH)n. Đối với nguyên tố phi kim, hydroxide của nó ở dạng acid.
Bảng 7.2. Công thức hydroxide của các nguyên tố nhóm A chu kì 3 (các nguyên tố ở hoá trị cao nhất)
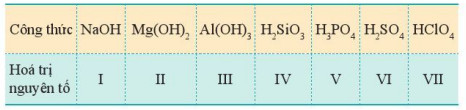
- Xu hướng biến đổi tính acid, tính base của hydroxide: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
Ví dụ
- NaOH là một base mạnh.
2NaOH + CO2 → Na2CO3 + H2O
Al(OH)3 có cả tính acid và tính base, có thể phản ứng với cả base và acid.
Al(OH)3 + NaOH → Na[Al(OH)4]
Al(OH)3 + 3HCl → AlCl3 + 3H2O
H2SiO3 là acidrất yếu, H3PO4 là acid trung bình, H2SO4 là acid mạnh, HClO4 là acid rất mạnh.
H3PO4 + 3NaOH → Na3PO4 +3H2O
| Xu hướng biến đổi tính acid, tính base của oxide và hydroxide trong một chu kì: tính acid có xu hướng tăng dần, tính base có xu hướng giảm dần theo chiều tăng điện tích hạt nhân. |
|---|
Bài tập minh họa
Bài 1: Một hạt nhân có điện tích là +Z sẽ hút electron bằng một lực với độ lớn \(F\, = \,a\frac{Z}{{{r^2}}}\), trong đó: r là khoảng cách từ hạt nhân tới electron, a là một hằng số. Hãy cho biết:
a) Điện tích hạt nhân càng lớn thì lực hút electron càng mạnh hay yếu?
b) Khoảng cách giữa electron và hạt nhân càng lớn thì electron bị hạt nhân hút càng mạnh hay càng yếu?
Hướng dẫn giải
(a) Trong cùng 1 chu kì, điện tích hạt nhân càng lớn, độ âm điện tăng nên lực hút giữa hạt nhân với electron lớp ngoài cùng càng mạnh.
(b) Khoảng cách giữa electron và hạt nhân càng lớn thì electron bị hạt nhân hút càng yếu.
Bài 2: Cặp electron liên kết bị lệch nhiều hơn trong phân tử NH3 hay trong phân tử H2O? Vì sao?
Hướng dẫn giải
- Trong phân tử NH3: độ âm điện của H và N lần lượt là 2,2 và 3,0
⟹ Nguyên tử N hút electron liên kết mạnh hơn H gấp 3,0 : 2,2 = 1,36 lần.
- Trong phân tử H2O: độ âm điện của H và O lần lượt là 2,2 và 3,4
⟹ Nguyên tử O hút electron liên kết mạnh hơn H gấp 3,4 : 2,2 = 1,54 lần.
Vậy cặp electron liên kết trong phân tử H2O bị lệch nhiều hơn trong phân tử H2O.
Luyện tập Bài 7 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Giải thích được xu hướng biến đổi bán kính nguyên tử trong một chu kì, trong một nhóm (các nguyên tố nhóm A).
- Nhận xét và giải thích được xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử các nguyên tố trong một chu kì, trong một nhóm (nhóm A).
- Nhận xét được xu hướng biến đổi thành phần và tính acid, tỉnh base của các oxide và các hydroxide theo chu kì. Viết được phương trình hoá học minh hoạ.
3.1. Trắc nghiệm Bài 7 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 7 cực hay có đáp án và lời giải chi tiết.
-
- A. 1s22s22p3
- B. 1s22s22p4
- C. 1s22s2
- D. 1s22s22p63s1
-
Câu 2:
Cho biết tổng số electron của AB32- là 42. Trong A và B đều có số proton bằng số nơtron. Tìm A và B?
- A. S và O
- B. O và C
- C. Na và S
- D. Mg và Ca
-
- A. 12
- B. 13
- C. 11
- D. 14
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 7 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 7 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 39 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 39 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 39 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 40 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 3 trang 40 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 4 trang 41 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 41 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 42 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 42 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 5 trang 42 SGK Hóa học 10 Cánh Diều - CD
Vận dụng trang 43 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 6 trang 44 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 44 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 44 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 45 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 45 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 45 SGK Hóa học 10 Cánh Diều - CD
Giải bài 4 trang 45 SGK Hóa học 10 Cánh Diều - CD
Giải bài 7.1 trang 20 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.2 trang 20 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.3 trang 20 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.4 trang 20 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.5 trang 20 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.6 trang 21 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.7 trang 21 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.8 trang 21 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.9 trang 21 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.10 trang 21 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.11 trang 21 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.12 trang 22 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.13 trang 22 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.14 trang 22 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.15 trang 22 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.16 trang 22 SBT Hóa học 10 Cánh Diều - CD
Giải bài 7.17 trang 23 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 7 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







