Nội dung bài học Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học lớp 10 chương trình SGK Cánh Diều được HOC247 biên soạn và tổng hợp sẽ cung cấp cho các em học sinh có cái nhìn toàn diện về lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hoá học, từ đó nắm được các khái niệm liên quan: ô, chu kì, nhóm...cũng như cách phân loại nguyên tố. Mời các em cùng theo dõi nội dung chi tiết sau đây.
Tóm tắt lý thuyết
1.1. Lịch sử phát minh
- D.I, Mendeleev (ĐI. Men-đê-lê-ép, 1834 – 1907), một nhà hoá học người Nga, được coi là cha đẻ của bảng tuần hoàn các nguyên tố hoá học. Mặc dù trước đó cũng đã có một số nhà khoa học tìm hiểu về tính tuần hoàn của các nguyên tố, nhưng không có công trình nào mang tính hệ thống để có thể dự đoán được về các nguyên tố mới như của Mendeleev.
- Mendeleey nhận thấy có mối liên hệ giữa khối lượng nguyên tử và tính chất các nguyên tố tương ứng qua dãy một số nguyên tố có tính chất tương tự nhau: dãy halogen (Cl, Br và I), kim loại kiềm (K, Rb, Cs) và kim loại kiềm thổ (Ca, Sr, Ba). Ông sắp xếp chúng vào một bảng với khối lượng nguyên tử tương ứng như sau:
Bảng 6.1. Cách sắp xếp 9 nguyên tố hoá học theo khối lượng nguyên tử của Mendeleev

- Sau đó, bằng cách thêm các nguyên tố khác theo mô hình này, Mendeleev đã công bố phiên bản mở rộng của bảng tuần hoàn vào năm 1869, bao gồm tất cả các nguyên tố đã biết, cũng như dự đoán nhiều nguyên tố mới. Ông cho rằng “Nếu các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử, sẽ xuất hiện sự tuần hoàn về các tính chất của chúng”. Đây được xem là tiền đề của định luật tuần hoàn sau này.
.jpg)
Hình 6.1. Bảng tuần hoàn các nguyên tố hoá học của Mendeleev năm 1869
- Năm 1871, Mendeleev đã đưa ra định luật tuần hoàn, phát biểu như sau: “Tính chất của các đơn chất, cấu tạo và tính chất các hợp chất của chúng có tính tuần hoàn theo khối lượng nguyên tử của các nguyên tổ”. Nhờ định luật này, Mendeleev đã dự đoán tới 10 nguyên tố mới, trong đó có 3 nguyên tố được tiên đoán khá tỉ mỉ về tính chất của đơn chất và hợp chất của chúng (sau này chính là các nguyên tố Sc, Ga và Ge). Các nguyên tố còn lại do vị trí trong bảng không thuận lợi nên ông chỉ đưa ra ước lượng về khối lượng nguyên tử của chúng.
- Bảng tuần hoàn các nguyên tố hoá học hiện đại ngày nay được xây dựng trên cơ sở sử dụng mối liên hệ số hiệu nguyên tử – tính chất” thay vì mối liên hệ “khối lượng nguyên tử – tinh chất”. Cách xây dựng này không những giúp nhanh chóng so sánh, suy luận về tính chất của đơn chất và hợp chất, mà còn cung cấp thông tin phong phú về mỗi nguyên tố hoá học.
- Miệng núi lửa Mendeleev trên Mặt Trăng, cũng như nguyên tố số 101, Mendelevium, được đặt theo tên nhà bác học Mendeleev, để ghi nhớ công ơn của ông.
- Năm 1911, Ernest Rutherford đã chứng minh khối lượng nguyên tử tỉ lệ thuận với số proton của nguyên tử (nhưng có một số ngoại lệ). Năm 1913, Henry Moseley (Hen-ri Mơ-lê) bằng thực nghiệm đã chỉ ra các nguyên tố được sắp xếp trong bảng tuần hoàn theo Số hiệu nguyên tử chính xác hơn là theo khối lượng nguyên tử.
| Mendeleev được coi là cha đẻ của bảng tuần hoàn các nguyên tố hoá học. Ông đã tìm ra quy luật tuần hoàn liên hệ giữa khối lượng nguyên tử và tính chất của chúng. |
|---|
1.2. Nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố Hóa học
Các nguyên tố hoá học được sắp xếp vào một bảng, gọi là bảng tuần hoàn dựa trên những nguyên tắc sau:
- Các nguyên tố hoá học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân của nguyên tử.
- Các nguyên tố mà nguyên tử có cùng số lớp electron được xếp vào cùng một hàng.
- Các nguyên tố mà nguyên tử có số electron hoá trị" như nhau được xếp vào cùng một cột.
1.3. Cấu tạo của bảng tuần hoàn các nguyên tố Hóa học
Bảng tuần hoàn các nguyên tố hoá học hiện nay (gọi tắt là bảng tuần hoàn) gồm 118 nguyên tố hoá học. Vị trí của mỗi nguyên tố hoá học trong bảng được thể hiện qua số thứ tự ô nguyên tố, chu kì và nhóm.
a. Ô nguyên tố
- Mỗi nguyên tố hoá học được xếp vào một ô trong bảng tuần hoàn, gọi là ô nguyên tố. Mỗi ô chứa một số thông tin của một nguyên tố hoá học như: kí hiệu hoá học, tên nguyên tố, số hiệu nguyên tử và nguyên tử khối trung bình,...
- Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
b. Chu kì
- Chu kì là tập hợp các nguyên tố hoá học mà nguyên tử của chúng có cùng số lớp electron, được xếp thành hàng theo chiều tăng dần điện tích hạt nhân từ trái sang phải.
- Bảng tuần hoàn gồm 7 chu kì, được đánh số thứ tự từ 1 đến 7.
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố thuộc chu kì đó.
c. Nhóm
- Nhóm là tập hợp các nguyên tố hoá học mà nguyên tử có cấu hình electron tương tự nhau, được xếp thành cột theo chiều tăng điện tích hạt nhân từ trên xuống dưới.
- Các nguyên tố được chia thành nguyên tố nhóm A và nguyên tố nhóm B dựa theo sự khác nhau về đặc điểm cấu hình electron. Nguyên tử của các nguyên tố trong cùng một nhóm A có cấu hình electron tương tự nhau nên có tính chất hoá học tương tự nhau. Bảng tuần hoàn gồm 18 cột được chia thành 4 nhóm A, đánh số từ A đến VIIIA; 8 nhóm B, được đánh số từ IB đến VIIIB. Mỗi nhóm Ahay B đều chỉ có một cột, trừ nhóm VIIIB có ba cột.
|
Bảng tuần hoàn các nguyên tố hoá học được xây dựng dựa trên liên hệ giữa số hiệu nguyên tử và tính chất của nguyên tố đó. Vị trí của một nguyên tố trong bảng tuần hoàn được đặc trưng bởi số thứ tự của ô nguyên tố, chu kì và nhóm. |
|---|
1.4. Liên hệ giữa cấu hình electron nguyên tử với vị trí của nguyên tố trong bảng tuần hoàn
- Từ cấu hình electron nguyên tử của một nguyên tố hoá học, ta có thể xác định được vị trí của nguyên tố đó trong bảng tuần hoàn theo quy tắc sau:
+ Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
+ Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của nguyên tố thuộc chu kì đó.
+ Nguyên tố nhóm A có cấu hình electron lớp ngoài cùng dạng ns1+2 hoặc ns2np1+6 và nguyên tố nhóm B* có cấu hình electron phân lớp ngoài cùng và phân lớp sát lớp ngoài cùng dạng (n-1)d1+10ns1+2.
- Với nguyên tố nhóm A, số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử nguyên tố đó (trừ He).
- Viết cấu hình electron nguyên tử Na. Cho biết trong bảng tuần hoàn, Na nằm ở ô số 11, chu kì 3, nhóm IA. Nêu mối liên hệ giữa số hiệu nguyên tử,
Ví dụ: Cấu hình electron của nguyên tử chlorine là 1s22s22p63s23p5, từ cấu hình này xác định được vị trí của chlorine trong bảng tuần hoàn
- Số hiệu nguyên tử của Cl là 17, do đó nguyên tố Cl nằm ở ô số 17.
- Nguyên tử Cl có 3 lớp electron, nên Cl thuộc chu kì 3.
- Cấu hình electron lớp ngoài cùng của Cl là 3s23p5 có 7 electron nên nguyên tố Cl thuộc nhóm VIIA.
| Từ cấu hình electron nguyên tử có thể xác định được vị trí của nguyên tố trong bảng tuần hoàn. |
|---|
1.5. Phân loại nguyên tố Hóa học
a. Dựa theo cấu hình electron
Dựa vào cấu hình electron nguyên tử, người ta phân loại các nguyên tố hoá học thành các khối nguyên tố s, p, d và f.
- Nguyên tố s là nguyên tố nhóm Amà nguyên tử có cấu hình electron lớp ngoài cùng là ns1+2.
- Nguyên tố p là nguyên tố nhóm A mà nguyên tử có cấu hình electron lớp ngoài cùng là ns2np1+6
- Nguyên tố dlà nguyên tố nhóm B mà nguyên tử có cấu hình electron phân lớp ngoài cùng và phân lớp sát lớp ngoài cùng là (n-1)d1+10ns1+2.
- Nguyên tố f là nguyên tố nhóm B mà nguyên tử có cấu hình electron phân lớp ngoài cùng và các phân lớp sát lớp ngoài cùng là (n-2)f0+14(n-1)d0+2ns2. Các nguyên tố f được xếp riêng bên dưới bảng tuần hoàn
Vị trí của các khối nguyên tố s, p, d f được thể hiện trong Hình 6.2.
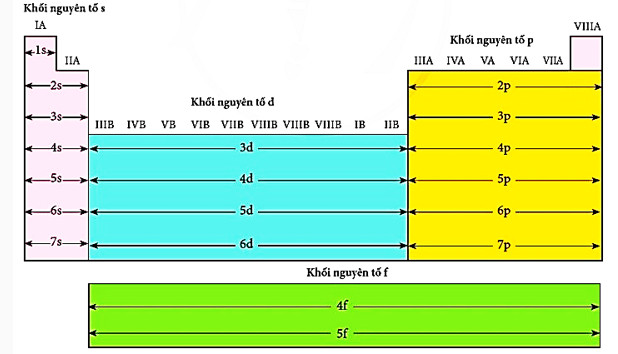
Hình 6.2. Các khối nguyên tố s, p, d, ftrong bảng tuần hoàn
b. Dựa theo tính chất hoá học
Các nguyên tố hoá học còn có thể được phân loại dựa theo tính chất hoá học cơ bản. Dựa vào cách này, các nguyên tố hoá học được phân chia thành: kim loại, phi kim, khí hiếm.
| Có hai cách phân loại nguyên tố hoá học: theo đặc điểm cấu hình electron (khối nguyên tố s, p, d, f) và theo tính chất hoá học (kim loại, phi kim, khí hiếm). |
|---|
Bài tập minh họa
Bài 1: Chu kì 2 gồm các nguyên tố cùng có hai lớp electron. Hỏi các nguyên tố nào sau đây thuộc về chu kì 2: Mg (Z = 12), Li (Z = 3), P(Z = 15), F(Z = 9)?
Hướng dẫn giải
- Cấu hình electron nguyên tử các nguyên tố hóa học:
+ Mg (Z = 12): 1s22s22p63s2
→ Mg có 3 lớp electron
+ Li (Z = 3): 1s22s1
→ Mg có 2 lớp electron
+ P (Z = 15): 1s22s22p63s23p3
→ Mg có 3 lớp electron
+ F (Z = 9): 1s22s22p5
→ Mg có 2 lớp electron
- Các nguyên tố thuộc chu kì 2 là: Li, F
Bài 2: Giả sử nguyên tố M ở ô số 19 trong bảng tuần hoàn chưa được tìm ra và ô này vẫn còn được bỏ trống. Hãy dự đoán những đặc điểm sau về nguyên tố đó:
a. Tính chất đặc trưng.
b. Công thức oxit. Oxit đó là oxit axit hay oxit bazơ?
Hướng dẫn giải
a, Cấu hình electron của nguyên tố đó là: 1s22s22p63s23p64s1
⇒ Electron lớp ngoài cùng là 1 nên tính chất đặc trưng của M là tính kim loại.
b, Nguyên tố đó nằm ở nhóm IA nên công thức oxit là M2O. Đây là một oxit bazơ.
Luyện tập Bài 6 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hoá học.
- Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hoá học và nêu được các khái niệm liên quan: ô, chu kì, nhóm.
- Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hoá học.
- Phân loại được nguyên tố hoá học.
3.1. Trắc nghiệm Bài 6 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 6 cực hay có đáp án và lời giải chi tiết.
-
- A. X thuộc nhóm VIA.
- B. X thuộc nhóm IIA.
- C. Q thuộc nhóm IB.
- D. Q thuộc nhóm IA.
-
- A. Theo chiều tăng dần của điện tích hạt nhân.
- B. Các nguyên tố có cùng số electron hoá trị trong nguyên tử xếp thành 1 cột.
- C. Các nguyên tố có cùng số lớp electron nguyên tử được xếp thành 1 hàng.
- D. Tất cả các ý trên.
-
- A. Số electron thuộc lớp ngoài cùng như nhau.
- B. Số electron như nhau.
- C. Số lớp electron như nhau.
- D. Cùng số electron s hay p.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 6 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 6 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 32 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 32 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 32 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 3 trang 33 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 4 trang 34 SGK Hóa học 10 Cánh Diều - CD
Vận dụng 1 trang 34 SGK Hóa học 10 Cánh Diều - CD
Vận dụng 2 trang 34 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 5 trang 34 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 6 trang 35 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 35 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 36 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 7 trang 37 SGK Hóa học 10 Cánh Diều - CD
Vận dụng trang 37 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 37 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 37 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 37 SGK Hóa học 10 Cánh Diều - CD
Giải bài 6.1 trang 17 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.2 trang 17 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.3 trang 17 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.4 trang 18 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.5 trang 18 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.6 trang 18 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.7 trang 18 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.8 trang 18 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.9 trang 19 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.10 trang 19 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.11 trang 19 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.12 trang 19 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.13 trang 19 SBT Hóa học 10 Cánh Diều - CD
Giải bài 6.14 trang 19 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 6 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







