Dưới đây là lý thuyết và bài tập minh họa Bài 20: Ôn tập chương 6 môn Hóa 10 Kết nối tri thức. Bài giảng đã được HỌC247 biên soạn ngắn gọn, đầy đủ, dễ hiểu về tốc độ phản ứng hóa học, các yếu tố ảnh hưởng đến tốc độ phản ứng... giúp các em dễ dàng nắm được nội dung chính của bài.
Tóm tắt lý thuyết
1.1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)...
Tốc độ phản ứng được xác định bằng thực nghiệm.
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
\(\overline V = - \frac{{{C_2} - {C_1}}}{{{t_2} - {t_1}}} = - \frac{{\Delta C}}{{\Delta t}}\)
1.2. Các yếu tố ảnh hưởng đến tốc độ phản ứng
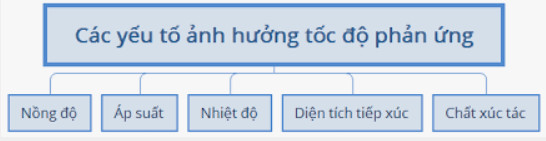
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.
Bài tập minh họa
Bài 1: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng ?
A. Nung kaliclorat ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxi.
D. Dùng phương pháp dời không khí để thu khí oxi.
Hướng dẫn giải
Đáp án B.
2KClO3 → 2KCl + 3O2
Sử dụng MnO2 làm chất xúc tác
Bài 2: Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn?
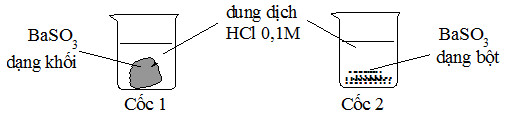
A. Cốc 1 tan nhanh hơn.
B. Cốc 2 tan nhanh hơn.
C. Tốc độ tan ở 2 cốc như nhau.
D. BaSO3 tan nhanh nên không quan sát được.
Hướng dẫn giải
Đáp án B.
Sử dụng yếu tố diện tích tiếp xúc, thí nghiệm 2: BaSO3 dạng bột sẽ làm tăng diện tích tiếp xúc, tốc độ phản ứng xảy ra nhanh hơn.
Bài 3: Cho phản ứng của các chất ở thể khí: I2 + H2 → 2HI
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).
Nồng độ đầu của I2 và H2 lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng I2.
Hướng dẫn giải
a) v = k . CI2.CH2
Trong đó k là hằng số tốc độ phản ứng
CI2.CH2 lần lượt là nồng độ của I2 và H2 tại một thời điểm đang xét
b)
- Tốc độ phản ứng tại thời điểm đầu:
v = k . CI2.CH2 = 2,5 . 10-4 . 0,02 . 0,03 = 1,5 . 10-7(mol/(Ls))
- Tốc độ phản ứng tại thời điểm hết một nửa lượng I2
→ CI2= 0,01 M
CH2 = 0,02 M
v = k . CI2.CH2 = 2,5 . 10-4 . 0,01 . 0,02 = 5.10-8(mol/(Ls))
Luyện tập Bài 20 Hóa 10 KNTT
Sau bài học này, học sinh có thể:
- Nắm được các khái niệm từ cơ bản đến tổng quan về tốc độ phản ứng hóa học và các yếu tố ảnh hưởng đến tốc độ phản ứng.
3.1. Trắc nghiệm Bài 20 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Kết nối tri thức Bài 20 cực hay có đáp án và lời giải chi tiết.
-
- A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột
- B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M
- C. Tăng nhiệt độ phản ứng từ 25oC đến 500 C
- D. Dùng thể tích dung dịch H2SO4 gấp đôi ban đầu
-
- A. Cốc A xuất hiện kết tủa vàng nhạt, cốc B không thấy kết tủa.
- B. Cốc A xuất hiện kết tủa nhanh hơn cốc B.
- C. Cốc A xuất hiện kết tủa chậm hơn cốc B.
- D. Cốc A và cốc B xuất hiện kết tủa với tốc độ như nhau.
-
- A. 1
- B. 2
- C. 3
- D. 4
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 20 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 20 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải bài 1 trang 102 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 2 trang 102 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 3 trang 102 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 4 trang 102 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 5 trang 102 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.1 trang 62 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.2 trang 62 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.3 trang 62 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.4 trang 62 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.5 trang 62 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.6 trang 63 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.7 trang 63 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.8 trang 63 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.9 trang 63 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.10 trang 64 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.11 trang 64 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 20.12 trang 64 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 20 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!







