─Éß╗ā gi├║p c├Īc em c├│ thß╗ā ph├ón biß╗ćt ─æŲ░ß╗Żc li├¬n kß║┐t ion, li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c v├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c theo ─æß╗Ö ├óm ─æiß╗ćn ─æß╗Ö ng┼® gi├Īo vi├¬n HOC247 ─æ├Ż bi├¬n soß║Īn v├Ā tß╗Ģng hß╗Żp nß╗Öi dung b├Āi giß║Żng Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ m├┤n H├│a hß╗Źc 10 chŲ░ŲĪng tr├¼nh SGK Kß║┐t nß╗æi tri thß╗®c b├¬n dŲ░ß╗øi ─æ├óy.
T├│m tß║»t l├Į thuyß║┐t
1.1. Sß╗▒ tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ
- Nguy├¬n tß╗Ł phi kim c├│ lß╗øp electron ho├Ī trß╗ŗ gß║¦n b├Żo ho├Ā v├Ā c├│ xu hŲ░ß╗øng nhß║Łn th├¬m electron ─æß╗ā ─æß║Īt cß║źu h├¼nh electron bß╗ün vß╗»ng cß╗¦a nguy├¬n tß╗Ł khi hiß║┐m. Khi hai nguy├¬n tß╗Ł phi kim kß║┐t hß╗Żp vß╗øi nhau tß║Īo th├Ānh phß║¦n tß╗½, ch├║ng sß║Į g├│p mß╗Öt hoß║Ęc nhiß╗üu electron ─æß╗ā tß║Īo th├Ānh c├Īc cß║Ęp electron d├╣ng chung. C├Īc cß║Ęp electron d├╣ng chung ─æŲ░ß╗Żc t├Łnh cho cß║Ż hai nguy├¬n tß╗Ł trong ph├ón tß╗Ł n├¬n mß╗Śi nguy├¬n tß╗½ ─æß╗üu ─æß║Īt ─æŲ░ß╗Żc cß║źu h├¼nh bß╗ün vß╗»ng theo quy tß║»c octet, Cß║Ęp electron d├╣ng chung tß║Īo ra li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ giß╗»a hai nguy├¬n tß╗Ł.
- Cß║Ęp electron d├╣ng chung giß╗»a hai nguy├¬n tß╗Ł c├│ thß╗ā ─æŲ░ß╗Żc tß║Īo th├Ānh theo hai kiß╗āu kh├Īc nhau.
- Mß╗Śi nguy├¬n tß╗Ł g├│p mß╗Öt hay nhiß╗üu electron ─æß╗ā tß║Īo th├Ānh c├Īc cß║Ęp electron d├╣ng chung.
V├Ł dß╗ź: A. + .B ŌåÆ A : B hoß║Ęc A- B (li├¬n kß║┐t A- B l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ).
- Cß║Ęp electron d├╣ng chung chß╗ē do mß╗Öt nguy├¬n tß╗½ ─æ├┤ng g├│p, li├¬n kß║┐t giß╗»a hai nguy├¬n tß╗½ l├Ā li├¬n kß║┐t Cß╗Öng ho├Ī trß╗ŗ liß╗ću cho - nhß║Łn.
V├Ł dß╗ź: Khi cß║Ęp electron d├╣ng chung chß╗ē do nguy├¬n tß╗½ B ─æ├│ng g├│p, nguy├¬n tß╗½ B l├Ā nguy├¬n tß╗Ł cho electron, nguy├¬n tß╗Ł A l├Ā nguy├¬n tß╗Ł nhß║Łn electron. K├Ł hiß╗ću BŌåÆA.
a. Sß╗▒ tß║Īo th├Ānh phß║¦n tß╗½ c├│ li├¬n kß║┐t ─æŲĪn
- Ph├ón tß╗Ł chlorine: Mß╗Śi nguy├¬n tß╗½ chlorine c├│ 7 electron ho├Ī trß╗ŗ, hai nguy├¬n tß╗½ chlorine li├¬n kß║┐t vß╗øi nhau bß║▒ng c├Īch m├Ā nguy├¬n tß╗Ł chlorine g├│p 1 electron, tß║Īo th├Ānh mß╗Öt cß║Ęp electron d├╣ng chung. Khi ─æ├│, trong ph├ón tß╗Ł Cl2, mß╗Śi nguy├¬n tß╗Ł ─æß╗üu c├│ 8 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, thoß║Ż m├Żn quy tß║»c octet.
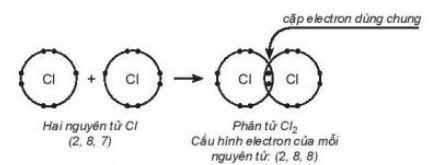
H├¼nh 12.1. SŲĪ ─æß╗ō m├┤ tß║Ż sß╗▒ d├╣ng chung cß║Ęp electron giß╗»a hai nguy├¬n tß╗Ł chlorine, tß║Īo th├Ānh phß║¦n tß╗Ł chorine
+ Tß╗½ c├┤ng thß╗®c electron, thay mß╗Öt cß║Ęp lectron d├╣ng chung bß║▒ng mß╗Öt gß║Īch nß╗æi th├¼ thu ─æŲ░ß╗Żc C├┤ng thß╗®c Lewis (Li-u├Įt).
+ C├│ thß╗ā biß╗āu diß╗ģn bß║▒ng sŲĪ ─æß╗ō:
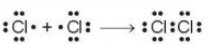
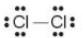
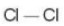
C├┤ng thß╗®c electron C├┤ng thß╗®c Lewis C├┤ng thß╗®c cß║źu tß║Īo
H├¼nh 12.2. SŲĪ ─æß╗ō sß╗▒ tß║Īo th├Ānh phß║¦n tß╗Ł chlorine
+ Giß╗»a hai nguy├¬n tß╗Ł chlorine c├│ mß╗Öt cß║Ęp electron c├╣ng chung (biß╗āu diß╗ģn bß║▒ng mß╗Öt gß║Īch nß╗Ģi), ─æ├│ l├Ā li├¬n kß║┐t ─æŲĪn.
- Ph├ón tß╗Ł hydrogen chloride: Nguy├¬n tß╗Ł hydrogen li├¬n kß║┐t vß╗øi nguy├¬n tß╗Ł chlorine bß║▒ng c├Īch mß╗Śi nguy├¬n tß╗Ł g├│p 1 electron tß║Īo th├Ānh 1 cß║Ęp electron d├╣ng chung trong ph├ón tß╗Ł HCl. Khi ─æ├│ nguy├¬n tß╗Ł hydrogen c├│ 2 electron (cß║źu h├¼nh electron bß╗ün vß╗»ng cß╗¦a nguy├¬n tß╗Ł khß╗ē hiß╗ām He) v├Ā nguy├¬n tß╗Ł chlorine c├│ 8 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, thoß║Ż m├Żn quy t├Īc octet.

C├┤ng thß╗®c electron C├┤ng thß╗®c Lewis C├┤ng thß╗®c cß║źu tß║Īo
H├¼nh 12.3. SŲĪ ─æß╗ō sß╗▒ tß║Īo th├Ānh ph├ón tß╗Ł hydrogen chloride
+ Giß╗»a hai nguy├¬n tß╗Ł hydrogen v├Ā chlorine c├│ mß╗Öt cß║Ęp electron d├╣ng chung (biß╗āu diß╗ģn bß║▒ng mß╗Öt gß║Īch n├┤i), ─æ├│ l├Ā li├¬n kß║┐t ─æŲĪn.
- Ph├ón tß╗Ł hß╗Żp chß║źt c├│ li├¬n kß║┐t cho ŌĆō nhß║Łn:
+ Trong ph├ón tß╗Ł NH3, lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł nitrogen c├│ 5 electron, trong ─æ├│ c├│ cß║Łp electron chŲ░a li├¬n kß║┐t. lon H+ c├│ orbital trß╗æng, kh├┤ng c├│ electron.
+ Khi ph├ón tß╗½ NH3 kß║┐t hß╗Żp vß╗øi ion H+, nguy├¬n tß╗Ł nitrogen ─æ├│ng g├│p cß║Ęp electron chŲ░a li├¬n kß║┐t ─æß╗ā tß║Īo li├¬n kß║┐t vß╗øi ion H+ tß║Īo th├Ānh NH4+.
+ Khi ─æ├│, li├¬n kß║┐t cho - nhß║Łn ─æŲ░ß╗Żc h├¼nh th├Ānh, trong ph├ón tß╗½ NH3, nguy├¬n tß╗½ nitrogen l├Ā nguy├¬n tß╗½ cho, ion H+ l├Ā nguy├¬n tß╗½ nhß║Łn.
+ Trong ion NH4+ bß║Żn li├¬n kß║┐t NŌĆōH ho├Ān to├Ān tŲ░ŲĪng ─æŲ░ŲĪng nhau.
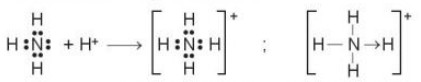
C├┤ng thß╗®c electron C├┤ng thß╗®c cß║źu tß║Īo
H├¼nh 12.4. SŲĪ ─æß╗ō sß╗▒ tß║Īo th├Ānh ion NH4+
b. Sß╗▒ tß║Īo th├Ānh ph├ón tß╗Ł c├│ li├¬n kß║┐t ─æ├┤i
- Ph├ón tß╗Ł oxygen: Mß╗Śi nguy├¬n tß╗Ł oxygen c├│ 6 electron ho├Ī trß╗ŗ, hai nguy├¬n tß╗Ł oxygen li├¬n kß║┐t vß╗øi nhau bß║▒ng c├Īch mß╗Śi nguy├¬n tß╗½ ─æ├│ng g├│p 2 electron, tß║Īo th├Ānh 2 cß║Ęp electron d├╣ng chung.
+ Trong ph├ón tß╗Ł O2, mß╗Śi nguy├¬n tß╗Ł oxygen ─æß╗üu c├│ 8 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, thoß║Ż m├Żn quy tß║»c octet.

C├┤ng thß╗®c electron C├┤ng thß╗®c Lewis C├┤ng thß╗®c cß║źu tß║Īo
H├¼nh 12.5. SŲĪ ─æß╗ō sß╗▒ tß║Īo th├Ānh ph├ón tß╗Ł oxygen
+ Giß╗»a hai nguy├¬n tß╗Ł oxygen c├│ hai cß║Ęp electron d├╣ng chung (biß╗āu diß╗ģn bß║▒ng hai gß║Īch nß╗æi ), ─æ├│ l├Ā li├¬n kß║┐t ─æ├┤i
- Ph├ón tß╗Ł carbon dioxide: Nguy├¬n tß╗½ carbon c├│ 4 electron ho├Ī trß╗ŗ, nguy├¬n tß╗Ł oxygen c├│ 6 electron ho├Ī trß╗ŗ. Hai nguy├¬n tß╗Ł oxygen li├¬n kß║┐t mß╗Öt nguy├¬n tß╗Ł carbon bß║▒ng c├Īch mß╗Śi nguy├¬n tß╗Ł oxygen ─æ├│ng g├│p 2 electron v├Ā nguy├¬n tß╗Ł carton ─æ├│ng g├│p 4 electron tß║Īo th├Ānh bß╗æn cß║Ęp electron d├╣ng chung.
+ Khi ─æ├│, trong ph├ón tß╗Ł CO2, mß╗Śi nguy├¬n tß╗Ł ─æß╗üu c├│ 8 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, thoß║Ż m├Żn quy tß║»c octet.

C├┤ng thß╗®c electron C├┤ng thß╗®c Lewis C├┤ng thß╗®c cß║źu tß║Īo
H├¼nh 12.6. SŲĪ ─æß╗ō sß╗▒ tß║Īo th├Ānh ph├ón tß╗Ł carbon dioxide
+ Giß╗»a nguy├¬n tß╗Ł C v├Ā nguy├¬n tß╗Ł O c├│ 2 cß║Ęp electron d├╣ng chung (biß╗āu diß╗ģn bß║▒ng hai gß║Īch nß╗æi ), ─æ├│ l├Ā li├¬n kß║┐t ─æ├┤i. Ph├ón tß╗½ CO2, c├│ hai li├¬n kß║┐t ─æ├┤i.
c. Sß╗▒ tß║Īo th├Ānh phß║¦n tß╗Ł c├│ li├¬n kß║┐t ba
- Ph├ón tß╗Ł nitrogen: Nguy├¬n tß╗½ nitrogen c├│ 5 electron ho├Ī trß╗ŗ, hai nguy├¬n tß╗Ł nitrogen li├¬n kß║┐t vß╗øi nhau bß║▒ng c├Īch mß╗Śi nguy├¬n tß╗Ł nitrogen ─æ├│ng g├│p 3 electron, tß║Īo th├Ānh ba cß║Ęp electron d├╣ng chung.
+ Khi ─æ├│, trong phß║¦n tß╗½ N2, mß╗Śi nguy├¬n tß╗Ł ─æß╗üu c├│ 8 electron ß╗¤ lß╗øp ngo├Āi c├╣ng, thoß║Ż m├Żn quy tß║»c octet.

C├┤ng thß╗®c electron C├┤ng thß╗®c Lewis C├┤ng thß╗®c cß║źu tß║Īo
H├¼nh 12.7. SŲĪ ─æß╗ō sß╗▒ tß║Īo th├Ānh ph├ón tß╗Ł nitrogen
+ Giß╗»a hai nguy├¬n tß╗Ł nitrogen c├│ ba cß║Ęp electron d├╣ng chung (biß╗āu diß╗ģn bß║▒ng ba gß║Īch nß╗æi), ─æ├│ l├Ā li├¬n kß║┐t ba.
- Li├¬n kß║┐t tß║Īo th├Ānh trong c├Īc ph├ón tß╗Ł Cl2, HCl, O2, CO2, N2,... l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ
- Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc tß║Īo th├Ānh giß╗»a hai nguy├¬n tß╗Ł bß║▒ng mß╗Öt hay nhiß╗üu cß║Ęp electron d├╣ng chung
- Li├¬n kß║┐t trong c├Īc ph├ón tß╗Ł Cl2, O2, N2,... c├│ cß║Ęp electron d├╣ng chung kh├┤ng bß╗ŗ h├║t lß╗ćch vß╗ü ph├Ła nguy├¬n tß╗½ n├Āo ─æŲ░ß╗Żc gß╗Źi l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c. Li├¬n kß║┐t trong phß║¦n tß╗½ HCl c├│ cß║Ęp electron d├╣ng chung lß╗ćch vß╗ü ph├Ła nguy├¬n tß╗Ł c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn hŲĪn (Cl) ─æŲ░ß╗Żc gß╗Źi l├Ā li├¬n kß║┐t Cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c.
|
- C├┤ng thß╗®c Lewis cß╗¦a mß╗Öt sß╗æ chß║źt ─æŲĪn giß║Żn - Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ─æŲ░ß╗Żc tß║Īo th├Ānh giß╗»a hai nguy├¬n tß╗Ł bß║▒ng mß╗Öt hay nhiß╗üu cß║Ęp electron d├╣ng chung |
|---|
1.2. ─Éß╗Ö ├óm ─æiß╗ćn v├Ā li├¬n kß║┐t h├│a hß╗Źc
- ─Éß╗Ö ├óm ─æiß╗ćn ─æß║Ęc trŲ░ng cho khß║Ż n─āng h├║t lectron cß╗¦a nguy├¬n tß╗½ khi h├¼nh th├Ānh li├¬n kß║┐t ho├Ī hß╗Źc.
- Dß╗▒a v├Āo sß╗▒ kh├Īc nhau vß╗ü ─æß╗Ö ├óm ─æiß╗ćn giß╗»a c├Īc nguy├¬n tß╗Ł tham gia li├¬n kß║┐t, c├│ thß╗ā dß╗▒ ─æo├Īn ─æŲ░ß╗Żc loß║Īi li├¬n kß║┐t giß╗»a hai nguy├¬n tß╗½ ─æ├│ (Bß║Żng 12.1)
Bß║Żng 121. Mß╗æi quan hß╗ć giß╗»a hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn vß╗øi li├¬n kß║┐t ho├Ī hß╗Źc
|
Trß║Īng th├Īi cß╗¦a cß║Ęp electron li├¬n kß║┐t |
Hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn \(\Delta \chi \) |
─Éß║Ęc ─æiß╗ām li├¬n kß║┐t |
Loß║Īi li├¬n kß║┐t |
|
Cß║Ęp electron li├¬n kß║┐t kh├┤ng bß╗ŗ h├║t lß╗ćch vß╗ü ph├Ła nguy├¬n tß╗Ł n├Āo. |
\(0 \le \left| {\Delta \chi } \right| < 0,4\) |
Li├¬n kß║┐t kh├┤ng bß╗ŗ ph├ón cß╗▒c |
Cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c. |
|
Cß║Ęp electron li├¬n kß║┐t h├║t lß╗ćch vß╗ü ph├Ła nguy├¬n tß╗Ł c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn hŲĪn |
\(0,4 \le \left| {\Delta \chi } \right| < 1,7\) |
Li├¬n kß║┐t bß╗ŗ ph├ón cß╗▒c |
Cß╗Öng h├│a trß╗ŗ ph├ón cß╗▒c |
|
Cß║Ęp electron li├¬n kß║┐t chuyß╗ān hß║│n ─æß║┐n nguy├¬n tß╗Ł nhß║Łn electron tß║Īo th├Ānh ion ├óm v├Ā nguy├¬n tß╗Ł nhŲ░ß╗Øng electron tß║Īo th├Ānh ion dŲ░ŲĪng. |
\(\left| {\Delta \chi } \right| \ge 1,7\) |
Li├¬n kß║┐t bß╗ŗ ph├ón cß╗▒c mß║Īnh
|
Ion |
V├Ł dß╗ź:
- Trong ph├ón tß╗Ł HCl, hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a Cl v├Ā H: 3,16 ŌĆō 2,20 = 0,96. V├¼ vß║Ły, li├¬n kß║┐t giß╗»a H v├Ā Cl l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c.
- Trong ph├ón tß╗Ł CO2, hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a O v├Ā C: 3,44 - 2,55 = 0,89. V├¼ vß║Ły, li├¬n kß║┐t giß╗»a C v├Ā O l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c. Tuy nhi├¬n, do ph├ón tß╗Ł CO2, c├│ cß║źu tß║Īo thß║│ng n├¬n ─æß╗Ö ph├ón cß╗▒c cß╗¦a hai li├¬n kß║┐t ─æ├┤i (C=O) triß╗ćt ti├¬u nhau, dß║½n ─æß║┐n to├Ān bß╗Ö ph├ón tß╗½ kh├┤ng bß╗ŗ ph├ón cß╗▒c.
- Trong ph├ón tß╗Ł NaCl, hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a Cl v├Ā Na 3,16 -0,93 = 2,33. V├¼ vß║Ły, li├¬n kß║┐t giß╗»a Na v├Ā Cl l├Ā li├¬n kß║┐t ion. Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c c├│ thß╗ā ─æŲ░ß╗Żc coi l├Ā dß║Īng trung gian giß╗»a li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c v├Ā li├¬n kß║┐t ion.
|
- Dß╗▒a v├Āo hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a c├Īc nguy├¬n tß╗Ł, dß╗▒ ─æo├Īn loß║Īi li├¬n kß║┐t:
|
|---|
1.3. M├┤ tß║Ż li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ bß║▒ng sß╗▒ xen phß╗¦ c├Īc Orbital nguy├¬n tß╗Ł
a. Sß╗▒ xen phß╗¦ c├Īc orbital nguy├¬n tß╗Ł tß║Īo li├¬n kß║┐t \(\sigma \) (sigma)
- Sß╗▒ xen phß╗¦ s-s
+ Ph├ón tß╗Ł H2 tß║Īo th├Ānh tß╗½ 2 nguy├¬n tß╗Ł H (1s1). Khi 2 nguy├¬n tß╗Ł H tiß║┐n lß║Īi gß║¦n nhau, hß║Īt nh├ón cß╗¦a nguy├¬n tß╗Ł n├Āy h├║t ─æ├Īm m├óy electron cß╗¦a nguy├¬n tß╗Ł kia, hai orbital nguy├¬n tß╗Ł xen phß╗¦ v├Āo nhau mß╗Öt ph├ón. V├╣ng xen phß╗¦ c├│ mß║Łt ─æß╗Ö ─æiß╗ćn t├Łch ├óm lß╗øn, l├Ām t─āng lß╗▒c h├║t cß╗¦a mß╗Śi hß║Īt nh├ón vß╗øi v├╣ng n├Āy v├Ā l├Ām c├ón bß║▒ng lß╗▒c ─æß║®y giß╗»a hai hß║Īt nh├ón, ─æß╗ā hai nguy├¬n tß╗Ł li├¬n kß║┐t vß╗øi nhau.
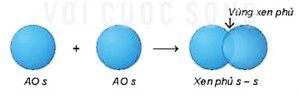
H├¼nh 12.9. SŲĪ ─æß╗ō xen phß╗¦ orbital s v├Ā s, tß║Īo li├¬n kß║┐t \(\sigma \)
+ Trong ph├ón tß╗Ł H2, khoß║Żng c├Īch giß╗»a t├óm cß╗¦a hai hß║Īt nh├ón nguy├¬n tß╗Ł H (─æß╗Ö d├Āi li├¬n kß║┐t H-H) l├Ā 74 pm, ngß║»n hŲĪn tß╗Ģng b├Īn k├Łnh cß╗¦a hai nguy├¬n tß╗Ł H (106 pm). Ph├ón tß╗Ł bß╗ün hŲĪn v├Ā c├│ n─āng lŲ░ß╗Żng thß║źp hŲĪn tß╗Ģng n─āng lŲ░ß╗Żng cß╗¦a hai nguy├¬n tß╗Ł H ri├¬ng rß║Į.
- Sß╗▒ xen phß╗¦ s-p
+ Ph├ón tß╗Ł HF tß║Īo th├Ānh khi orbital 1s cß╗¦a nguy├¬n tß╗Ł H (1s1) xen ph├╣ vß╗øi orbital 2p cß╗¦a nguy├¬n tß╗Ł F (2s22p5) theo trß╗źc li├¬n kß║┐t, tß║Īo li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ giß╗»a H v├Ā F, v├╣ng xen phß╗¦ c├Āng lß╗øn th├¼ li├¬n kß║┐t c├Āng bß╗ün.
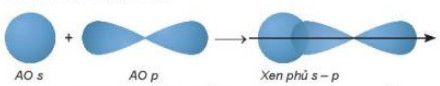
H├¼nh 12.10. SŲĪ ─æß╗ō xen phß╗¦ orbital s v├Ā p, tß║Īo li├¬n kß║┐t \(\sigma \)
- Sß╗▒ xen phß╗¦ p - p
+ Ph├ón tß╗Ł Cl2, tß║Īo th├Ānh khi hai abital 3p cß╗¦a hai nguy├¬n tß╗Ł Cl (3s23p5) xen phß╗¦ theo trß╗źc li├¬n kß║┐t cß╗¦a hai nguy├¬n tß╗Ł Cl.

H├¼nh 12.11. SŲĪ ─æß╗ō xen phß╗¦ orbital p v├Ā p, tß║Īo li├¬n kß║┐t \(\sigma \)
+ Trong c├Īc trŲ░ß╗Øng hß╗Żp xen phß╗¦ tr├¬n, ─æß╗ā v├╣ng xen phß╗¦ cß╗▒c ─æß║Īi, c├Īc orbital sß║Į xen phß╗¦ vß╗øi nhau theo trß╗źc li├¬n kß║┐t.
+ Sß╗▒ xen phß╗¦ nhŲ░ thß╗ā gß╗Źi l├Ā xen phß╗¦ trß╗źc, tß║Īo ra li├¬n kß║┐t \(\sigma \), c├Īc li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ─æŲĪn ─æß╗üu l├Ā li├¬n kß║┐t \(\sigma \).
+ Trong li├¬n kß║┐t \(\sigma \), mß║Łt ─æß╗Ö x├Īc suß║źt t├Łm thß║źy electron lß╗øn nhß║źt dß╗Źc theo trß╗źc li├¬n kß║┐t.
b. Sß╗▒ xen phß╗¦ c├Īc orbital nguy├¬n tß╗Ł tß║Īo li├¬n kß║┐t \(\pi \) (pi)
- Sß╗▒ xen phß╗¦, trong ─æ├│ trß╗źc cß╗¦a c├Īc orbital tham gia li├¬n kß║┐t song song vß╗øi nhau v├Ā vu├┤ng g├│c vß╗øi ─æŲ░ß╗Øng nß╗æi t├óm cß╗¦a hai nguy├¬n tß╗Ł li├¬n kß║┐t, ─æŲ░ß╗Żc gß╗Źi l├Ā xen phß╗¦ b├¬n. Sß╗▒ xen phß╗¦ b├¬n tß║Īo ra li├¬n kß║┐t \(\pi \) (pi) (H├¼nh 12.12).
- ß╗× nhß╗»ng li├¬n kß║┐t ─æß╗æi v├Ā ba (nhŲ░ trong ph├ón tß╗Ł N2, C2H4,... ), ngo├Āi li├¬n kß║┐t \(\sigma \) c├▓n c├│ li├¬n kß║┐t \(\pi \).
- Li├¬n kß║┐t ─æ├┤i gß╗ōm mß╗Öt li├¬n kß║┐t \(\sigma \) v├Ā mß╗Öt li├¬n kß║┐t \(\pi \).
- Li├¬n kß║┐t ba gß╗ōm mß╗Öt li├¬n kß║┐t \(\sigma \) v├Ā hai li├¬n kß║┐t \(\pi \).
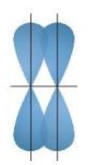
H├¼nh 12.12. SŲĪ ─æß╗ō xen phß╗¦ orbial p v├Ā p, tß║Īo li├¬n kß║┐t \(\pi \)
|
- Sß╗▒ xen phß╗¦ orbital theo trß╗źc li├¬n kß║┐t tß║Īo ra li├¬n kß║┐t \(\sigma \). Sß╗▒ xen phß╗¦ b├¬n cß╗¦a c├Īc orbital tß║Īo ra li├¬n kß║┐t \(\pi \) - C├Īc li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ─æŲĪn ─æß╗üu l├Ā li├¬n kß║┐t \(\sigma \), 1 li├¬n kß║┐t ─æ├┤i gß╗ōm 1 li├¬n kß║┐t \(\sigma \) v├Ā 1 li├¬n kß║┐t \(\pi \), 1 li├¬n kß║┐t ba gß╗ōm \(\sigma \) li├¬n kß║┐t ß╗¤ v├Ā 2 li├¬n kß║┐t \(\pi \) |
|---|
1.4. N─āng lŲ░ß╗Żng li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ
- N─āng lŲ░ß╗Żng li├¬n kß║┐t (Eb) l├Ā n─āng lŲ░ß╗Żng cß║¦n thiß║┐t ─æß╗ā ph├Ī vß╗Ī mß╗Öt li├¬n kß║┐t ho├Ī hß╗Źc trong ph├ón tß╗¦ ß╗¤ thß║┐ khi th├Ānh c├Īc nguy├¬n tß╗½ ß╗¤ thß╗ü kh├Ł. N─āng lŲ░ß╗Żng li├¬n kß║┐t thŲ░ß╗Øng c├│ ─æŲĪn vß╗ŗ l├Ā kJ/mol,
- V├Ł dß╗ź: ─Éß╗ā ph├Ī vß╗Ī 1 mol li├¬n kß║┐t H-Cl th├Ānh c├Īc nguy├¬n tß╗Ł H v├Ā Cl (ß╗¤ thß╗ā kh├Ł) theo phŲ░ŲĪng tr├¼nh: HCl(g) ŌåÆ H(g) + Cl(g) cß║¦n n─āng lŲ░ß╗Żng l├Ā 432 kJ, n├¬n n─āng lŲ░ß╗Żng li├¬n kß║┐t H-Cl l├Ā Eb = 432 kJ/mol.
Bß║Żng 12.2. N─āng lŲ░ß╗Żng li├¬n kß║┐t trung b├¼nh cß╗¦a mß╗Öt sß╗æ li├¬n kß║┐t h├│a hß╗Źc
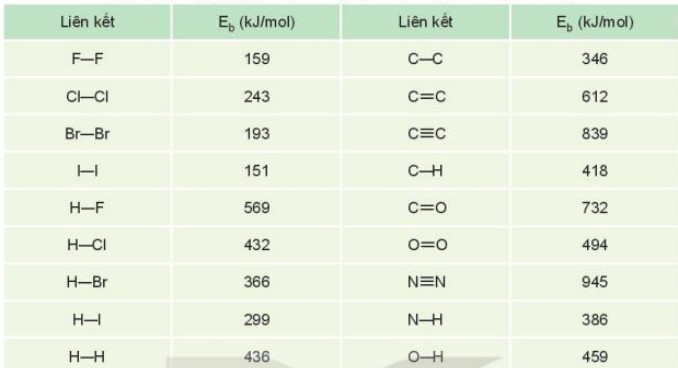
- N─āng lŲ░ß╗Żng li├¬n kß║┐t ─æß║Ęc trŲ░ng cho ─æß╗Ö bß╗ün cß╗¦a li├¬n kß║┐t. N─āng lŲ░ß╗Żng li├¬n kß║┐t c├Āng lß╗øn th├¼ li├¬n kß║┐t c├Āng bß╗ün v├Ā ph├ón tß╗Ł c├Āng kh├│ bß╗ŗ ph├ón hß╗¦y.
| N─āng lŲ░ß╗Żng li├¬n kß║┐t l├Ā n─āng lŲ░ß╗Żng cß║¦n thiß║┐t ─æß╗ā ph├Ī vß╗Ī mß╗Öt li├¬n kß║┐t ho├Ī hß╗Źc trong ph├ón tß╗Ł ß╗¤ thß╗ā khi th├Ānh c├Īc nguy├¬n tß╗Ł ß╗¤ thß╗ā kh├Ł. N─āng lŲ░ß╗Żng li├¬n kß║┐t ─æß║Ęc trŲ░ng cho ─æß╗Ö bß╗ün cß╗¦a li├¬n kß║┐t. |
|---|
B├Āi tß║Łp minh hß╗Źa
B├Āi 1: Nguy├¬n tß╗Ł hydrogen v├Ā chlorine dß╗ģ d├Āng kß║┐t hß╗Żp ─æß╗ā tß║Īo th├Ānh ph├ón tß╗Ł hydrogen cloride (HCl), li├¬n kß║┐t trong trŲ░ß╗Øng hß╗Żp n├Āy c├│ g├¼ kh├Īc so vß╗øi li├¬n kß║┐t ion trong ph├ón tß╗Ł sodium chloride (NaCl)?
HŲ░ß╗øng dß║½n giß║Żi
- Nguy├¬n tß╗Ł H c├│ 1 electron lß╗øp ngo├Āi c├╣ng, cß║¦n 1 electron ─æß╗ā ─æß║Īt cß║źu h├¼nh bß╗ün giß╗æng He. Nguy├¬n tß╗Ł Cl c├│ 7 electron lß╗øp ngo├Āi c├╣ng, c┼®ng cß║¦n 1 electron ─æß╗ā ─æß║Īt cß║źu h├¼nh bß╗ün giß╗æng Ne.
ŌåÆ H v├Ā Cl khi li├¬n kß║┐t vß╗øi nhau c├│ xu hŲ░ß╗øng g├│p chung electron ─æß╗ā xung quanh mß╗Śi nguy├¬n tß╗Ł ─æß╗üu c├│ sß╗æ electron ─æß║Īt cß║źu h├¼nh bß╗ün cß╗¦a kh├Ł hiß║┐m tß║Īo li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ.
- Trong ph├ón tß╗Ł NaCl c├│ ion sodium mang ─æiß╗ćn t├Łch dŲ░ŲĪng, ion chlorine mang ─æiß╗ćn t├Łch ├óm n├¬n h├¼nh th├Ānh li├¬n kß║┐t ion.
Vß║Ły li├¬n kß║┐t trong ph├ón tß╗Ł HC l├Ā li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ c├▓n li├¬n kß║┐t trong ph├ón tß╗Ł NaCl l├Ā li├¬n kß║┐t ion.
B├Āi 2: Sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t Žā v├Ā ŽĆ kh├Īc nhau nhŲ░ thß║┐ n├Āo?
HŲ░ß╗øng dß║½n giß║Żi
a) Li├¬n kß║┐t Žā
- Li├¬n kß║┐t Žā ─æŲ░ß╗Żc h├¼nh th├Ānh do sß╗▒ xen phß╗¦ giß╗»a hai obitan h├│a trß╗ŗ cß╗¦a hai nguy├¬n tß╗Ł tham gia li├¬n kß║┐t dß╗Źc theo trß╗źc li├¬n kß║┐t.
- T├Łnh chß║źt cß╗¦a li├¬n kß║┐t Žā l├Ā ─æß╗æi xß╗®ng qua trß╗źc li├¬n kß║┐t, c├Īc nguy├¬n tß╗Ł tham gia li├¬n kß║┐t quay quanh trß╗źc li├¬n kß║┐t. Li├¬n kß║┐t Žā bß╗ün hŲĪn c├Īc loß║Īi li├¬n kß║┐t kh├Īc.
b) Li├¬n kß║┐t ŽĆ
- Li├¬n kß║┐t ŽĆ l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc h├¼nh th├Ānh do sß╗▒ xen phß╗¦ giß╗»a hai obitan h├│a trß╗ŗ cß╗¦a 2 nguy├¬n tß╗Ł tham gia li├¬n kß║┐t ß╗¤ hai b├¬n trß╗źc li├¬n kß║┐t (xen phß╗¦ b├¬n).
- T├Łnh chß║źt cß╗¦a li├¬n kß║┐t ŽĆ l├Ā kh├┤ng c├│ t├Łnh ─æß╗æi xß╗®ng trß╗źc, n├¬n hai nguy├¬n tß╗Ł tham gia li├¬n kß║┐t kh├┤ng c├│ khß║Ż n─āng quay quanh trß╗źc li├¬n kß║┐t v├Ā k├®m bß╗ün hŲĪn c├Īc li├¬n kß║┐t kh├Īc.
Luyß╗ćn tß║Łp B├Āi 12 H├│a 10 KNTT
Sau b├Āi hß╗Źc n├Āy, hß╗Źc sinh c├│ thß╗ā:
- Tr├¼nh b├Āy ─æŲ░ß╗Żc kh├Īi niß╗ćm v├Ā lß║źy ─æŲ░ß╗Żc v├Ł dß╗ź vß╗ü li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ (li├¬n kß║┐t ─æŲĪn, ─æ├▓i, ba) khi ├Īp dß╗źng quy tß║»c Octiet.
- Viß║┐t ─æŲ░ß╗Żc c├┤ng thß╗®c Lewis cß╗¦a mß╗Öt sß╗æ chß║źt ─æŲĪn giß║Żn.
- Tr├¼nh b├Āy ─æŲ░ß╗Żc kh├Īi niß╗ćm vß╗ü li├¬n kß║┐t cho - nhß║Łn.
- Ph├ón biß╗ćt ─æŲ░ß╗Żc c├Īc loß║Īi li├¬n kß║┐t (li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c, ph├ón cß╗▒c, li├¬n kß║┐t ion) dß╗▒a theo ─æß╗Ö ├óm ─æiß╗ćn.
- Giß║Żi th├Łch ─æŲ░ß╗Żc sß╗▒ h├¼nh th├Ānh li├¬n kß║┐t ß╗¤ v├Ā li├¬n kß║┐t TT qua sß╗▒ xen phß╗¦ AO.
- Tr├¼nh b├Āy ─æŲ░ß╗Żc kh├Īi niß╗ćm n─āng lŲ░ß╗Żng li├¬n kß║┐t (cß╗Öng ho├Ī trß╗ŗ).
- Lß║»p r├Īp ─æŲ░ß╗Żc m├┤ h├¼nh mß╗Öt sß╗æ ph├ón tß╗Ł c├│ li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ.
3.1. Trß║»c nghiß╗ćm B├Āi 12 H├│a 10 KNTT
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung kiß║┐n thß╗®c ─æ├Ż hß╗Źc ─æŲ░ß╗Żc th├┤ng qua b├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c B├Āi 12 cß╗▒c hay c├│ ─æ├Īp ├Īn v├Ā lß╗Øi giß║Żi chi tiß║┐t.
-
- A. cß╗Öng h├│a trß╗ŗ kh├┤ng cß╗▒c
- B. cß╗Öng h├│a trß╗ŗ c├│ cß╗▒c
- C. liên kết ion
- D. li├¬n kß║┐t cho nhß║Łn
-
- A. K2O
- B. NaF
- C. HF
- D. N2
-
Câu 3:
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc h├¼nh th├Ānh giß╗»a hai nguy├¬n tß╗Ł bß║▒ng
- A. một electron chung.
- B. sß╗▒ choŌłÆnhß║Łn proton
- C. mß╗Öt cß║Ęp electron g├│p chung.
- D. mß╗Öt hay nhiß╗üu cß║Ęp electron chung
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK B├Āi 12 H├│a 10 KNTT
C├Īc em c├│ thß╗ā xem th├¬m phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c B├Āi 12 ─æß╗ā gi├║p c├Īc em nß║»m vß╗»ng b├Āi hß╗Źc v├Ā c├Īc phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp.
Hoß║Īt ─æß╗Öng trang 58 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Źc 1 trang 58 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Źc 2 trang 59 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 3 trang 61 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 4 trang 61 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 5 trang 62 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi c├óu hß╗Åi 6 trang 62 SGK H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.1 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.2 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.3 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.4 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.5 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.6 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.7 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.8 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.9 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.10 trang 32 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.11 trang 33 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.12 trang 33 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.13 trang 33 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.14 trang 33 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.15 trang 33 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Giß║Żi b├Āi 12.16 trang 33 SBT H├│a hß╗Źc 10 Kß║┐t nß╗æi tri thß╗®c - KNTT
Hß╗Åi ─æ├Īp B├Āi 12 H├│a hß╗Źc 10 KNTT
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ thß║»c mß║»c hay cß║¦n trß╗Ż gi├║p g├¼ th├¼ c├Īc em h├Ży comment ß╗¤ mß╗źc Hß╗Åi ─æ├Īp, Cß╗Öng ─æß╗ōng H├│a hß╗Źc HOC247 sß║Į hß╗Ś trß╗Ż cho c├Īc em mß╗Öt c├Īch nhanh ch├│ng!
Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt v├Ā lu├┤n ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp!








